抗新型冠状病毒候选药物研究现状
罗丹,邓永强,秦成峰
军事科学院军事医学研究院微生物流行病研究所,北京 100071
自2002年以来,β-冠状病毒共导致了三次重大传染病疫情的暴发,包括2002-2003年的严重急性呼吸综合征(SARS)和2012年的中东呼吸综合征(MERS),以及2019年底发现的由新型冠状病毒(severe acute respiratory syndrome-coronavirus 2,SARS-CoV-2)引起的新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)[1]。与SARS的病死率(10%)相比,COVID-19的病死率低,约为3.7%,但其传染性高[2]。截至2021年4月19日,全球累计确诊新冠肺炎1.4亿例以上,累计死亡302.6万例。目前还没有针对COVID-19的特效药,但已有多个候选药物在临床前或临床研究阶段获得了乐观的试验结果[3]。本文主要总结了COVID-19的潜在治疗药物,并介绍它们的作用机制、安全性及有效性。
1 SARS-CoV-2的生物学特性
SARS-CoV-2属于单正链RNA包膜病毒,通常为球形,直径60~140 nm,外观形似日冕[4]。SARS-CoV-2基因组由29 903个核苷酸组成[5],且与严重急性呼吸综合征冠状病毒(SARS-CoV)基因组序列有79.6%的相似度[6]。SARS-CoV-2基因组分为非结构蛋白编码区与结构蛋白编码区(图1),共编码29种蛋白[5]。非蛋白编码区编码16种非结构蛋白(non-structural proteins,NSP),其中NSP7、NSP8及NSP12形成RNA依赖的RNA聚合酶(RNA dependent RNA polymerase,RdRp),在病毒的复制及转录周期中发挥重要作用;而NSP3、NSP5可使其他NSP从复制-转录复合物(replication-transcription complex,RTC)中释放出来,NSP3即木瓜蛋白酶(papain like protease,PLpro),NSP5即3C蛋白酶(3C-like proteinase,3CLpro)或主蛋白酶(main protease,Mpro)。因此,RdRp、PLpro及3CLpro可作为抑制病毒复制的药物靶标。结构蛋白编码区主要编码刺突(spike,S)蛋白、包膜(envelope,E)蛋白、膜(m e m b r a n e,M)蛋白及核衣壳(nucleocapsid,N)蛋白,4种结构蛋白形成冠状病毒外层,保护内部的RNA。研究发现,SARS-CoV-2依赖丝氨酸蛋白酶TMPRSS2启动S蛋白[7],利用S蛋白与血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)结合[1],通过细胞内吞作用进入宿主细胞[8]。近期发现,在ACE2存在的情况下,嗅上皮细胞与嗅神经细胞上高表达另一种受体——神经纤毛蛋白(neuropilin-1,NRP1)受体[9-10],NRP1可通过与S蛋白亚单位S1结合,增强SARS-CoV-2感染宿主细胞的能力。因此,TMPRSS2、S蛋白、ACE2及NRP1同样是抗SARS-CoV-2药物研究的重要靶点。此外,SARS-CoV-2还编码9种有助于改变胞内环境、促进病毒复制的辅助蛋白。

图1 SARS-CoV-2基因编码蛋白Fig.1 Proteins encoded by SARS-CoV-2 genome
2 病毒靶向药物
2.1 阿比朵尔(arbidol) 阿比朵尔是一种血凝素抑制剂,可抑制流感病毒脂质囊膜与宿主细胞膜的接触、吸附及融合。目前包括回顾性队列研究、病例报告在内的证据都显示,阿比朵尔单独或联合抗病毒药物治疗COVID-19有一定疗效[11-14],并能改善COVID-19患者的肺部CT影像,提高鼻咽拭子转阴率[15]。
2.2 氯喹(chloroquine,CQ)及羟氯喹(hydroxychloroquine,HCQ) CQ及HCQ广泛用于治疗疟疾及自身免疫性疾病,可作用于病毒囊膜发挥抗病毒活性。体外研究显示,CQ、HCQ在SARS-CoV-2细胞进入及进入后阶段均起作用[16],其半最大效应浓度(EC50)分别为2.71、4.51 μmol/L[17]。然而,有临床研究发现,口服HCQ会使COVID-19患者的QT间期延长,患者出现心律不齐及心脏性猝死的风险较高[18]。同时,另外几项大型随机对照试验研究也证明CQ抗SARS-CoV-2的作用不明显,且不良反应多[19-20]。
2.3 S蛋白靶向药物 S蛋白在病毒识别宿主受体、吸附及进入细胞等过程中发挥重要作用。目前发现的几种S蛋白靶向药物见表1。
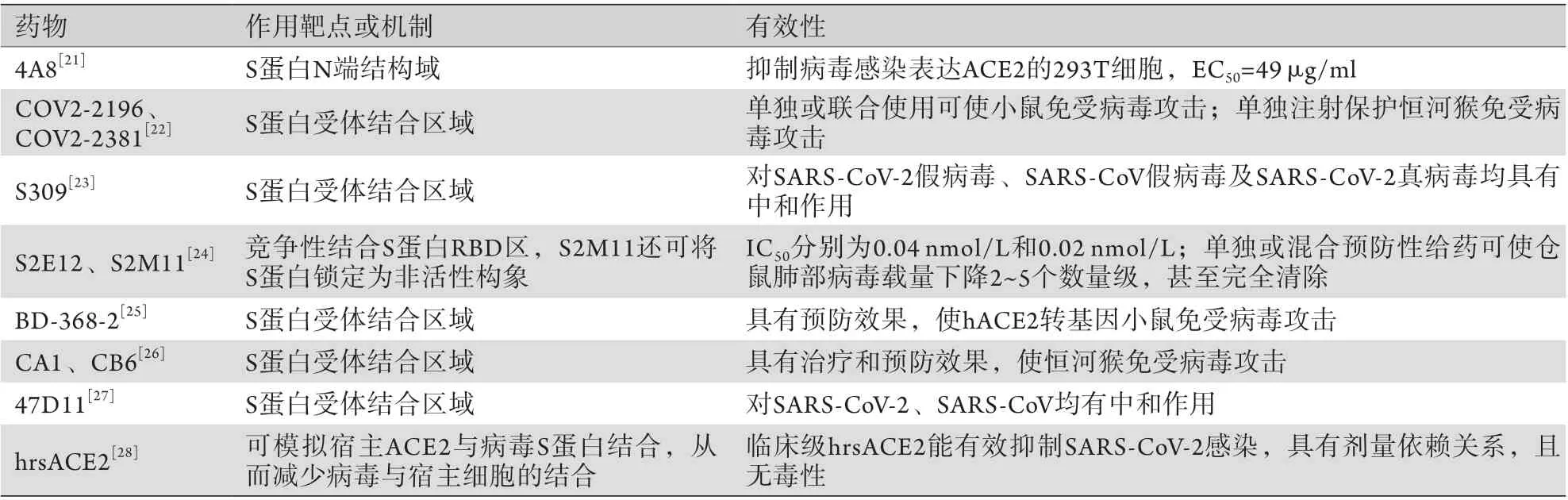
表1 S蛋白靶向药物Tab.1 Drugs targeting spike protein
2.4 PLpro及3CLpro抑制剂
2.4.1 洛匹那韦/利托那韦(lopinavir/ritonavir,LPV-r) 研究发现,LPV-r可通过抑制冠状病毒PLpro及3CLpro发挥抗病毒活性[29-30],且有多项临床证据表明,LPV-r可改善SARS或MERS重症患者的急性呼吸窘迫综合征(ARDS),从而改善患者预后[29,31-32]。最近一项回顾性队列研究指出,LPV-r与阿比朵尔联合治疗可改善COVID-19患者的肺部CT影像学表现,对病毒转阴也有促进作用[15]。然而,其他临床试验则显示,LPV-r治疗并不能降低28 d内死亡人数[33],且LPV-r治疗还会出现急性肾损伤及继发性感染等严重并发症[34]。
2.4.2 N3、11a及11b N3是一种Michael受体抑制剂,能与SARS-CoV-2的3CLpro形成共价键,是一种不可逆的3CLpro抑制剂。体外实验表明,N3可显著抑制SARS-CoV-2对Vero细胞的感染,其EC50为16.77 μmol/L[35]。基于3CLpro的三维结构,研究人员还设计合成了拟肽类化合物11a、11b,并通过空斑试验测定出11a、11b对SRAS-CoV-2同样具有较好的抑制作用,其EC50分别为0.53、0.72 μmol/L[36]。2.5 RdRp抑制剂
2.5.1 瑞德西韦(remdesivir) 瑞德西韦属于核苷酸类似物,最初是为了控制埃博拉病毒而开发[37],随后证实其在体外可干扰病毒RdRp,具有抗SARSCoV、MERS-CoV等冠状病毒的活性[38-39]。然而,目前瑞德西韦对COVID-19的疗效仍存在争议。有研究对53例采用瑞德西韦治疗的重症COVID-19患者进行随访,发现在平均18 d的随访中,大部分患者的临床症状有缓解或出院,仅有7例死亡,表明瑞德西韦治疗COVID-19是有希望的[40]。但另一项涉及237例的研究则显示,与安慰剂相比,瑞德西韦治疗的COVID-19重症患者在临床症状消失时间、病死率及病毒清除时间等方面无明显改善[41]。
2.5.2 法匹拉韦(favipiravir) 法匹拉韦具有广泛的抗病毒活性,可通过抑制病毒RdRp而干扰病毒基因组的复制。研究发现,无论是采用定量RTPCR法还是免疫荧光法,法匹拉韦均可明显抑制SARS-CoV-2在Vero E6细胞中的复制,其EC50为61.88 μmol/L[16]。此外,一项回顾性研究也表明法匹拉韦治疗COVID-19中度感染患者在7 d恢复率及症状缓解时间方面优于阿比朵尔[42]。但法匹拉韦单药治疗大样本病例的有效性及安全性还需进一步研究。
2.5.3 EIDD-2801 EIDD-2801是基于核苷酸类似物EIDD-1931而设计的新药,该药通过模拟核糖核酸结合到病毒RNA中,导致病毒在RNA合成过程中出现致死性突变,抑制病毒复制所需的RdRp。体外实验显示,EIDD-2801不仅对SARS-CoV、MERSCoV及SARS-CoV-2具有抑制作用,对其他冠状病毒甚至瑞德西韦耐药毒株也同样具有较强的抗病毒活性,其对SARS-CoV-2的IC50为0.3 μmol/L[43-44]。
3 宿主靶向药物
3.1 丝氨酸蛋白酶TMPRSS2抑制剂 SARS-CoV-2进入细胞需要宿主TMPRSS2活化S蛋白。体外实验证实,甲磺酸卡莫司他(camostat mesilate)可通过抑制TMPRSS2降低SARS-CoV-2对Calu-3细胞的感染[7]。另外,TMPRSS2抑制剂甲磺酸萘莫司他(nafamostat mesilate)对SARS-CoV-2感染也有抑制作用,其EC50为22.50 μmol/L[16]。
3.2 二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)抑制剂 S312与S416是两个靶向宿主细胞DHODH的抑制剂,可通过抑制病毒基因组复制与免疫调节作用而发挥广谱抗病毒活性。有研究将S312、S416与病毒在Vero细胞上共培养24 h,然后用定量RT-PCR法对细胞上清中的病毒RNA进行检测,结果显示S312、S416均具有高效抗SARSCoV-2活性,其EC50分别为1.56、0.017 μmol/L[45],其中S416的选择指数大于5882。
PTC299也是一种DHODH抑制剂。有研究用不同浓度的PTC299预处理Vero细胞24 h,然后再用感染复数(MOI)=0.05的SARS-CoV-2感染细胞48 h,最后用免疫荧光法定量检测细胞内的病毒蛋白,结果显示,PTC299可使细胞内的病毒载量明显降低,呈剂量依赖关系,其EC50为1.96 nmol/L[46]。
3.3 免疫调节剂 巴瑞替尼(baricitinib)是一种酪氨酸激酶抑制剂,不仅可通过劫持细胞因子信号通路来阻止过度的免疫反应,还可调节细胞内吞作用,阻止SARS-CoV-2进入宿主细胞[8,47-48]。托西珠单抗(tocilizumab)则可通过抑制白细胞介素-6,防止SARS-CoV-2导致的细胞因子风暴引起过度免疫反应[49-50]。回顾性研究表明,托西珠单抗可缓解COVID-19患者发热、低氧血症等临床症状及CT影像学表现,且未见明显的不良反应[51]。
3.4 辅助治疗药物
3.4.1 皮质类固醇 皮质类固醇可降低毛细血管通透性并抑制炎性细胞水平,从而减轻肺部炎症反应。一项回顾性研究发现,对于发生了ARDS的COVID-19患者,用甲泼尼龙治疗可降低死亡风险[52]。另一项大规模临床试验也显示,地塞米松使COVID-19重症患者的病死率降低了1/3[53]。然而,高剂量皮质类固醇可能会导致继发性感染、病毒清除延迟及病毒耐药性的出现,因此必须谨慎使用。3.4.2 肝素 有研究发现,接受肝素抗凝治疗的COVID-19重症患者的预后更佳[54-55],因此新型肝素类化合物的开发具有重要意义,但未来仍需要大样本的临床研究证实肝素对COVID-19的治疗作用。
3.4.3 维生素 动物实验证实,维生素C可保护肺屏障功能,并通过减轻炎症反应及凝固性改变来减轻肺血管损伤[56-57];维生素D则通过诱导抗菌肽的产生、降低病毒复制速度从而阻止促炎细胞因子的产生[58]。目前,维生素D治疗COVID-19患者的临床试验正在进行中。
4 总结与展望
COVID-19大流行是21世纪以来人类面临的最大全球公共卫生危机,但目前仍无安全有效的药物应用于临床治疗。当前面临的主要挑战包括:(1)缺乏能够完全模拟人类COVID-19患者疾病特征的动物模型,导致许多药物的临床前研究受限;(2)许多药物虽在临床前实验中显示出良好的抗病毒活性,但缺乏有说服力的临床试验数据;(3)老药新用策略未在临床试验中显示出明显优势,没有确切证据证实哪种现有药物可提高病毒清除率;(4)由于不同地区的疫情严重程度不同,病例分散且数量较少的地区开展临床试验的可行性相对较低;(5)新型冠状病毒易发生突变,增加了特异性药物的研发难度。
就现有的抗新型冠状病毒药物研究结果而言,病毒靶向的中和抗体最有希望成为缓解COVID-19疫情的药物,虽然SARS-CoV-2中和逃逸株的出现可能会限制抗体疗效,但针对刺突蛋白不同位点的抗体鸡尾酒疗法有助于防止病毒产生耐药性(表2)。
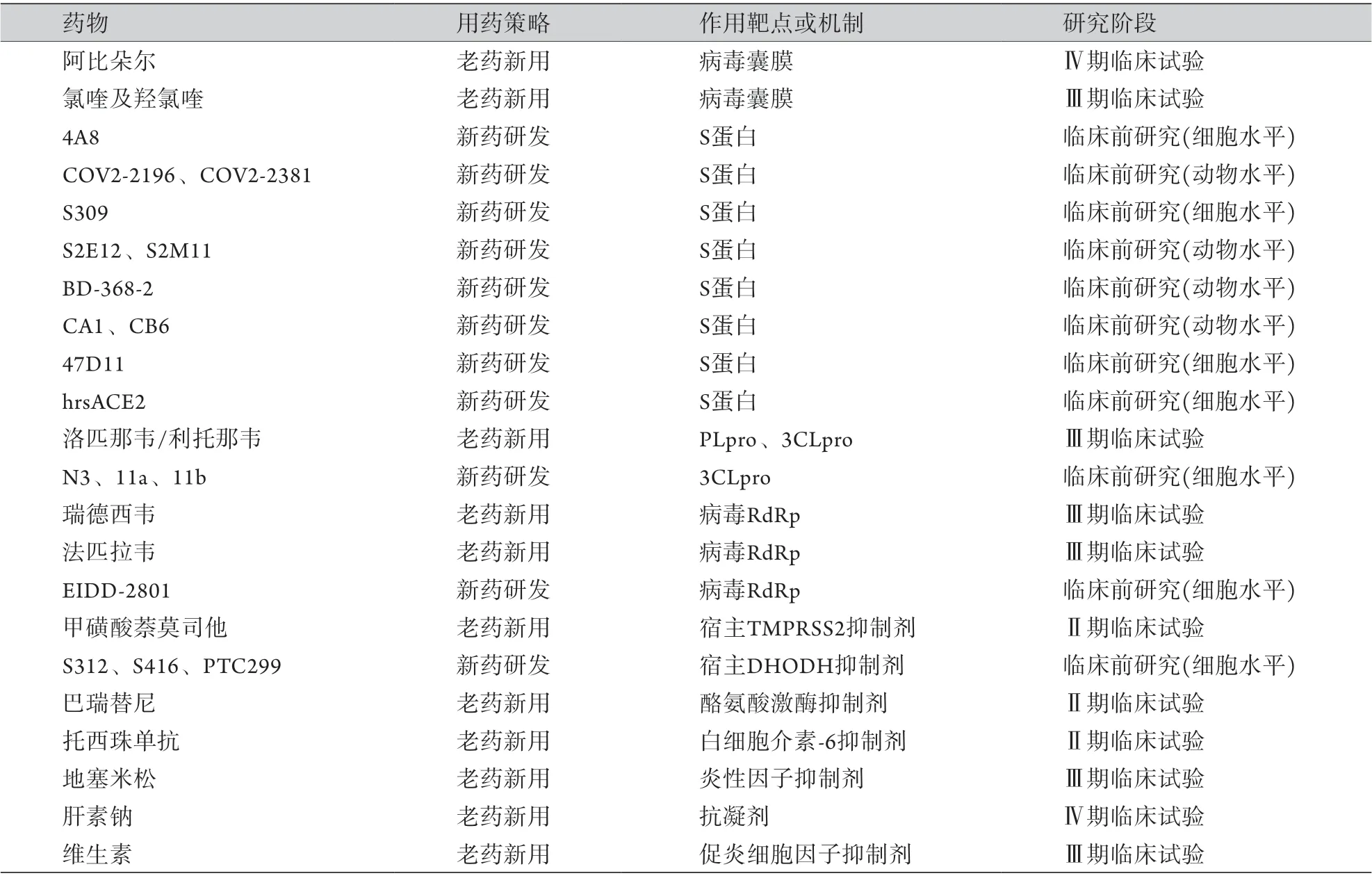
表2 抗新型冠状病毒药物研究现况Tab.2 Research status of candidate drugs against SARS-CoV-2
此外,研发宿主靶向药物也是未来突破病毒耐药问题不可或缺的方向。同时,高通量筛选、人工智能及计算机辅助药物设计等多学科新兴技术的结合运用,也将成为未来新药研发的主流趋势。

