Z-没药甾酮经ERK/MAPK通路对糖尿病大鼠皮肤溃疡的祛腐生肌作用及机制
李洋,陈庆良,张帆
1天津医科大学研究生院,天津 300070;2天津市胸科医院心血管外科,天津 300222;3河北医科大学第二医院影像科,石家庄 050061
糖尿病是一组以慢性高血糖为特征的全身代谢性疾病,随着病情进展可出现各种并发症,其中糖尿病足坏疽为常见的严重并发症之一,轻则致足部溃疡,重则致残[1]。糖尿病足是一种进行性、慢性、涉及肢体血管与外周神经的特殊疾病,在中医学中归为“脱疽”范畴,临床表现为肢端疼痛、麻木、溃疡、感染等。关于糖尿病足坏疽的治疗方法,从总体来讲是降血糖、控制感染、清创换药,但从局部来讲,皮肤溃疡治疗是炎性细胞与修复细胞等共同参与的复杂生理网络过程[2]。历代中医学者对脱疽有深入研究,发现没药有祛瘀散血、消肿生肌、止痛活血的功效[3]。Z-没药甾酮(Z-guggulsterone,Z-GS)为其主要药效物质,有消炎、促进创面愈合的作用[4]。本研究通过建立糖尿病皮肤溃疡大鼠模型,进一步观察Z-GS治疗皮肤溃疡的作用并探讨其可能机制,旨在为相关药物的开发提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 7周龄SPF级SD大鼠65只,雌雄各半,体重250~270 g,购自天津市中医药大学第一附属医院[动物实验许可证号:SCXK(津)2015-0003;批号:0079418]。实验前适应性饲养1周,饲养环境温度(22±2) ℃,湿度55%~75%,12 h循环光照,自由摄食、饮水。实验过程符合国家及单位实验动物管理规定。
1.1.2 药物、主要试剂及仪器 Z-G S(纯度≥90%,上海甄准生物科技有限公司),链脲佐菌素(货号S0130,上海佰世凯化学科技有限公司),ERK抑制剂PD98059(货号P215,北京百奥莱博科技有限公司),复方磺胺嘧啶锌凝胶剂(批号171203,成都第一药物研究所有限公司),白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫试剂盒(上海抚生实业有限公司),兔抗鼠CD34单克隆抗体、酶标山羊抗小鼠/兔IgG聚合物(上海碧云天生物技术有限公司),兔抗大鼠细胞外调节蛋白激酶(extracellular regulated protein kinase1/2,ERK1/2)、磷酸化ERK1/2(p-ERK1/2)、促丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷酸化MAPK(p-MAPK)、GAPDH单克隆抗体以及辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗(北京百奥莱博科技有限公司)。HM-200电子天平(上海双旭电子有限公司),64R高速冷冻离心机(美国Beckman公司),Model ELX800酶标仪(美国Bio-Tek公司),GELDOC2000凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 造模及分组 10只大鼠设为健康组,其余55只大鼠建立糖尿病皮肤溃疡模型[5],取0.1 mol/L枸橼酸钠缓冲液将链脲佐菌素配制成0.45%的溶液,按55 mg/kg体重进行尾静脉注射,72 h后测定血糖,若空腹血糖值为13.5~25.0 mmol/L,则正式纳入皮肤溃疡造模,即对大鼠腰背两侧去毛,以2 cm×2 cm印筐沾龙胆紫染色后印于皮肤,沿筐壁剪开皮肤,深入至浅筋膜,切除2 cm×2 cm面积的皮肤,造成缺损创面,每日涂抹50%冰醋酸,1周后形成缺损型的皮肤溃疡大鼠模型。健康组经尾静脉注射等体积生理盐水,腰背两侧除毛,不做其他处理,用于对比观察55只大鼠是否造模成功。造模成功标准:与健康组比较,造模成功大鼠形体偏瘦,毛色发黄,笼内异味严重,进食量、饮水量、排尿量等明显增多,空腹血糖升高(>16.7 mmol/L)且高于健康组,符合糖尿病的体征与症状,不同时间点的创面发白,分泌物清稀、量少,肉芽生成少且愈合缓慢,符合中医阴证疮疡的指征。造模期间死亡11只,建模成功44只,随机分为模型组、Z-GS组、抑制剂+Z-GS组、阳性对照组(n=11)。
1.2.2 干预与取材 造模成功后检测大鼠空腹血糖值,并于次日开始给药,先以生理盐水擦洗创面,拭去分泌物后清洁创面。模型组以凡士林纱条覆盖创面,阳性对照组予以复方磺胺嘧啶锌凝胶剂(对应创面在纱条上涂抹3 g软膏制剂),Z-GS组予以Z-GS(Z-GS溶于10% DMSO,浓度20 mmol/L)10 μl,抑制剂+Z-GS组予以ERK抑制剂PD98059 300 μg/L+Z-GS 20 mmol/L共计10 μl。1次/d,连续用药4周。在给药1、2、3、4周分别使用透明膜覆盖创面,以记号笔在边缘描画创面大小、形状,方便计算创面愈合率。创面愈合率(%)=(给药前创面面积-给药后创面面积)/给药前创面面积×100%。给药4 周后以2%戊巴比妥钠麻醉大鼠,取创面0.2 cm×0.4 cm大小的肉芽组织,置入4%多聚甲醛溶液中固定。
1.2.3 大鼠血清炎性因子含量测定 在给药4周后,以2%戊巴比妥钠麻醉大鼠,腹主动脉取血3 ml,室温下1500 r/min离心15 min,离心半径10 cm,取上清液,参考酶联免疫试剂盒说明书检测血清IL-8、TNF-α含量,采用酶标仪在492 nm处测定IL-8、TNF-α的光密度值,计算血清IL-8、TNF-α水平。
1.2.4 大鼠溃疡创面的组织病理学观察 取已固定的肉芽组织标本进行梯度乙醇脱水,二甲苯透明,石蜡包埋,连续切片,厚度5 μm。将切片脱蜡至水,浸入苏木精液染色5 min,自来水冲洗,使切片蓝化。蒸馏水冲洗,入伊红染液复染,脱水、分化、透明、封固,镜下观察肉芽组织的形态学结构,细胞核被苏木精染成蓝色,细胞质、结缔组织、嗜酸性颗粒等被染为红色。
1.2.5 免疫组化法检测大鼠创面组织中的微血管含量(MVD) 石蜡包埋、切片(5 μm厚)、脱蜡、脱水步骤同上,PBS洗涤,滴加3% H2O2于切片上,室温静置10 min,PBS洗涤。切片浸入柠檬酸盐修复液中,微波抗原修复。滴入一抗(兔抗鼠CD34单克隆抗体),4 ℃过夜,滴加二抗(酶标山羊抗兔IgG聚合物),DAB显色、复染、脱水、封固,以PBS代替一抗作为阴性对照。参考微血管染色试剂盒说明书,染色后切片。光镜下呈棕褐色或棕黄色颗粒为阳性细胞,随机选6个视野(×100),以背景有明确区别的任意棕褐色或棕黄色的细胞丛为一个血管数量,计算MVD。
1.2.6 Western blotting检测大鼠溃疡组织中ERK/MAPK通路相关蛋白的表达 从-80 ℃冰箱中取出已固定的模型组、Z-GS组、抑制剂+Z-GS组大鼠肉芽组织标本20 mg,加入含有蛋白酶抑制剂的细胞裂解液200 μl中研磨,移入1.5 ml EP管内,4 ℃下12 000 r/min离心15 min,取上清,提取含组织总蛋白的蛋白溶液,置于-20 ℃保存。测定蛋白浓度,沸水浴变性10 min,上样后进行SDS-PAGE电泳,转PVDF膜。将PVDF膜置入5%脱脂奶粉中封闭,4 ℃过夜后加入一抗(1:1000的兔抗大鼠ERK1/2、p-ERK1/2、MAPK、p-MAPK、GAPDH单克隆抗体),室温孵育2 h,TBST洗膜,加入二抗(1:5000的HRP标记的山羊抗兔IgG),室温孵育2 h,TBST洗膜后进行ECL显色反应,曝光、显影、过水、定影。
1.3 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料以表示,均符合正态分布;经方差齐性检验,创面愈合率、血清炎性因子含量等数据方差齐,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;ERK/MAPK通路相关蛋白相对表达量数据方差不齐,采用Welch检验,进一步比较采用DunnettT3检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠皮肤创面愈合率比较 给药1、2、3、4周,模型组、抑制剂+Z-GS组、Z-GS组、阳性对照组的皮肤创面愈合率均持续升高,组间、时间、交互比较差异均有统计学意义(P<0.05)。在给药1、2、3、4周时,与模型组比较,抑制剂+Z-GS组、Z-GS组、阳性对照组皮肤创面愈合率较高(P<0.05);与阳性对照组比较,抑制剂+Z-GS组、Z-GS组皮肤创面愈合率较低(P<0.05);与Z-GS组比较,抑制剂+Z-GS组皮肤创面愈合率较低(P<0.05)(表1)。
表1 各组大鼠皮肤创面愈合率比较(%,±s,n=11)Tab.1 Comparison of the healing rate of skin wound of rats in each group (%, ±s, n=11)
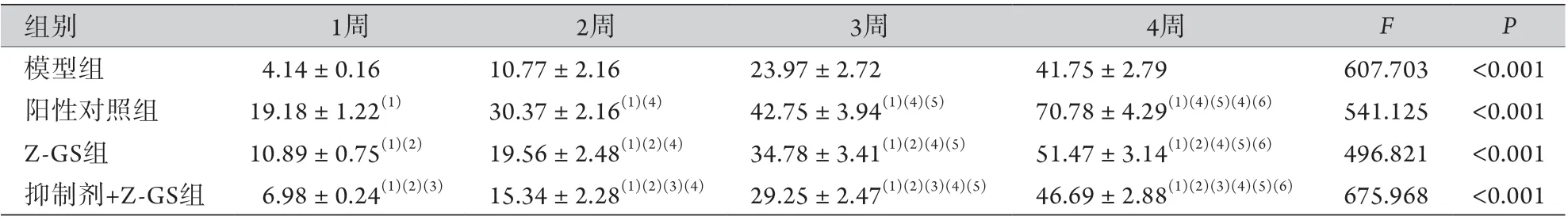
表1 各组大鼠皮肤创面愈合率比较(%,±s,n=11)Tab.1 Comparison of the healing rate of skin wound of rats in each group (%, ±s, n=11)
GS. Z-没药甾酮;F组间=16.399,P组间<0.001;F时间=25.695,P时间<0.001;F交互=34.785,P交互<0.001;与模型组比较,(1)P<0.05;与阳性对照组比较,(2)P<0.05;与Z-GS组比较,(3)P<0.05;与1周比较,(4)P<0.05;与2周比较,(5)P<0.05;与3周比较,(6)P<0.05。
组别1周2周3周4周FP模型组4.14±0.1610.77±2.1623.97±2.7241.75±2.79607.703<0.001阳性对照组19.18±1.22(1)30.37±2.16(1)(4)42.75±3.94(1)(4)(5)70.78±4.29(1)(4)(5)(4)(6)541.125<0.001 Z-GS组10.89±0.75(1)(2)19.56±2.48(1)(2)(4)34.78±3.41(1)(2)(4)(5)51.47±3.14(1)(2)(4)(5)(6)496.821<0.001抑制剂+Z-GS组6.98±0.24(1)(2)(3)15.34±2.28(1)(2)(3)(4)29.25±2.47(1)(2)(3)(4)(5)46.69±2.88(1)(2)(3)(4)(5)(6)675.968<0.001
2.2 大鼠血清炎性因子水平变化 大鼠血清IL-8、TNF-α水平组间比较差异均有统计学意义(P<0.05)。其中,与模型组比较,抑制剂+Z-GS组、Z-GS组、阳性对照组IL-8、TNF-α水平明显降低(P<0.05);与阳性对照组比较,抑制剂+Z-GS组、Z-GS组IL-8、TNF-α水平明显升高(P<0.05);与Z-GS组比较,抑制剂+Z-GS组IL-8、TNF-α水平明显升高(P<0.05)(表2)。
表2 各组血清炎性因子水平(pg/g,±s,n=11)Tab.2 Serum levels of inflammatory factors of rats in each group (pg/g, ±s, n=11)

表2 各组血清炎性因子水平(pg/g,±s,n=11)Tab.2 Serum levels of inflammatory factors of rats in each group (pg/g, ±s, n=11)
Z-GS. Z-没药甾酮;与模型组比较,(1)P<0.05;与阳性对照组比较,(2)P<0.05;与Z-GS组比较,(3)P<0.05。
组别IL-8TNF-α模型组258.15±7.9580.21±7.45阳性对照组177.56±5.18(1)50.45±2.12(1)Z-GS组204.11±6.71(1)(2)61.48±3.64(1)(2)抑制剂+Z-GS组233.18±8.48(1)(2)(3)73.16±4.26(1)(2)(3)F 260.10882.646 P<0.001<0.001
2.3 大鼠皮肤溃疡创面的病理学观察结果 模型组大鼠新生表皮菲薄,真皮有大量炎性细胞浸润,散见成纤维细胞,毛细血管、胶原纤维少见。与模型组比较,阳性对照组新生皮肤结构近完整,炎性细胞浸润少见,毛细血管含量丰富,胶原纤维较粗;抑制剂+Z-GS组、Z-GS组表皮明显增厚,创面覆盖较厚痂皮,炎性细胞浸润减少,毛细血管含量丰富,胶原纤维细少;与阳性对照组比较,抑制剂+Z-GS组、Z-GS组新生皮肤欠完整,炎性细胞浸润相对较多,毛细血管、胶原纤维欠丰富(图1)。
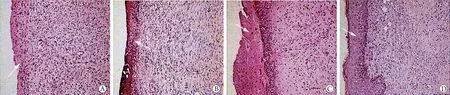
图1 大鼠皮肤溃疡创面病理学观察(HE ×40)Fig.1 Pathology of skin ulcer wounds of rats (HE ×40)
2.4 大鼠皮肤溃疡创面中的MVD CD34为常用的血管内皮细胞特异性标记物,表达于血管内皮细胞的细胞质。给药4周后,模型组、抑制剂+Z-GS组、Z-GS组、阳性对照组大鼠创面MVD分别为(3.33±0.67)条/mm2、(5.14±0.48)条/mm2、(8.63±0.47)条/mm2、(14.78±0.49)条/mm2,呈逐渐增高趋势(P<0.05,图2)。

图2 大鼠皮肤溃疡创面中的MVD(免疫组化染色 ×100)Fig.2 Microvessel density in rat skin ulcer wounds (Immunohistochemistry ×100)
2.5 大鼠皮肤溃疡组织中E R K/M A P K 通路相关蛋白的表达水平 大鼠创面组织中ERK1/2、M A P K 蛋白相对表达量组间比较差异均无统计学意义(P>0.05)。与模型组比较,抑制剂+Z-GS组、Z-GS组p-ERK1/2、p-MAPK蛋白表达水平较高(P<0.05);与Z-GS组比较,抑制剂+Z-GS组p-ERK1/2、p-MAPK蛋白表达水平较低(P<0.05)(表3、图3)。

图3 Western blotting检测大鼠皮肤溃疡组织ERK/MAPK通路相关蛋白表达Fig.3 Protein expression of ERK/MAPK pathway in rats' skin ulcer tissue by Western blotting
表3 各组大鼠皮肤溃疡组织中ERK/MAPK通路相关蛋白表达水平(±s,n=11)Tab.3 Expression levels of ERK/MAPK pathway related proteins in skin ulcer tissues of rats in each group (±s, n=11)

表3 各组大鼠皮肤溃疡组织中ERK/MAPK通路相关蛋白表达水平(±s,n=11)Tab.3 Expression levels of ERK/MAPK pathway related proteins in skin ulcer tissues of rats in each group (±s, n=11)
与模型组比较,(1)P<0.05;与Z-GS组比较,(2)P<0.05。
组别ERK1/2p-ERK1/2MAPKp-MAPK模型组0.75±0.110.22±0.030.56±0.150.12±0.03 Z-GS组0.71±0.110.42±0.06(1)0.52±0.090.35±0.05(1)抑制剂+Z-GS组0.74±0.150.35±0.04(1)(2)0.51±0.110.24±0.02(1)(2)F 0.31083.6590.418152.908 P 0.818<0.0010.741<0.001
3 讨 论
慢性皮肤溃疡多因手术切口、意外创伤、糖尿病、下肢静脉曲张等引起,属于临床难治性疾病。近年来,伴随糖尿病发生率的增高,糖尿病所致并发症——皮肤溃疡也随之增多,国外报道糖尿病患者一生中有25%的概率并发糖尿病足坏疽,是导致患者截肢的主要原因[6]。糖尿病足坏疽与下肢远端神经异常、周围血管病变相关,病因复杂,发病机制涉及细胞、分子、基因等,但其具体机制目前尚不清楚,目前多认为与骨质异常、外周神经疾病、伤口微循环障碍、伤口愈合有关蛋白质表达等有关[7]。对于中药促进创面愈合的作用机制,目前多从促进创面血液循环、创面修复、细胞信号传导通路等方面进行探索。Z-GS为中药没药的主要活性成分,具有抗炎、抗氧化、改善血管内皮功能等作用,应用前景广阔,已证实其在局灶性脑缺血、缺血性脑卒中的治疗中有促进新生血管网络建立等作用,因此推测将其用于皮肤溃疡的治疗具有一定可行性[8]。
本研究采用注射链脲佐菌素+皮肤缺损的方法建立糖尿病皮肤溃疡大鼠模型,其症状表现、创面愈合率变化(呈时间依赖性)基本符合慢性皮肤溃疡的造模要求。在实验的不同时间点,从模型组到抑制剂+Z-GS组、Z-GS组,大鼠皮肤创面愈合率依次升高,提示Z-GS可促进糖尿病大鼠皮肤溃疡创面的愈合。HE染色结果显示,与模型组比较,Z-GS组溃疡处新生表皮厚度、结构及炎症浸润等明显改善,进一步提示Z-GS在创面愈合中具有祛腐生肌的作用。IL-8、TNF-α是促炎症反应中最活跃的细胞因子,在创面修复乃至机体生存中均具有重要作用[9-10]。IL-8主要生物学功能为将中性粒细胞、T淋巴细胞趋化到病灶部位,发挥促炎作用。TNF-α是诱发感染性疾病的重要炎症机制,其生物学活性广泛,既可杀伤或抑制肿瘤细胞,亦可增强中性粒细胞的吞噬功能,刺激IL-8分泌,引发恶病质、感染性休克等[11]。强烈、持续的炎症反应可杀伤正常细胞,阻碍创面修复。本研究结果显示,Z-GS组大鼠血清IL-8、TNF-α水平均低于模型组,提示Z-GS可通过降低炎性因子水平促进皮肤创面的愈合[12]。创面愈合是一个连续、复杂的过程,肉芽组织形成是创面修复愈合的关键步骤,因此创面新生血管生成具有重要意义[13]。CD34是血管内皮的标志物,选择性表达于小血管内皮细胞,经免疫组化实验可标记创面肉芽组织切片中的微血管[14]。本研究发现,Z-GS组皮肤创面MVD高于模型组,提示Z-GS可促进创面微血管生成,加速肉芽组织生长,改善微循环,从而发挥去腐生肌的作用。
ERK/MAPK通路是炎性因子、生长因子、细胞因子等多种因子发挥作用的主要信号转导通路,是调节细胞生长、发育、分裂的信号网络核心[15]。MAPK广泛存在于真核细胞的细胞质中,是高度保守的一类丝氨酸蛋白酶,是多种细胞因子向核内传导信号的公共途径,调控机体的诸多生理活动,参与细胞分化、增殖、分裂与凋亡等过程。ERK是MAPK家族中的一员,其触发因素包括多种蛋白、激酶、细胞因子、生长因子等[16]。ERK1/2是以脯氨酸为导向的丝氨酸/苏氨酸蛋白激酶,具有广泛的催化活性,激活后可进入细胞核,磷酸化底物,促进细胞增殖。肖敏等[17]发现,慢性皮肤溃疡创面长期不愈合与炎症反应、ERK/MAPK通路有关。近年来,ERK/MAPK通路在溃疡发病过程中的作用备受关注,彭海娟等[18]发现,ERK信号通路可促进溃疡性结肠炎大鼠肠上皮细胞的分化与增殖,并抑制凋亡,提示ERK信号通路与溃疡愈合有关。本研究结果显示,从模型组到抑制剂+Z-GS组、Z-GS组,大鼠创面组织中p-ERK1/2、p-MAPK蛋白表达水平依次升高,提示Z-GS可能是通过激活ERK/MAPK通路来治疗皮肤溃疡的。
综上所述,Z-GS可能通过激活ERK/MAPK通路对糖尿病大鼠皮肤溃疡发挥祛腐生肌作用。因条件受限,本研究样本量较小,且仅检测了ERK/MAPK通路蛋白的表达,皮肤溃疡的病理机制及Z-GS的治疗机制均较复杂,该药物治疗皮肤溃疡是否通过其他信号通路,仍有待进一步深入研究。

