腺苷通路在肿瘤免疫中的作用研究进展
俞阳,张安琪,高磊,尹振宇,刘乾,白玉萍,刘乐,齐文博,陈昊
1兰州大学第二医院肿瘤外科,兰州 730030;2兰州大学第二临床医学院肿瘤外科,兰州 730030;3北京大学第六医院/北京大学精神卫生研究所/国家卫生健康委员会精神卫生学重点实验室(北京大学)/国家精神心理疾病临床医学研究中心(北京大学第六医院),北京 100191
肿瘤的发生发展与机体免疫状况密切相关,抗肿瘤免疫有赖于体内的T细胞、树突细胞(dendritic cells,DCs)、自然杀伤细胞(natural killer cells,NK)以及巨噬细胞等的识别和清除。人体免疫系统具有多种调节机制,可调节免疫反应的持续性和强度[1-2]。其中,免疫检查点为免疫系统中的抑制性调节信号,可保护正常组织免受自身免疫的攻击或免疫的过度激活。而肿瘤利用这一特点,通过过度表达免疫检查点分子,传递抑制信号,从而逃避免疫系统的识别和杀伤[3]。近年来,针对免疫检查点阻断剂的研究取得了重大进展[4]。多种免疫检查点抑制剂(如抗PD-1、PD-L1和CTLA-4抗体等)已被批准上市,在非小细胞肺癌(non-small cell lung carcinoma,NSCLC)、肾细胞癌、膀胱癌、头颈部癌、黑色素瘤,以及微卫星不稳定肿瘤等多种肿瘤中展现了确切的疗效[5-6]。尽管免疫检查点抑制剂具有强大的疗效,但研究发现仅少部分患者能从中获益,大部分患者仍然疗效不明[7],亟需寻找新的分子通路以为肿瘤的免疫分型、免疫治疗与预后分析等提供新思路。腺苷通路是一条与肿瘤免疫逃逸相关的重要通路,肿瘤主要通过增高微环境中的腺苷水平来产生免疫抑制信号[8]。本文系统回顾了相关文献,对腺苷通路在肿瘤免疫中的作用机制及其潜在的临床应用价值进行综述,旨在为肿瘤免疫的临床和基础研究提供参考。
1 CD39-CD73-腺苷通路
1.1 组成与信号转导 腺苷是调节外周免疫反应并维持机体稳态的重要分子。腺苷主要由胞外三磷酸腺苷(adenosine triphosphate,ATP)代谢产生,在生理情况下,正常组织的细胞外腺苷和ATP维持着较低的浓度,但在病理条件下,如机体组织出现炎症、缺血或缺氧时,组织中各类细胞可快速释放ATP到细胞外,造成胞外短暂的ATP高浓度[9-10]。作为刺激信号,ATP可激活免疫反应。随后,进入胞外的ATP很快被外核酸酶CD39和CD73去磷酸化,形成腺苷。不同于ATP的作用,腺苷主要产生抑制免疫反应的信号。这些病理生理过程共同调节机体恢复稳态(图1)。
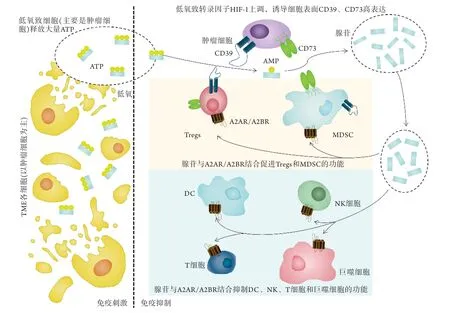
图1 腺苷的产生及其作用信号通路Fig.1 Adenosine production and action signaling pathways
在肿瘤微环境中,细胞外存在高浓度的ATP,这主要是由于肿瘤微环境的缺氧特征可导致死亡的细胞(主要为肿瘤细胞)破裂释放大量ATP,造成ATP过度累积[11]。ATP随即在外核酸酶CD39和CD73的作用下产生腺苷。外核酸酶CD39和CD73是腺苷通路中的关键分子,前者水解胞外ATP和二磷酸腺苷(adenosine diphosphate,ADP)转化成单磷酸腺苷(adenosine monophosphate,AMP),随后在后者的作用下生成腺苷。CD39和CD73表达于肿瘤微环境中的各类细胞,包括基质细胞、肿瘤细胞、浸润免疫细胞及上皮细胞等,尤其在肿瘤细胞和部分浸润免疫细胞中高表达[12-13],协同诱导产生高浓度腺苷环境[14]。同时,缺氧可激活缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1),进一步上调各细胞表面CD39和CD73分子的表达[13,15]。因此,肿瘤微环境中腺苷通路被过度激活,肿瘤细胞处于高浓度腺苷环境中。
1.2 腺苷通路的促肿瘤免疫逃逸功能 在肿瘤的发生发展过程中,腺苷对于肿瘤获得免疫逃逸起到了重要作用。腺苷通过P1型嘌呤受体[腺苷A1受体(adenosine A1 receptor,A1R)、腺苷A2A受体(adenosine A2A receptor,A2AR)、腺苷A2B受体(adenosine A2B receptor,A2BR)、腺苷A3受体(adenosine A3 receptor,A3R)]发挥相应的功能。腺苷受体属于G蛋白偶联受体家族,主要表达于各种类型的免疫细胞。目前认为,腺苷诱导的肿瘤免疫抑制主要与A2AR和A2BR密切相关,前者为高亲和性受体,表达于T细胞、NK细胞、单核细胞、巨噬细胞和DCs;后者为低亲和性受体,主要表达于巨噬细胞和DCs[16]。腺苷与各类免疫细胞上的腺苷受体(A2AR和A2BR)结合后,导致胞内环腺苷酸(cyclic adenosine monophosphate,cAMP)水平增高,从而减轻机体炎症效应,抑制免疫反应。
首先,腺苷可抑制或影响效应免疫细胞的成熟、分化及其功能。腺苷通过A2AR和A2BR抑制单核细胞分化成巨噬细胞,促进巨噬细胞由促炎的M1型转向抗炎的M2型[17]。对于DCs,腺苷通过A2AR和A2BR抑制其抗原提呈能力,同时诱导DCs分泌促血管及免疫抑制因子[如白介素10(interleukin 10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)、精氨酸酶和3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)等][18]。腺苷通过A2AR抑制NK细胞的成熟,使其杀伤活性显著下降。对于T细胞,腺苷激活A2AR可抑制CD4+T细胞产生IL-2,继而引起T细胞上CD28等共刺激分子的表达下调[19];腺苷通过A2AR抑制CD8+T细胞的增殖、分化和成熟,以及IL-2、干扰素-γ(interferon gamma,INF-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等细胞因子的产生[16,20-21]。类似地,高浓度的腺苷通过A2AR抑制B细胞的增殖、分化、成熟及细胞因子的产生。其次,对于免疫抑制细胞,如调节T细胞(regulatory T cells,Tregs)和髓源抑制性细胞(myeloid-derived suppressor cells,MDSC)等,腺苷可促进这些细胞抑制免疫反应的功能。激活的A2AR通过叉头状转录因子3(forkhead box protein 3,FOXP3)和淋巴细胞活化基因3(lymphocyte activating 3,LAG3)通路促使更多的T细胞转化为免疫抑制性Tregs,而Tregs本身可高表达CD39和CD73,构成了正反馈的闭合通路,进一步抑制免疫反应。最后,A2AR激活可增加免疫细胞表面免疫检查点的表达,包括程序性死亡受体-1(programmed death-1,P D-1)、细胞毒性T 淋巴细胞抗原4(c y to to x i c T lymphocyte associated antigen-4,CTLA-4)和LAG3[13,16,21]。总之,CD39-CD73-腺苷通路在肿瘤微环境中显著表达,通过腺苷受体抑制效应免疫细胞的杀伤功能,增强免疫抑制细胞的活性,从而为肿瘤细胞的免疫逃逸提供了重要的支持。
2 腺苷通路分子在肿瘤中的表达及临床意义
腺苷通路分子的表达水平在一定程度上可以反映肿瘤微环境的特征,单独或联合应用这些分子进行肿瘤分型可为药物治疗、病情监测及预后评估提供指导。
2.1 CD39 CD39在肿瘤微环境中表达于多种细胞表面,可作为生物标志物。多项研究对CD39在肺癌、黑色素瘤、胰腺癌、淋巴瘤、胃癌及结直肠癌等多种肿瘤中的表达进行了检测和分析[22-25]。张斌[25]发现,CD39在胃癌和结直肠癌组织中的表达水平较正常组织高,但与肿瘤临床病理特征及患者总生存期(overall survival,OS)并无明显关系,可能是该研究样本量较小导致检验性能不足所致。另有研究发现,CD39高表达与肿瘤的不良结局有关[22-23]。
2.2 CD73 与CD39类似,CD73亦广泛表达于肿瘤微环境中的多种细胞。多项研究分析了CD73与多种肿瘤(包括乳腺癌、肺癌、胃癌、黑色素瘤、头颈部癌、妇科肿瘤和泌尿系统肿瘤等)的相关性[6,22,26-36],结果显示,肿瘤微环境中CD73高表达与不良预后密切相关[6,22,26-28,30-31,33,35]。Morello等[36]证实了黑色素瘤患者外周血中CD73的活性与肿瘤结局的关系,可溶性CD73高活性患者的生存时间明显短于低活性患者。另有研究发现,CD73高表达为临床结局的有利因素,尤其在肿瘤早期阶段[29,32,34]。这与腺苷通路的免疫抑制机制并不相符,一种解释是CD73诱导产生的高浓度腺苷可作为血管内皮的屏障,减少肿瘤细胞的转移。此外,有研究探讨了CD73分子预测免疫治疗效果的潜能:Morello等[36]和Capone等[37]分别评估了黑色素瘤患者外周血中CD73活性和CD73+T细胞比率与抗PD-1抗体疗效的关系,结果提示,CD73可作为免疫治疗效果的预测指标。
2.3 A2AR 作为腺苷通路产生免疫抑制信号最重要的受体,A2AR在肿瘤中的表达具有重要意义。李风伟[38]和Wu等[39]分别探讨了A2AR在肝癌和结直肠癌中的表达及意义,发现A2AR在肝癌和结直肠癌组织中呈高表达,且A2AR高表达与患者的OS呈负相关,可作为OS的独立预测因子。Kamai等[40]检测了肾细胞癌患者肿瘤组织中A2AR的表达,发现A2AR表达增加与肾细胞癌转移、免疫靶向治疗抵抗和患者OS缩短明显相关。Wang等[41]发现,肿瘤浸润淋巴细胞上A2AR的表达与淋巴瘤患者的OS明显相关,A2AR+患者具有更短的OS。
3 腺苷通路的靶向治疗
目前,肿瘤的免疫检查点抑制剂研究在临床上取得了巨大进展。基于腺苷通路在肿瘤免疫逃逸中的重要作用,阻断腺苷通路在肿瘤免疫治疗中具有重要意义。靶向腺苷通路的药物主要包括阻断腺苷与受体结合的A2AR阻断剂、抑制腺苷生成的CD73抑制剂和CD39抑制剂。基于临床前研究的结果,已有多种腺苷通路阻断剂进入了临床试验阶段,以检验这些药物单独应用或联合其他抗肿瘤药物的有效性和安全性。
3.1 A2AR阻断剂 阻断腺苷与其受体的结合是抑制腺苷通路效应的最直接方法。目前已有7种A2AR阻断剂进入临床试验阶段,包括CPI-444、AZD4635、AB928、PBF-509、CS3005、MK-3814和EOS100850(表1)。其中CPI-444和AZD4635已有初步的临床数据公布,均得到了积极的结果。这些试验的干预策略包括单药治疗、与PD-L1抗体联合、与CD73抗体联合等。CPI-444在NSCLC中的应用已进入Ⅱ期临床试验,可获得的临床证据主要来自一项Ⅰa和Ⅰb研究(NCT02655822)。该研究主要包括两个部分:第一部分初步探讨了CPI-444的治疗剂量和具体方案;第二部分验证了最佳剂量方案在多种实体瘤中的安全性和临床活性,包括黑色素瘤、NSCLC、三阴性乳腺癌(triple-negative breast cancer,TNBC)和肾细胞癌等。第一部分研究招募了48名受试者,最终确定最佳治疗方案为100 mg/次,2次/d,共28 d,总的疾病控制率[定义为完全缓解(complete response,CR)、部分缓解(partial response,PR)或疾病稳定(stable disease,SD)的患者]达45%,常见的不良反应为恶心(13%)和疲乏(19%)[42]。随后,研究者在一项更大样本的肾细胞癌队列研究中进一步检验了CPI-444的临床有效性,该研究共纳入68例肾细胞癌患者,其中33例采用CPI-444单药治疗,35例接受CPI-444联合PD-L1单抗(atezolizumab)治疗[43]。结果显示,CPI-444单药治疗组和联合治疗组分别有1例和4例患者达到CR,中位无进展生存期(progression-free survival,PFS)分别为4.1个月和5.8个月。AZD4635在前列腺癌与NSCLC等肿瘤中的应用已进入了Ⅱ期临床试验,最新公布的数据来自一项针对实体瘤的Ⅰ期临床试验(NCT02740985),共纳入38例晚期实体瘤患者,其中15例接受AZD4635单药治疗,23例接受AZD4635联合PD-L1单抗(durvalumab)治疗。结果显示,AZD4635最大耐受剂量在单药和联合用药时均为100 mg/次,1次/d,常见的不良反应包括恶心、疲乏、呕吐和头晕。在纳入的8例前列腺癌患者中,经AZD4635单药和联合治疗后各有1例达到CR;纳入的头颈癌、膀胱癌、胃癌和肉瘤等患者中,接受治疗超过6个月的患者均达到SD[44]。
3.2 CD73抑制剂 抑制CD73分子的活性可显著降低肿瘤微环境中腺苷的水平,进而解除抗肿瘤免疫抑制。CD73抑制剂包括单抗和小分子抑制剂两类,目前已有7种药物进入临床试验阶段,包括MEDI9447、BMS-986179、NZV930、CPI-006、AB680、LY-3475070和TJ004309(表1)。大多数临床试验处于患者招募阶段,仅MEDI9447和BMS-986179公布了初步的有效性和安全性。一项关于MEDI9447的Ⅱ期临床试验(NCT02503774)初步披露了其在结直肠癌和胰腺癌中的数据。该研究中分别有21例晚期结直肠癌患者和20例胰腺癌患者接受了MEDI9447与durvalumab联合治疗,最终1例晚期结直肠癌患者和2例胰腺癌患者达到PR,2例晚期结直肠癌患者和3例胰腺癌患者达到SD;报告的不良反应包括腹泻(8.7%)、发热(8.7%)、疲劳(6.5%)、谷丙转氨酶升高(6.5%)、谷草转氨酶升高(6.5%)和碱性磷酸酶升高(6.5%)等[45]。目前BMS-986179仅有一项在研的临床试验(NCT02754141),初步研究结果在2018年ACCR会议上进行了报告。截至2017年12月,研究共招募59例实体瘤患者,接受了BMS-986179单药或与nivolumab联合治疗,结果提示,单药治疗及后续的联合疗法均有良好的耐受性,未见4级治疗相关不良反应及治疗相关的死亡。在纳入的头颈癌、胰腺癌、前列腺癌、肛门癌和肾癌患者中,有7例最终达到PR,10例达到SD[46]。
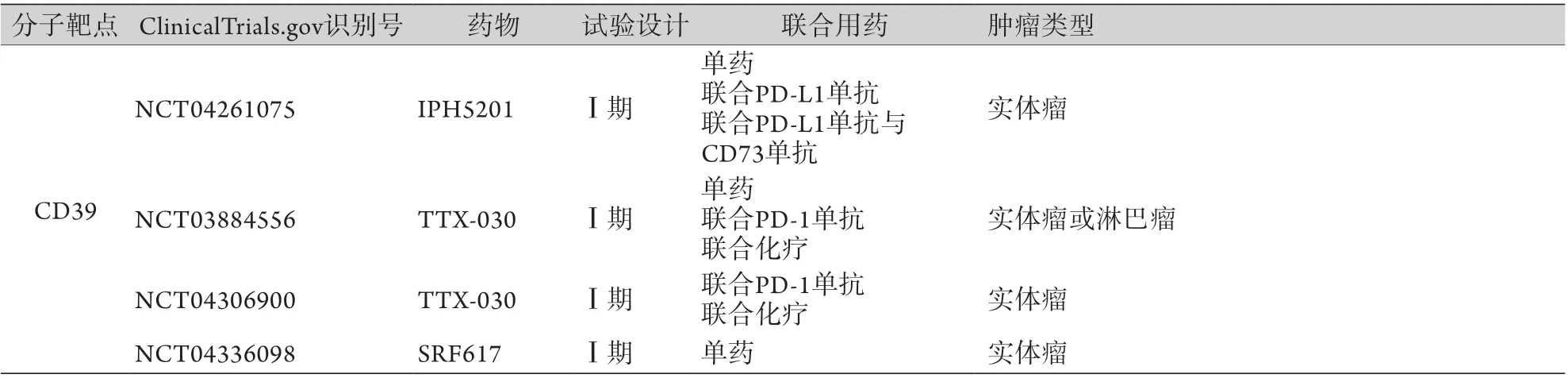
3.3 CD39抑制剂 与CD73类似,目前已开发出CD39抑制剂,进入临床试验阶段的有IPH5201、TTX-030和SRF617等(表1)。这类抑制剂的研究相对较少且处于早期阶段,均为Ⅰ期临床试验。目前尚无临床试验公布研究结果,其安全性和有效性仍有待评估。

表1 肿瘤领域腺苷通路靶向药物的临床试验Tab.1 Clinical trials of adenosine-pathway-related targeted drugs in tumor treatment
4 总结与展望
腺苷通路在肿瘤的发生和发展中起着重要作用。肿瘤特殊的微环境导致腺苷通路被过度激活,从而诱导抗肿瘤免疫抑制反应,肿瘤由此逃避免疫系统的监视和清除。在腺苷通路中,CD39、CD73和A2AR是产生腺苷和发挥作用的3个关键分子。作为肿瘤的生物标志物,腺苷通路相关分子的表达水平与肿瘤的临床病理特征及预后存在明显相关性。此外,腺苷通路在免疫治疗反应的评估中具有广阔的应用价值。针对腺苷通路的不同分子已开发出多种靶向抑制剂,包括A2AR阻断剂、CD73抑制剂和CD39抑制剂等,其中多种药物展现出了令人振奋的临床活性。然而,这些靶向腺苷通路的药物研究刚刚起步,其抗肿瘤效益有待更多大样本研究进一步证实。鉴于腺苷的产生有赖于低氧环境和细胞更新,未来可考虑将腺苷通路抑制剂与诱导低氧和细胞死亡的抗肿瘤药物联合。此外,还可探讨与其他免疫治疗的协同作用,如联合PD-1、PD-L1和CTLA-4抗体等。总之,腺苷通路在肿瘤免疫中扮演了重要角色,随着研究的不断深入,腺苷通路将显示出巨大的临床转化潜力。
(续 表)

