血栓调节蛋白对脓毒症性凝血病的诊断价值
曾庆波,张念清,余婷,何龙平,林青伟,钟林翠,邓星平,宋景春*
1解放军联勤保障部队第908医院重症医学科,南昌 330002;2南昌市洪都中医院重症医学科,南昌 330000
脓毒症是机体对感染的反应失调导致的危及生命的器官功能障碍[1-2]。美国每年约有170万脓毒症患者,其中26.5万人死于脓毒症[3]。我国每年约有300万例脓毒症患者,其中重症监护室(Intensive Care Unit,ICU)的脓毒症患病率约为37.3%,住院死亡人数约100万例[4]。凝血功能障碍是脓毒症的常见并发症,约32%的脓毒症患者可能进展为凝血功能障碍,而合并凝血功能障碍的脓毒症患者病死率明显增高[5-6]。因此,早期识别凝血功能障碍对脓毒症的治疗及预后至关重要[7]。2017年,国际血栓与止血协会(ISTH)以传统凝血指标如国际标准化比值(international normalized ratio,INR)、血小板计数(platelet count,PLT)联合序贯器官衰竭评分(sequential organ failure assessment,SOFA),通过积分制制订了脓毒症性凝血病(septic coagulopathy,SIC)的诊断标准[8]。传统凝血指标的主要优势在于普及性强,便于临床应用,但识别凝血障碍的灵敏度不高,且未纳入针对凝血功能异常的血管内皮细胞功能指标。
组织型纤溶酶原激活剂-纤溶酶原激活剂抑制剂-1复合物(tissue plasminogen activator-inhibitor complex,t-PAIC)与血栓调节蛋白(thrombomodulin,TM)是反映血管内皮细胞损伤的指标[7],而反映凝血系统活化的标志物凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)及反映纤溶活性的纤溶酶-α2抗纤溶酶复合物(α2-plasmin inhibitor-plasmin complex,PIC)是近年来应用于临床的凝血分子标志物,这些指标均采用高敏化学发光法检测,具有灵敏度高、检测速度快等优点。但目前尚无关于凝血分子标志物t-PAIC、TM、TAT、PIC用于诊断SIC的研究。本研究采用凝血分子标志物t-PAIC、TM、TAT、PIC对SIC进行诊断,以探讨SIC的最佳诊断方法。
1 资料与方法
1.1 一般资料 选取解放军第908医院重症医学科2018年5月-2019年10月收治的172例脓毒症患者,其中男110例,女62例,年龄(64.9±18.7)岁。纳入标准:(1)年龄≥18岁;(2)符合2016年美国重症医学会(SCCM)与欧洲重症医学会(ESICM)联合发布的脓毒症诊断新标准(Sepsis 3.0):感染+SOFA≥2分。排除标准:(1)存在已知的先天性凝血功能障碍;(2)慢性肝功能不全;(3)血液系统恶性肿瘤;(4)合并其他引起血小板变化的疾病如血小板减少性紫癜、脾功能亢进,以及服用引起凝血功能异常或致血小板减少的药物。
1.2 分组情况 根据脓毒症患者的凝血指标检测结果,依据2017年ISTH发布的SIC诊断标准[(1)血小板计数:(100~150)×109/L为1分,<100×109/L为2分;(2)国际标准化比率(INR):1.2
1.3 方法
1.3.1 仪器及试剂 HISCL-800自动化学发光免疫分析仪及配套化学发光试剂购自日本Sysmex公司;ACL-TOP700全自动血凝分析仪及配套试剂购自美国沃芬公司;BC-6900全自动血细胞分析仪及配套试剂购自深圳迈瑞生物医疗电子股份有限公司。ABL90 FLEX血气分析仪购自上海雷度米特医疗有限公司。
1.3.2 凝血分子标志物及常规凝血指标检测 脓毒症患者入科2 h内采用枸橼酸抗凝管(枸橼酸与血液比例为1:9)取外周静脉血2 ml,室温下以3000 r/min离心10 min后,按HISCL-800自动化学发光免疫分析仪说明书步骤,采用化学发光免疫分析法定量检测TM、TAT、t-PAIC、PIC的发光强度,计算被测样本TM、TAT、t-PAIC、PIC浓度。将2 ml枸橼酸抗凝血离心后,采用ACL-TOP700全自动凝血分析仪检测凝血功能指标血浆凝血酶原时间(PT)及INR。PLT检测:所有患者入科2 h内采用EDTA抗凝管取外周静脉血3 ml,在BC-6900全自动血细胞分析仪上测定。血乳酸(Lac)检测:所有患者入科2 h内用肝素化注射器取桡动脉血0.5 ml,排净注射器内空气,立即在ABL90 FLEX血气分析仪上测定。
1.3.3 平均动脉压(MAP)、SOFA评分及APACHEⅡ评分 测量血压值,按如下公式计算平均动脉压。平均动脉压=舒张压+1/3脉压差。按1985年版的急性生理与慢性健康评分(APACHE Ⅱ)量表计算APACHE Ⅱ;按2017年版的SOFA量表计算SOFA。
1.4 统计学处理 采用SPSS 25.0软件进行统计分析。计数资料以例(%)表示,两组比较采用χ2检验;计量资料采用单样本S-W法进行正态分布检验,符合正态分布的数据以表示,两组比较采用t检验;非正态分布的数据以M(Q1,Q3)表示,两组比较采用非参数Mann-WhitneyU检验。采用logistic回归分析SIC的影响因素,采用受试者工作特征(ROC)曲线分析TM诊断SIC的效能,采用Kaplan-Meier生存分析法比较不同TM分组患者的生存情况。P<0.05为差异有统计学意义。
2 结 果
2.1 两组基线资料比较 两组患者年龄、性别、MAP、合并疾病及ICU住院时间差异无统计学意义(P>0.05)。与SA组比较,SIC组APACHE Ⅱ评分、SOFA评分、ICU病死率及乳酸水平增高,PT、INR延长,PLT降低,差异均有统计学意义(P<0.05)(表1)。

表1 两组脓毒症患者基线资料比较Tab.1 Comparison of the baseline data of sepsis patients between the two groups
2.2 两组凝血标志物比较 SIC组TM、TAT及t-PAIC水平高于SA组,差异有统计学意义(P<0.05),两组PIC差异无统计学意义(P>0.05)(表2)。
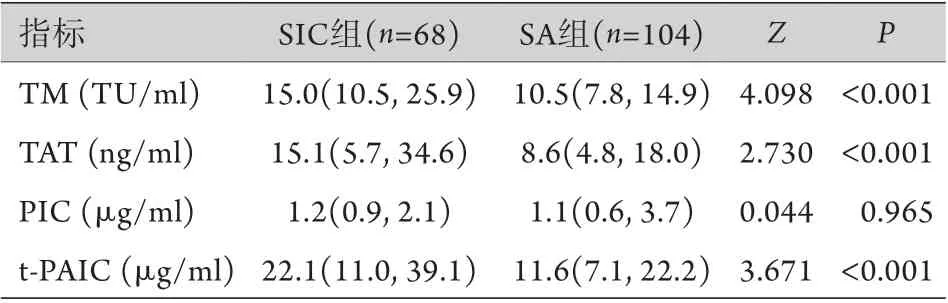
表2 两组脓毒症患者凝血标志物水平比较[M(Q1, Q3)]Tab.2 Comparison of coagulation markers between the two groups of sepsis patients [M(Q1, Q3)]
2.3 SIC影响因素的logistic回归分析 以SIC为因变量(有=1,无=0),TM、TAT、t-PAIC、Lac、PIC、
MAP及年龄为自变量进行单因素logistic回归分析,结果显示,TM、TAT、t-PAIC及Lac升高是发生SIC的独立危险因素(P<0.05),进一步行多因素logistic回归分析显示,TM及Lac升高是发生SIC的独立危险因素(P<0.05)(表3)。
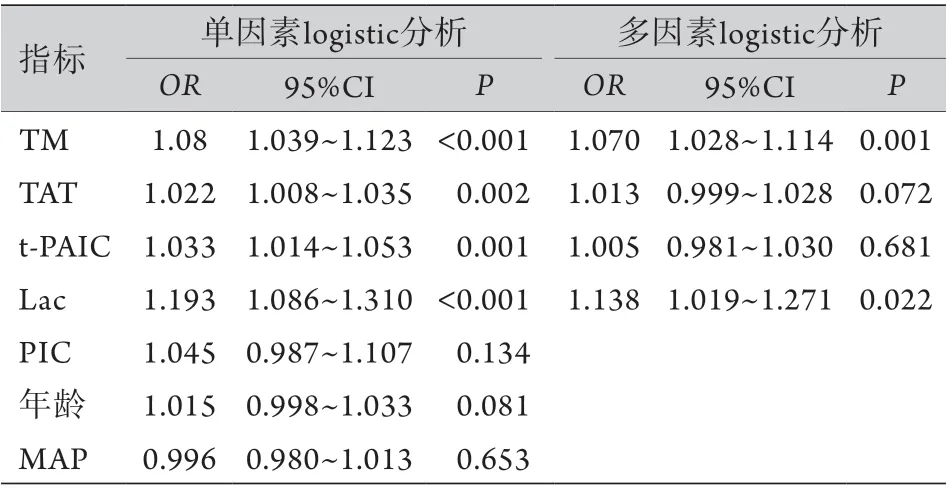
表3 Logistic回归分析SIC发生的危险因素Tab.3 Logistic regression analysis for patients with sepsisinduced coagulopathy
2.4 ROC曲线分析TM对SIC的诊断效能 TM诊断SIC的ROC曲线下面积(AUC)为0.685(95%CI 0.601~0.763,P<0.001);当TM的界值为11.5 TU/ml时,敏感度为72.1%,特异度为61.5%,阳性预测值为55.2%,阴性预测值为77.1%。TM联合SOFA诊断SIC的AUC为0.817,敏感度为67.6%,特异度为84.6%(图1)。
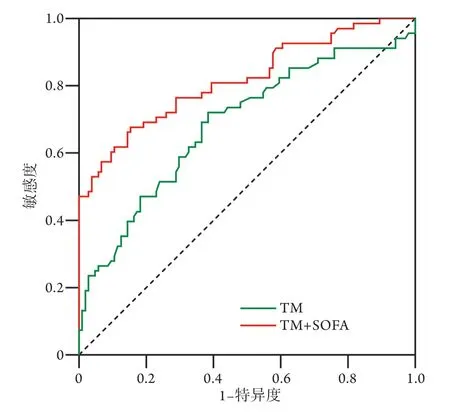
图1 ROC曲线分析TM对SIC的诊断效能Fig.1 Effect of TM on the diagnosis of sepsis-induced coagulopathy by ROC
2.5 生存分析 生存分析结果显示,TM>11.5 TU/ml组的死亡风险是TM≤11.5 TU/ml组的3.61倍(95%CI 1.925~5.594),差异有统计学意义(P<0.05,图2)。

图2 TM≤11.5 TU/ml组与TM>11.5 TU/ml组脓毒症患者的生存曲线Fig.2 Kaplan-Meier-analysis demonstrating survival of patients with sepsis by TM
2.6 SOFA联合TM诊断与ISTH-SIC诊断SIC的病死率比较 本组172例脓毒症患者中符合ISTHSIC诊断标准者68例,其病死率为47.1%(32/68),不符合ISTH-SIC诊断标准者104例,病死率为21.2%(22/104)。符合SOFA≥2且TM>11.5 TU/ml的患者89例,其病死率为47.2%(42/89),不符合该标准者83例,病死率为14.5%(12/83)。
3 讨 论
促凝物质大量释放、抗凝机制受损及纤溶系统功能相对抑制是SIC发生的重要机制,而血管内皮细胞损伤是SIC发生的启动因素[9-10]。内皮细胞衬于血管表面,是内毒素的首要攻击靶点。脓毒症发生时机体大量释放内毒素及炎性细胞因子,直接损伤血管内皮细胞。内皮细胞损伤可导致炎症-凝血通路过度激活,引起凝血功能紊乱。同时由于炎症反应导致内皮细胞肿胀且间隙增大,引起毛细血管通透性增高,从而发生毛细血管渗漏,加重了组织器官的灌注不足,进而导致多器官功能障碍[11-12]。因此,内皮细胞损伤分子标志物的升高有助于早期发现脓毒症性凝血功能障碍[13-16]。
本研究结果显示,SIC组的APACHE Ⅱ评分、SOFA评分、病死率及乳酸水平均明显高于SA组,说明脓毒症患者在出现明显凝血功能障碍时就已出现了严重的器官功能障碍。本研究还发现SIC组的TM、t-PAIC及TAT均较SA组明显升高,说明SIC患者已出现严重的血管内皮细胞损伤,并已启动凝血系统;但两组PIC并无明显差异,说明PIC难以区分脓毒症不同阶段纤溶活动的强弱[17]。多因素logistic回归分析显示,TM及Lac水平升高是SIC的独立危险因素,较单因素logistic分析剔除了TAT及t-PAIC两个指标,提示脓毒症早期Lac升高时伴发的微循环障碍是导致内皮细胞功能损害的重要因素,TAT升高代表的凝血活化是内皮损伤后的后续病理生理过程,t-PAIC反映的严重内皮损害往往合并器官功能障碍[18]。本课题组既往研究采用TM联合TAT判断脓毒症患者的预后,发现TM>16.95 TU/ml且TAT>10.55 ng/ml时脓毒症患者的病死率增高[14]。本研究则发现采用TM诊断SIC的曲线下面积为0.685时,TM界值为11.5 TU/ml;TM>11.5 TU/ml组的死亡风险是TM≤11.5 TU/ml组的3.61倍;TM的正常值为3.8~13.3 TU/ml,提示当TM尚在正常范围时患者就已出现了有病理学意义的内皮损伤。本研究尝试采用SOFA联合TM诊断SIC,与现行SIC诊断标准ISTH-SIC比较,SOFA联合TM可以诊断出更多的SIC患者,且未符合SOFA联合TM诊断患者的病死率低于ISTH-SIC诊断阴性者,提示SOFA联合TM评估SIC预后的准确程度优于ISTH-SIC标准。
综上所述,TM>11.5 TU/ml时脓毒症患者死亡风险升高,联合SOFA≥2可为诊断SIC提供参考。本研究的局限性是样本量偏少,下一步可扩大样本量并进行多中心前瞻性队列研究。

