高原肺水肿防治研究进展
马四清,宋青
1青海省人民医院重症医学科,西宁 810007;2解放军总医院第一医学中心重症医学科,北京 100853
高原肺水肿(high altitude pulmonary edema,HAPE)是急进高原(海拔>3000 m)后最常见且最严重的一类急性重症高原病[1-2],严重时会继发急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)及多器官功能障碍综合征(mutiple organ dysfunction syndrome,MODS),后者是临床治疗的难点,也是导致HAPE患者死亡的主要原因[3-4]。近年来,随着援藏、援青、高山旅游、高原资源开发以及国防建设的开展,进入高原人数增多,HAPE发病率持续升高。本文就高原低氧对机体的生理影响,HAPE的分型、发病机制、临床表现及治疗等方面综述如下。
1 高原低氧对机体的生理影响
随着海拔升高,大气压明显降低,特别是人体吸入气氧分压(PIO2)降低,肺泡、动脉血、组织及静脉血氧的传递明显减弱[5],氧张力明显降低[6-7]。海拔升高对机体的影响如下:(1)气体交换障碍,由于大气压降低导致肺泡PO2下降,肺泡与毛细血管间的氧分压差减小,致使氧通过肺泡毛细血管的弥散速率减小;(2)低氧性通气反应(hypoxic ventilatory responses,HVR)增强,易出现低二氧化碳及呼吸性碱中毒;低氧导致交感神经系统兴奋、心率增快、血压增高及心输出量增加;(3)低氧性肺血管收缩(hypoxic pulmonary vasoconstuction,HPV)导致缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH);(4)血清红细胞生成素(EPO)增加,血红蛋白增加,血细胞比容增高,血液黏滞度改变;(5)血管内皮细胞生长因子(VEGF)表达增强,血管通透性增加。这些改变最终导致急性HAPE,有时伴有高原脑水肿(high altitude cerebral edema,HACE)的发生。如图1所示。
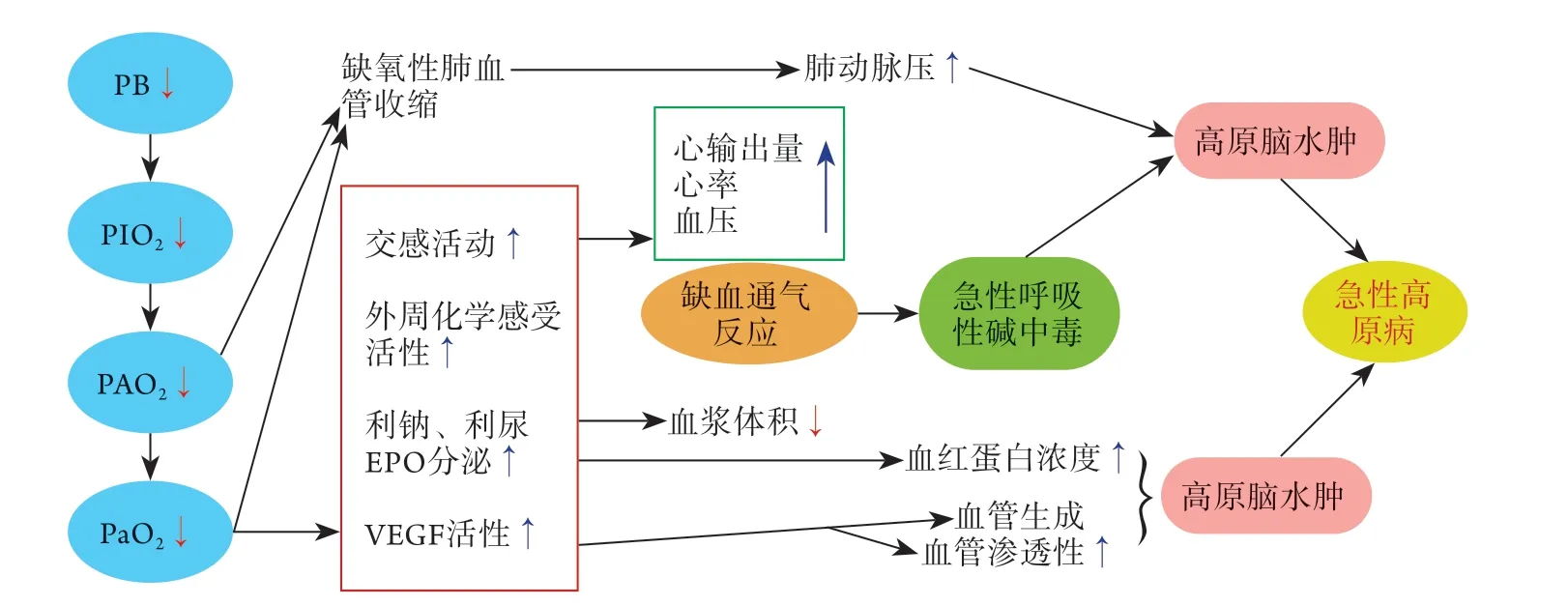
图1 急性缺氧对机体的生理影响Fig.1 Physiological effects of acute hypoxia
2 HAPE的分型及发病机制
急进高原后,轻者可表现为急性轻症高原病,又称急性高原反应或急性高山病,其发病率最高,影响范围最广;重者则表现为HAPE,以肺部积液为特征,伴或不伴有HACE[8]。有一类HAPE临床症状不典型,也不完全符合诊断HAPE的路易斯湖国际诊断计分系统(LLSS)标准[9],以往常被诊断为单纯的急性轻症高原病或被漏诊,目前则常诊断为亚临床高原肺水肿(subclinical high altitude pulmonary edema,SCHAPE)。上述分型及诊断标准有助于HAPE的早期发现及治疗[10]。
既往认为,肺动脉压过度升高、肺毛细血管通透性增加、体液转运失调等是HAPE发病的主要机制[11-12]。目前认为HAPE的发病机制是低氧引起缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)等介导的多个基因的转录发生改变[13-14],进而引起能量代谢稳态失衡、神经内分泌改变、体液平衡紊乱、氧化应激及血管功能异常等[15](图2)。
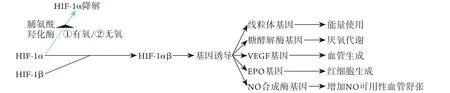
图2 常氧及缺氧环境中的HIF-1α活性Fig.2 HIF-1α activity in normoxic and anoxic environment
3 HAPE的临床表现
3.1 典型肺水肿的表现 HAPE患者有典型的肺水肿表现,包括呼吸困难、咳嗽、体力下降等,且随着病情进展,咳嗽加剧,有时伴端坐呼吸、发绀、呼吸急促、脉搏过快、发热等典型体征。咳粉红色泡沫痰及胸部可听到痰鸣音提示病情严重。肺部听诊可闻及湿啰音,部分患者如果出现共济失调、意识模糊,则可能伴有HACE[16]。
3.2 SCHAPE的表现 约0.05%的HAPE会伴发HACE[17],后者出现认知功能严重减退、共济失调、头痛、恶心呕吐等,严重者可发生昏迷或死亡,是较严重的一类急性重症高原病,具体表现为:(1)心动过速且呼吸急促,在休息状态下,呼吸频率>20次/min,且有明显发绀现象;(2)血氧饱和度较低(65%~75%);(3)早期胸部体征不明显,胸片显示一侧或两侧肺门旁有结节状浸润性阴影[18]。前往高原地区的大部分人群肺部均会出现亚临床变化,经一段时间的习惯适应后,水肿可自行消除并恢复[19]。SCHAPE症状不典型或可能出现轻微症状,甚至不出现症状,易被漏诊或误诊为其他疾病如单纯的急性轻症高原病。
3.3 HAPE继发ARDS的表现 HAPE在下列情况下可发展为ARDS:(1)延误诊断或治疗不当导致病情恶化;(2)严重的双肺弥漫性大片渗出(白肺),病变在短期内迅速发展;(3)混合型肺/脑水肿,是急性高原病中最严重的一类;(4)继发肺部严重感染或并发肠道感染。在上述情况下,由于严重的低氧血症及肺动脉高压,致使肺毛细血管通透性增强,肺泡透明膜形成,此时低氧损伤若再并发感染,产生大量白细胞及炎性介质,进一步造成肺损伤,如肺微血管血栓形成、肺微循环障碍、通气/血流灌注比值失衡、肺内动静脉分流等,则必然发展为ARDS[20]。ARDS临床表现为呼吸窘迫,出现三凹征,呼吸频率≥30次/min,口唇、四肢末梢明显发绀,血氧饱和度明显下降,胸部X线片或CT示大量渗出(白肺),需要积极进行呼吸支持治疗。
4 HAPE的预防及治疗
4.1 个体自身管理 HAPE是身体对高原缺氧的一种过度反应,发生肺水肿前一般有急性高原病的表现,后者可通过自身管理有效防止。因此,急进高原者应重视高原反应的发生,做好自身管理,如做到及时发现、及时休息、及时吸氧等。串联行走测试是一种应用广泛的测试方法,在醉酒测试、失温测试及急性高原病测试中均有效,其方法是让测试者后脚跟触到前脚尖行走一条直线,如果测试者很难完成,提示存在躯干运动失调,是急性高原病的严重表现,当受试者出现这种情况时,应立即向更低海拔地区转移。
4.2 非药物预防
4.2.1 基础预防 主要包括物质保障,习服性登高方式、认知教育及心理适应水平的促进等。笔者对修建青藏铁路的27 606名工人进行分析(调查地为青藏铁路格拉段工程施工前线,海拔3000~5072 m,大气压为70.70~53.28 kPa,氧分压为14.20~11.16 kPa),结果显示急性高原病的发生率为0.83%(229/27 606),其中HAPE发生率为0.50%(138/27 606),HACE为0.28%(77/27 606),HAPE合并HACE为0.05%(14/27 606);进一步将该组人群分为基础预防优良者8176名(优良组)与基础预防不良者19 430名(不良组),结果显示,不良组的急性高原病发生率明显高于优良组[1.04%(202/19 430)vs. 0.32%(26/8176),χ2=36.95,P<0.001][19]。
4.2.2 心理治疗及教育 多数患者对高原病的发生、发展及转归不够了解,且伴有躯体症状,易产生紧张、恐惧心理,不仅加重病情,也影响治疗效果。心理治疗的重点是评估患者的心理状况,做好教育,解释病情,解除或降低患者过度的精神活动,降低大脑神经的高耗氧状态,并配合治疗[21-22]。
4.2.3 控制海拔上升速度 海拔上升速度过快是导致急性高原病发生的关键因素,限制海拔上升速度即每天上升的高度,是有效预防急性高原病的重要手段[23]。有研究报道海拔一旦超过3000 m,应控制每天上升的高度不超过500 m[15]。
4.2.4 充分休息 低张性缺氧是导致高原反应及高原病的核心因素,在高原病的预防及救治中要始终贯穿氧复苏的理念,即节氧疗法与供氧疗法。节氧疗法的核心是降低氧耗使患者处于节氧的生理状态。睡眠不足易使人疲惫及脱水,增加急性高原病的发生风险。因此,在开始上升前要保证充足的休息。
4.2.5 大量饮水及正确饮食 脱水会降低身体适应高度的能力,在海拔适应期,每天应饮用2~3 L以上的水,上升期再增加1 L饮用量。此外,高碳水化合物饮食可缓解急性高原病的症状,尽量低盐饮食可防止身体脱水。
4.2.6 使用供氧装置 使用便携式压力袋(Gamow袋)[15]、氧气补给袋、呼气正压通气(expiratory positive airway pressure,EPAP)等[24]供氧装置能够方便氧气供给,提高机体的氧利用,防治低氧血症,预防急性高原病。
4.3 药物预防及治疗
4.3.1 乙酰唑胺 乙酰唑胺是一种碳酸酐酶抑制剂,其预防急性高原病的机制可能是通过增加副交感神经张力来加速快速上升到高海拔的习服过程[25]。也有研究发现乙酰唑胺具有清除氧自由基及抗氧化的作用,能减轻缺氧导致的脑细胞氧化损伤,从而延长缺氧耐受时间[26]。此外,乙酰唑胺还能增强一氧化氮合酶活性,改善组织微循环并降低血液黏滞度,提高红细胞变形能力[23-24],增加重要器官的供氧能力,增强机体能量代谢,提高机体的有氧运动能力[27]。乙酰唑胺的预防剂量为125 mg/次,2次/d;治疗剂量为250 mg/次,2次/d[28]。
4.3.2 地塞米松 地塞米松是一种合成的高效糖皮质激素,可以增强肾上腺皮质功能,增强毛细血管及细胞膜韧性,提高机体抗缺氧能力。临床研究证实,地塞米松能预防急性高原病的发生,改善HAPE患者的临床症状,缩短肺水肿的病程[29]。也有研究表明使用地塞米松能降低肺微血管壁的通透性,阻止血浆成分向肺泡腔渗出,增加肺泡腔内液体的吸收[23]。地塞米松的治疗剂量为4 mg/次,2次/d,一般不超过3 d。
4.3.3 硝苯地平 硝苯地平属于钙离子通道阻滞药,具有抑制Ca2+内流、选择性舒张动脉阻力血管、松弛血管平滑肌、扩张冠状动脉、增加下腔静脉血流及肺动脉血流的作用,能限制平滑肌收缩所需的细胞内钙浓度的上升,从而干扰缺氧性肺血管收缩及降低肺动脉压力[23-24]。硝苯地平的预防剂量与治疗剂量相同,均为20 mg/次,3次/d。
4.3.4 磷酸二酯酶-5抑制剂 磷酸二酯酶-5抑制剂通过阻断血管平滑肌中环磷酸鸟苷(cGMP)的降解来增强NO的作用,cGMP浓度升高可降低平滑肌细胞的钙流入并增加钙的流出,促进血管舒张并降低肺动脉压力。此类药物还可改善气体交换并部分减轻高海拔引起的最大运动能力降低[27-28]。常用的磷酸二酯酶-5抑制剂为西地那非,其预防剂量与治疗剂量相同,均为10 mg/次,2次/d。
4.3.5 沙美特罗 沙美特罗是一种长效β受体激动剂,可通过刺激顶膜上的敏感性钠通道及增加基底外侧膜上的Na+-K+-ATP酶活性而增强钠及液体转运出肺泡的能力[23-24]。其预防剂量与治疗剂量相同,均为50 μg/次,2次/d。
4.3.6 其他治疗方法 除上述治疗药物外,利尿剂因能够快速减轻肺水肿、改善呼吸功能、纠正低氧血症等,也是治疗肺水肿的一线药物。高压氧疗能够明显改善急性缺氧患者的组织缺氧[30],对HAPE是一种具有明显疗效的治疗方式。当HAPE患者出现急性呼吸功能不全或衰竭时,需要行机械通气治疗。
4.4 注意事项
4.4.1 权衡利尿剂及液体的使用 HAPE由于低氧炎症反应、肺血管压力增高及血管通透性增高等因素,易致肺间质及肺泡水肿,但由于进入高原饮水减少、脱水等因素,体循环可能表现为脱水,导致血容量的不足,此时,为了解决肺水肿,盲目使用利尿剂可能对体循环血压造成严重影响,因此应慎重使用利尿剂[31],且要适当补充液体以维持体循环灌注。
尿量是一个极易获得又比较准确的监测指标,尿量减少可能提示急性高原病。急进高原一旦出现高原少尿,必须引起高度重视。此时绝对禁忌利尿剂,唯一措施为补液,保证每天饮水量达到4.5 L,紧急情况下对尿少或无尿者必须输液。尿液清亮是补水补足的标志。
4.4.2 高压氧的应用 尽管高压氧能够明显改善低张性缺氧,减轻组织细胞缺氧,但并不是吸氧浓度、吸氧压力越高越好。吸入2~3个大气压以上的氧,可在短时间(6个大气压数分钟,4个大气压数十分钟)内引起氧中毒,主要表现为面色苍白、出汗、恶心、眩晕、幻视、幻听、抽搐、晕厥等神经症状,严重者可昏迷、死亡。许多HAPE患者伴有严重的呼吸衰竭,不但有低氧,可能还伴有二氧化碳增高等中枢及外周呼吸衰竭,此时应给予机械通气,不宜行高压氧治疗。
4.4.3 机械通气的应用 HAPE的主要特征为肺动脉高压[32],正压通气及呼气末正压通气(PEEP)时,跨肺压及肺的膨胀压增加,可对肺泡毛细血管产生挤压,导致肺血管阻力明显升高,进而增加右心后负荷,甚至可出现急性肺动脉高压及右室功能障碍,严重时会出现急性肺心病(acute corpulmonale,ACP)[33-34]。不恰当的机械通气方式会更进一步加重肺动脉高压,海拔越高,此种现象越明显。因此,对此类患者应当针对不同海拔高度或基础肺动脉高压状况及右心功能状态采用基于呼吸功能监测的个体化通气,避免机械通气肺损伤[35-36]。笔者认为,早期高流量吸氧、无创正压通气、有创正压通气等序贯治疗模式有助于改善HAPE乃至继发ARDS患者的氧合及血流动力学[37]。
4.4.4 须与急性肺栓塞鉴别 肺栓塞是指来自静脉系统或右心的血栓阻塞肺动脉或其分支[38],主要以肺循环及呼吸功能障碍为主要临床表现及病理生理特征。急进高原后,低氧环境可致EPO释放增加,加之脱水等因素致血红蛋白含量增高,导致血液黏度增加,红细胞及血细胞比容代偿性增高,增加了肺栓塞的发生风险。同时低氧性肺动脉高压还可导致血管内皮损伤,加重血栓形成。两者共同导致肺栓塞的发生,表现为胸痛及呼吸困难等,与肺水肿极为相似,不易鉴别。但两者治疗方法完全不同,应仔细甄别,以免误诊。通过床旁心电图、床旁肺部超声、胸部CT检查及D-二聚体水平检测可明确鉴别[39]。
5 总结与展望
HAPE是一种急进高原低氧环境导致的严重疾病,随着急进高原的人群不断增多,患病人数随之增加。HAPE的发病具有一定特殊性,进入高原前进行良好的教育和防护,克服恐惧心理,做好低氧习服、阶梯型登高等,及早发现高原反应(急性轻症高原病)并进行恰当的药物及非药物预防,可明显阻止该病进一步发展至HAPE和(或)HACE。HAPE一旦继发ARDS或MODS,应积极纳入重症患者管理流程,并注意治疗中的一些医源性损伤,可明显减少严重并发症的发生。将来随着基因芯片技术的开发,可从基因水平为急性高原病的预警和防治提供实用的检测方法,及早筛选低氧不耐受人群(相关研究待发表),同时随着新药的研发和应用,可有效减少急性高原病的发生,有利于保障急进高原人群的健康和国防戍边官兵的战斗力。
致谢:本文部分数据来自青海省科技创新创业团队(2020-66)及青海省高原重症医学重点实验室(2021-0402-ZJC-0028),特此感谢!
——过敏性休克和肺水肿的抢救流程

