高效液相色谱-串联质谱法测定菌渣有机肥中红霉素残留量
谢 芳,易鸳鸯,吴智慧,胡潇涵,张 琳
(新疆环境保护科学研究院,新疆环境污染监控与风险预警重点实验室,新疆清洁生产工程技术研究中心,新疆 乌鲁木齐 830011)
我国每年生产的抗生素有70多种,年产量占全世界的70%。按1 t抗生素产生10 t菌渣计算,每年会产生200 t菌渣。国家环保部将抗生素菌渣列入《国家危险废物名录》。残留的抗生素不仅会对生态系统造成破坏,而且对人体健康造成潜在危害[1-2],抗生素残留问题亟待解决。
红霉素类抗生素通过垃圾填埋场的菌渣渗滤液或者其它方式渗透到环境土壤中。所以,对于抗生素菌渣作为肥料施用后在土壤中的残留量进行检测是有必要的。目前,测定抗生素残留量的方法主要有微生物法、免疫法、光谱法、色谱法、液质联用法等[3-5]。其中,微生物法测定时间长、误差较大;免疫法由于会发生交叉反应等不足,不适用于残留抗生素的测定;高效液相色谱-串联质谱法(HPLC-MS/MS)具有选择性高、特异性好、灵敏度高[6-7]、分离效率高、能够直接得到待测物质的结构与相对分子量等特点,可以达到快速、可靠分析样品的目的。鉴于此,作者建立HPLC-MS/MS测定菌渣有机肥中红霉素残留量的新方法,为检测抗生素菌渣作为肥料施用后在土壤中的残留量提供思路。
1 实验
1.1 材料、试剂与仪器
土壤样品采集于新疆某制药企业试验基地。播种前,农田A1地块、A2地块分别按每亩500 kg、1 000 kg施入红霉素菌渣有机肥,以空间代替时间序列法采集播种期、出苗期、开花期和成熟期等四个时期的土样,分别选取对角线5点法采集表土层(0~20 cm)土样,剔除石头、植物根系、枯枝落叶等杂质后混匀,用四分法保留500 g送至实验室,于通风处风干,过20目筛,储存于密封袋中,于4 ℃保存备用。
CaCl2,天津盛奥化学试剂有限公司;三羟甲基氨基甲烷(Tris),上海青析化工科技有限公司;氨水,西陇化工股份有限公司;1,2-二氯乙烷,色谱纯,天津北联精细化学品开发有限公司;甲醇、乙腈,色谱纯,Fisher公司;红霉素标准品(98%),色谱纯,河北百灵威超精细材料有限公司;其它试剂均为分析纯;实验用水为蒸馏水或去离子水。
TSQ-Quantum Access MAX 型高效液相色谱-三重四级杆质谱联用仪,美国赛默飞世尔公司;ASE-350型加速溶剂萃取仪,美国DIONEX公司;RV10型旋转蒸发仪,德国IKA;AutoEVA-20Plus型全自动氮吹浓缩仪,睿科集团股份有限公司;TDL-5A型大容量离心机,湖南星科科技有限公司。
1.2 标准溶液的配制
准确称取适量红霉素标准品,用甲醇溶解,配制成50 mg·L-1的红霉素标准储备液,避光4 ℃冷藏保存;用甲醇逐级稀释,得到浓度(μg·L-1)分别为1、10、50、100、500、1 000的系列红霉素标准溶液,现配现用。
1.3 样品预处理
参考专利[8],并结合实际样品对预处理方法进行优化。准确称取土样1.0 g(精确至0.000 1 g)于50 mL聚丙烯离心管中,加入乙腈-Tris-CaCl2溶液15 mL,充分振荡1 min后超声提取30 min,3 800 r·min-1离心5 min,取上清液。重复操作2次,合并上清液。
将上清液在旋转蒸发仪上浓缩至5 mL左右,转移至50 mL聚丙烯离心管,加入pH值为6的Tris-CaCl2溶液10 mL,充分涡旋振荡1 min;加入400 μL氨水调节pH值为10,加入1 mL甲醇溶液;快速注射1 mL萃取剂1,2-二氯乙烷,充分振荡30 s,3 800 r·min-1离心5 min,取底层液体;重复萃取步骤,合并含有目标物的1,2-二氯乙烷,氮吹浓缩后用甲醇定容至1 mL,经0.45 μm滤膜过滤至液相用样品瓶中,待测。
1.4 色谱及质谱条件
1.4.1 色谱条件
色谱柱:Waters Symmetry-C18(100 mm×2.1 mm,3.5 μm,USA);流动相为0.1%甲酸(A)-甲醇(B),采用梯度洗脱(表1);柱温30 ℃;流速0.3 mL·min-1;进样量2 μL。

表1 高效液相色谱流动相梯度洗脱程序
1.4.2 质谱条件
电子喷雾(ESI)离子源;反应监测(SRM)正离子扫描模式;鞘气和辅助气为氮气;碰撞气为氩气;喷射电压3.5 kV;离子传输毛细管温度300 ℃;扫描宽度0.01;扫描时间0.02 s。质谱扫描参数见表2。

表2 质谱扫描参数
2 结果与讨论
2.1 色谱条件优化
首先以甲醇和乙腈溶液作为流动相,结果显示,甲醇为流动相时基线稳定且响应值较高,离子化效率和分析灵敏度较乙腈的高。采用0.1%甲酸溶液能改善分析物的色谱峰形,提高分析物的响应值,保证高的灵敏度,且峰形尖锐对称,无拖尾和双头峰等现象。红霉素是极性较强化合物,为了色谱峰的分离效果更好,最终确定采用0.1%甲酸-甲醇作为流动相,并梯度洗脱。
2.2 质谱条件优化
根据红霉素结构特征,采用ESI正离子扫描模式。将2 000 μg·L-1红霉素标准溶液以5 μL·min-1进入离子源,正离子全扫描,找出M+1峰,分别用于轰击母离子,即可找出3个较强信号的子离子,母离子和子离子共同组成监测离子对,进行定性和定量分析。采用自动优化和手动优化相结合的方式对质谱条件进行优化,确定最佳质谱条件为: ESI离子源;SRM正离子扫描模式;鞘气和辅助气为氮气;碰撞气为氩气;喷射电压3.5 kV;离子传输毛细管温度300 ℃;扫描宽度0.01;扫描时间0.02 s。不同浓度红霉素的总离子流图见图1。

图1 不同浓度红霉素的总离子流图Fig.1 Total ion chromatograms of Erythromycin with different concentrations
2.3 线性范围和检出限
取系列红霉素标准溶液按1.4.1条件进样测定,以积分面积(y)对红霉素质量浓度(x)进行线性回归,拟合得红霉素的标准曲线(图2)。

图2 红霉素的标准曲线Fig.2 Standard curve of Erythromycin
由图2可知,红霉素的标准曲线回归方程为y=7134.43x-64383.6,相关系数R2=0.9992。以信噪比S/N=3计算检出限(LOD),为0.2 ng·L-1。
2.4 精密度和加标回收率
取红霉素标准溶液按1.4.1条件进样测定,每个浓度做5个平行,进样量为2 μL,相对标准偏差(RSD)为2.98%~3.57%,表明该方法的精密度良好;实际样品的加标回收率为70.3%~90.7%,RSD低于5.0%(表3)。

表3 精密度和加标回收率结果(n=5)
2.5 红霉素残留量检测(表4)
由表4可知,红霉素在大豆和玉米的播种期、开花期、成熟期均未检出。A1地块出苗期均未检出;A2地块大豆和玉米出苗期的红霉素残留量分别为0.3 ng·g-1、0.2 ng·g-1,残留量非常低。
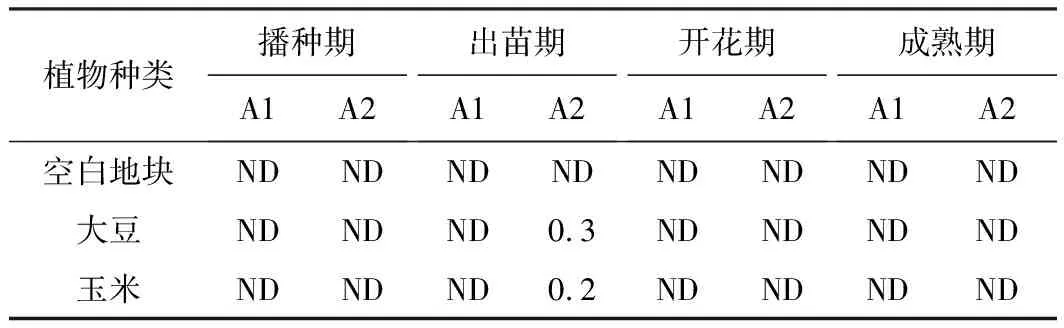
表4 红霉素残留量/(ng·g-1)
3 结论
对色谱条件和质谱条件进行了优化,建立了测定菌渣有机肥中红霉素残留量的HPLC-MS/MS法。采用该方法检测大豆和玉米不同生育期(播种期、出苗期、开花期、成熟期)土壤中红霉素残留量,其中A1地块四个时期均未检出,A2地块大豆和玉米出苗期均有检出,红霉素残留量分别为0.3 ng·g-1和0.2 ng·g-1。该方法准确、灵敏,可用于菌渣有机肥中红霉素残留量的测定。

