水生植物对湖泊浮游细菌群落组成的影响
何肖微,王司辰,赵大勇*
(1.河海大学水文水资源学院,江苏 南京 210098;2.河海大学 水利工程实验教学中心,江苏 南京 210098;3.河海大学 水利学科专业实验教学中心,江苏 南京 210098)
浮游细菌是湖泊生态系统的重要组成部分,并且在生源要素的生物地球化学循环过程中发挥着重要作用。淡水湖泊中的浮游细菌群落组成往往会随时空因素而变化[1-5]。许多因素都可以影响淡水湖泊中的浮游细菌群落组成,如营养盐、盐度、溶解性有机碳、生产力和水温等[2,6-7]。此外,已有的关于大型浅淡水湖泊中浮游细菌群落组成的研究结果表明:水生植物的存在或缺失会导致浮游细菌群落组成发生显著变化[5]。这说明包括水生植物在内的许多因素导致的生境异质会影响湖泊的浮游细菌群落组成[8]。
水生植物是淡水湖泊中的重要初级生产力,对生态系统中的生物多样性有重要影响[9-10]。在湖泊生态系统中,水生植物为微生物提供了多种微生境,并通过为它们提供必要的基质来影响浮游细菌的丰度和活性[11-13]。研究[14]表明:水生植物释放的化合物可以作为直接改变浮游细菌群落的选择性因子。综合这些研究结果可形成如下科学假设,即水生植物可能驱动湖泊中的浮游细菌群落变化。
目前,关于水生植物对湖泊浮游细菌群落影响的研究还比较少。作者从南京花神湖采集2种常见水生植物:沉水植物苦草(Vallisnerianatans)和飘浮植物浮萍(Lemnaminor);构建包含植物的微宇宙模拟体系,在不同的培养时间点采集水样,对其理化指标和浮游细菌群落组成进行分析,对比不同处理组浮游细菌群落多样性及组成的差异,探讨水生植物对湖泊浮游细菌群落的影响,以期为丰富湖泊微生物生态学基础理论提供参考数据。
1 实验
1.1 样品采集
在南京花神湖使用彼得逊采泥器采集沉积物样品,并收集足量的湖水、苦草和浮萍幼苗,立即运回实验室用于构建微宇宙模拟体系。将采集的沉积物混匀、过筛(100目)后均匀分装到直径20 cm、高度50 cm的圆柱状有机玻璃微宇宙模拟体系中,沉积物深度为10 cm左右。依次向微宇宙模拟体系中加入采集的花神湖湖水(高度约10 cm)和灭菌纯净水(高度约30 cm)。待体系稳定3 d后,挑选完整、健康的水生植物苦草和浮萍进行移植,移植前用过氧乙酸对苦草和浮萍幼苗叶片等部位进行灭菌处理,以只包含花神湖湖水和沉积物、未移植水生植物为空白对照,3种体系各设置1个重复组。待植物生长稳定后,将其中一组模拟体系设置为添加氨氮处理组,每4 d向其中添加2 mg·L-1的氨氮。分别在模拟体系培养稳定后的第14 d、第35 d和第70 d采集不同体系中的水样并储存在无菌聚丙乙烯瓶中,用于提取DNA和理化指标测定。
1.2 理化指标测定方法
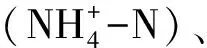
1.3 DNA提取和测序
使用0.22 μm聚碳酸酯滤膜(Millipore,Billerica,MA,USA)过滤水样,参照试剂盒Water DNA Kit(OMEGA bio-tek)说明书进行DNA提取。采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和533R(5′-TTACCGCGGCTGCTGGCAC-3′)对细菌的16S rRNA基因进行PCR扩增。50 μL的PCR反应体系包含:10 μL的5×Prime STAR Buffer(plus Mg2+)、0.2 mmol·L-1dNTPs、0.4 μmol·L-1上下游引物、2.0 U TaKaRa Taq DNA聚合酶,加ddH2O到50 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,27个循环;72 ℃最终延伸7 min。每个样品做3个重复,然后充分混合。PCR产物用1.0%琼脂糖凝胶电泳进行检测后,送至上海美吉生物医药科技有限公司,在罗氏454 FLX Titanium平台上进行高通量测序。所有的原始测序结果文件均已上传至美国国家生物信息中心(NCBI)数据库,检索号为SRP091979。
1.4 高通量测序序列处理
依据Mothur软件包的SOP流程(https://mothur.org/wiki/454_sop/)对高通量测序序列进行预处理。首先,将下机原始测序文件进行降噪和修剪处理,删除测序质量较低的序列(平均质量<27)和较短的序列(<200 bp,不包括引物和barcode),并删除单一碱基连续出现8次以上的序列。使用NAST算法将剩余序列与SILVA 16S rRNA基因模板进行对齐。为了加速后续计算过程,使用 ‘pre.cluster’命令进一步精简数据,然后使用 ‘chimera.uchime’ 命令去除嵌合体序列。使用RDP在线数据库(http://rdp.cme.msu.edu/index.jsp),应用基于80%的cutoff阈值获得细菌群落分类学信息。使用最大邻近距离法在基于3%的差异值水平上划分操作分类单元(OTU)。按照全部样品中获得的最小序列数进行序列随机抽取采样,使得文库中各个样品的序列数一致,以方便进行α和β多样性指数的计算。
1.5 统计分析
使用Mothur软件包的‘summary.single’命令计算细菌群落的丰度(OTU数)和多样性指数(Chao1)。运用R软件中的‘vegan’包计算两两细菌群落之间的β多样性(基于Bray-Curtis距离),使用非度量多维尺度分析(NMDS)进行可视化,使用典范对应分析(CCA)评价环境因子对细菌群落组成的影响。使用‘adonis’命令进行非参数多元方差分析(PerMANOVA),判断采样时间和添加氨氮两因素对浮游细菌群落影响的大小。
2 结果与讨论
2.1 浮游细菌群落分类学分析
基于80%的cutoff阈值,对浮游细菌群落中各序列的分类学信息进行分析,并计算不同处理组中浮游细菌群落各个门所占的相对丰度,结果如图1所示。
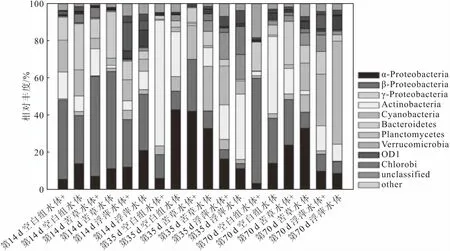
图1 不同处理组中浮游细菌群落门类相对丰度柱状图(“+”代表添加氨氮处理组)Fig.1 Relative abundance of bacterioplankton community at phylum level in different treatment groups(“+”reprents ammonia-nitrogen addition treatment group)
由图1可知:变形菌门(Proteobacteria)在所有处理组中的平均相对丰度最高,达到(47.00±19.22)%,其包含的3个纲α-变形菌纲(α-Proteobacteria)、β-变形菌纲(β-Proteobacteria)和γ-变形菌纲(γ-Proteobacteria)的相对丰度在各个处理组中都较高,平均丰度分别达到了(17.30±12.11)%、(23.80±17.12)%和(5.20±6.21)%;放线菌门(Actinobacteria)(16.30±16.48)%、蓝藻门(Cyanobacteria)(10.70±13.37)%和拟杆菌门(Bacteroidetes)(10.10±7.48)%也是本次发现的浮游细菌群落中的主要优势类群;β-Proteobacteria在第14 d的所有处理组中的相对丰度均较高;放线菌门在第35 d和第70 d的空白处理组中的相对丰度较高;绿菌门(Chlorobi)在第14 d的浮萍处理组中的相对丰度较高;蓝藻门在第70 d的浮萍处理组中的相对丰度较高。研究[15-17]发现:变形菌门、放线菌门、拟杆菌门、蓝藻门和疣微菌门是湖泊水体浮游细菌群落中的常见优势类群,本研究发现的湖泊浮游细菌优势类群与上述研究基本一致。此外,湖泊的营养状态和温度等环境因子也会对浮游细菌群落组成有较大影响[18]。
由于在门的分类学水平上无法了解具体浮游细菌种属的相对丰度变化情况,因此,进一步筛选出每个处理组中平均相对丰度最高的10个属,比较它们在不同处理组中的相对丰度差异,以热图的形式来呈现,结果如图2所示。
由图2可知:(1)拟杆菌门中的Sediminibacterium属、Fluviicola属以及Flavobacterium属在第14 d处理组中的相对丰度较高(>1%),但在第35 d处理组中的相对丰度很低(<1%)。有研究[16,19]显示,拟杆菌丰度与水生植物生物量成正比关系,水生植物可以通过改善水质以及释放分泌物来影响浮游细菌群落组成。(2)变形菌门中的LD28_freshwater_group、Methylophilus属和Methylotenera属在第14 d苦草处理组中的相对丰度较高(>1%),变形菌门中的Novosphingobium属和Legionella属在第35 d苦草处理组中的相对丰度较高(>1%),变形菌门中的Sphingomonas属在第35 d空白处理组中的相对丰度较高(>1%)。有研究[20]显示,变形菌门在低营养环境中更易获取营养,成为优势类群。

图2 不同处理组中优势菌属的相对丰度热图(“+”代表添加氨氮处理组)Fig.2 Relative abundance of dominant bacterioplankton at genus level in different treatment groups(“+”reprents ammonia-nitrogen addition treatment group)
2.2 浮游细菌群落组成分析
为了比较不同处理组中浮游细菌群落的组成差异,通过非度量多维尺度分析比较苦草、浮萍和空白组不同采样时间点的细菌群落组成差异,结果如图3所示。

图3 不同处理组中浮游细菌群落组成差异Fig.3 Differences of bacterioplankton community composition in different treatment groups
由图3可知:第14 d时的浮游细菌样品趋向于聚类在一起,说明实验初期浮游细菌群落组成较为相似;第35 d和第70 d时的浮游细菌样品聚类程度不如第14 d时的紧密,且同一种水生植物处理组的样品呈现聚集。这可能是由于水生植物在实验中后期对水体浮游细菌群落影响作用增强而导致的。
为了探究采样时间和添加氨氮两因素对水体浮游细菌群落影响作用的大小,通过非参数多元方差分析对比两因素对水体浮游细菌群落影响作用的大小,结果见表1。

表1 采样时间和添加氨氮两因素对水体浮游细菌群落影响作用的比较
由表1可知:采样时间对水体浮游细菌群落具有显著影响(P<0.01),而添加氨氮对水体浮游细菌群落无显著影响(P>0.05)。氨氮作为重要的营养因子,对湖泊水生植物和浮游细菌群落都会产生影响。但是,本研究中的微宇宙模拟体系中存在沉积物和水生植物,这两者都会迅速吸收添加入系统的氨氮,从而使得添加氨氮处理组与对照组中水体氨氮浓度无太大差异。
2.3 浮游细菌群落的丰度和多样性分析
经过降噪、去除嵌合体以及非细菌序列之后,获得的单个样品的序列数在3 170~5 614之间。依据最少序列数3 170进行随机重采样,以此计算出各个浮游细菌群落样品的丰度和多样性指数。根据表1中的结果,添加氨氮对水体浮游细菌群落无显著影响。因此,在分析浮游细菌群落的丰度和多样性指数时,将有无氨氮添加的两组样品合并后进行分析,结果如图4所示。
由图4可知:在第14 d浮游细菌样品中,浮萍处理组浮游细菌群落的丰度(OTU数)和多样性指数(Chao1)比苦草处理组和空白处理组都要高;随后,各个处理组样品中的浮游细菌群落的丰度和多样性指数均开始下降,但浮萍处理组样品中浮游细菌群落的多样性指数一直比另外两个处理组要高;在第70 d时,苦草处理组浮游细菌群落的多样性指数出现回升,两个水生植物处理组中浮游细菌群落的多样性指数接近一致。这反映了不同水生植物对浮游细菌群落多样性的影响机制不同。培养初期,浮萍处理组浮游细菌大量繁殖,浮萍生长消耗水中营养物质的同时,叶片也能为浮游细菌提供定殖的场所;随着时间推移,浮萍生长改变了水体的pH值和溶解氧等环境因子,不同细菌类群对pH值的响应不同,水体pH值的改变也是影响浮游细菌群落变化的重要因素[21-23]。而苦草属于沉水植物,生长初期主要吸收沉积物中的营养盐,与浮游细菌的生态位不重合,这也能合理解释苦草处理组与空白处理组体系前中期(14 d和35 d)的浮游细菌群落多样性相似[10]。两个水生植物处理组在第70 d呈现出相似的多样性水平,均略高于空白处理组,说明经过70 d的培养,两个水生植物体系趋于稳定,并为浮游细菌提供了一定的生态位,增加了浮游细菌群落的多样性。此外,水生植物与浮游藻类间的竞争关系以及水生植物的化感作用等也能间接影响浮游细菌群落多样性的变化[24]。
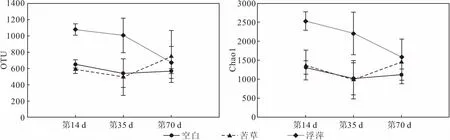
图4 不同处理组浮游细菌群落丰度和多样性指数随时间的变化Fig.4 Variations of abundance and diversity index of bacterioplankton community with time in different treatment groups
2.4 环境因子对浮游细菌群落组成的影响分析
为了探究微宇宙模拟体系中水质因子的变化对浮游细菌群落组成的影响,测定了每个采样时间点体系中的主要水质因子,结果见表2。
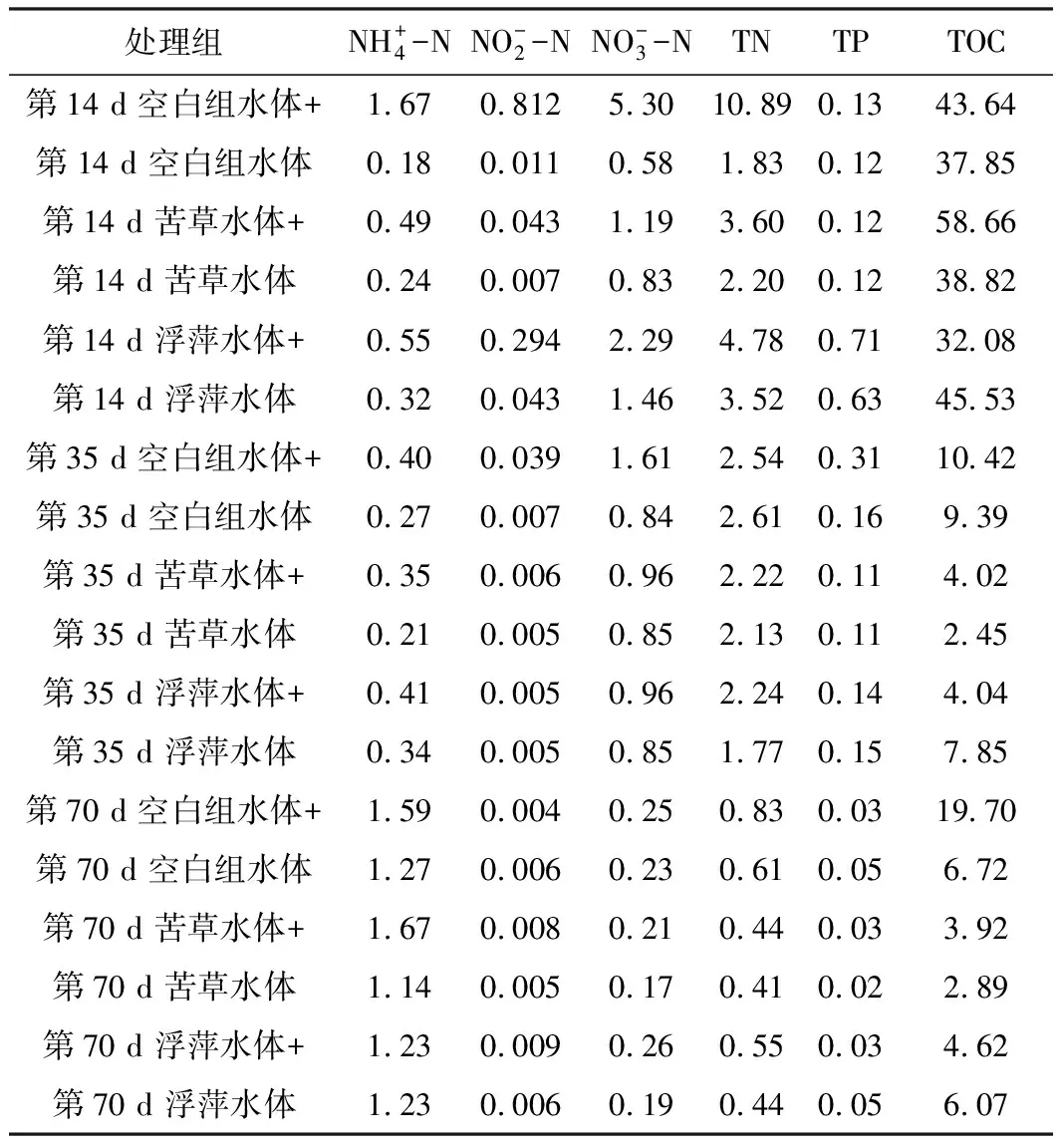
表2 不同采样时间点各处理组中的主要水质因子/(mg·L-1)
应用典型对应分析探究水质因子的变化对浮游细菌群落组成的影响,并通过排序图进行呈现,结果如图5所示。
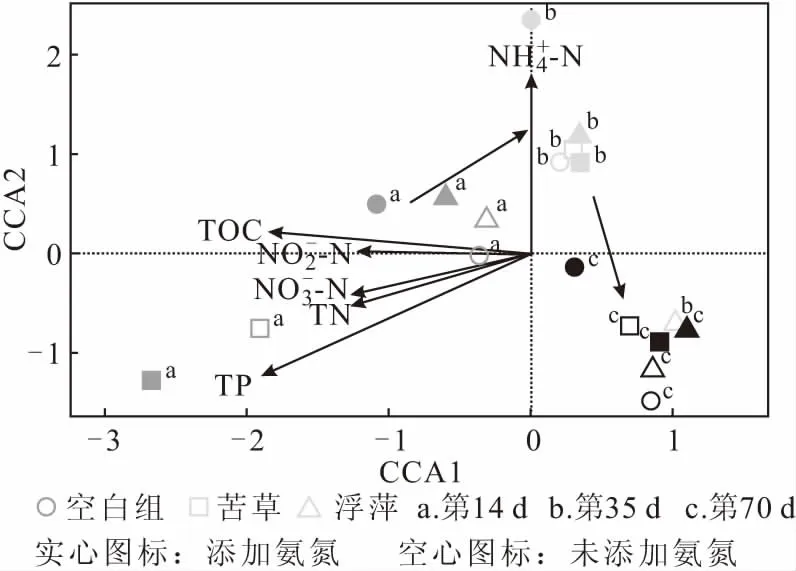
图5 不同处理组中浮游细菌群落与环境因子的典范对应分析图Fig.5 Canonical correspondence analysis of bacterioplankton community and environmental factors in different treatment groups
由图5可知,总体上,不同时间序列处理组(第14 d、第35 d和第70 d)的细菌群落分别聚类在一起。观察样品在沿两个轴方向的分布上,可以发现实验初期的第14 d处理组的细菌群落沿CCA1轴分布,随后的第35 d和第70 d处理组的细菌群落大致沿CCA2轴分布,呈现出明显的随时间演替规律,说明实验初期与实验中后期的浮游细菌群落整体上受不同环境因子的影响。
进一步应用envfit函数对环境因子与排序轴的相关性进行检验,结果发现:氨氮、总磷和总有机碳是影响水体中浮游细菌群落组成的主要环境因子(表3)。一方面,氮和磷会增加异养细菌的生物量并导致其群落组成的变化[25]。另一方面,水体中氮、磷的变化也能通过影响浮游植物群落组成而间接影响浮游细菌群落。薛银刚等[26]在太湖竺山湾的研究显示,总磷含量显著影响了浮游细菌群落的结构。

表3 环境因子与排序轴之间的相关性
3 结论
构建了包含淡水湖泊中两种典型水生植物苦草(Vallisnerianatans)和浮萍(Lemnaminor)的微宇宙模拟体系,结合高通量测序技术,探讨了水生植物对湖泊浮游细菌群落组成的影响。结果表明:不同采样时间及处理组中,浮游细菌群落中的优势类群不同;氨氮的加入对浮游细菌群落的影响没有采样时间大;实验初期,浮萍处理组的浮游细菌群落多样性指数比苦草和空白处理组都要高,随着实验的进行,各个处理组的浮游细菌群落多样性指数总体开始下降并最终趋于一致;氨氮、总磷和总有机碳是影响浮游细菌群落组成的主要环境因子。

