氧化石墨烯对紫花苜蓿抗病生理生态特征的影响
魏宏达,赵树兰,多立安
(1.天津师范大学生命科学学院,天津300387;2.天津师范大学天津市动植物抗性重点实验室,天津300387)
豆科根瘤能够共生固氮,是全球生物固氮的主体,具有非常重要的生态价值.紫花苜蓿(Medicago sativa)是全世界种植范围最广的一种豆科牧草,具有其他牧草不能比拟的抗逆性强、品质好、产量高、经济价值高等特点.近年来虽然紫花苜蓿的种植面积不断扩大,但病害也经常发生,造成产量和品质下降,甚至会导致家畜中毒.如何更好地进行紫花苜蓿病害防控,增强其抗病性,对于提高紫花苜蓿的产量和品质极为重要.
植物在遭受病原微生物侵害时,自身可通过生理、生化、形态特征等多方面的变化产生抗病性[1].苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、几丁质酶和β-1,3-葡聚糖酶是与植物抗病相关的3种极其重要的酶,可作为植物抗病性的重要生理指标.Duba等[2]研究小麦受病原菌侵染后体内PAL的变化,发现小麦感染病原菌后PAL活性显著升高,抗病能力增强.Wilson等[3]研究也表明,几丁质酶和β-1,3-葡聚糖酶普遍存在于高等植物体内,具有抵抗病原菌侵害的作用.另外,植物体内木质素、富含羟脯氨酸糖蛋白(hydroxyproline-rich glycoprotein,HPRG)及类黄酮等物质也与植物抗病性密切相关.Yao等[4]研究发现,类黄酮可以提高番茄对黄化曲叶病毒的抗性并抑制病毒传播.Deepak等[5]研究发现,木质素和HPRG含量提高可使细胞壁发生木质化,形成物理和化学屏障,增强植物细胞壁抵抗病原菌穿透的能力.
石墨烯(graphene)作为新型碳纳米材料,具有独特的理化特性,在很多领域应用广泛.氧化石墨烯(graphene oxide,GO)是一种石墨烯的重要衍生物,除了具有石墨烯的优良性能外,表面含有较多的含氧基团,使其在环境保护领域也得到了广泛应用[6].另外,GO在治疗肿瘤和中枢神经系统疾病等方面也表现出良好的应用前景[7].然而,GO用量的增加对生物和环境造成的风险也在增加,并引起广泛关注,一些针对GO对植物生长影响的研究已经展开.Begum等[8]研究发现,GO显著抑制了白菜、番茄和红菠菜根、茎的生长,且随着GO浓度的增加,抑制作用增强.Wang等[9]研究也表明高浓度GO显著降低了大豆种子发芽率以及根和幼苗的干质量.但也有报道,GO对番茄种子的萌发具有促进作用,显著提高了种子发芽率[10].可见,GO对植物的影响很大程度上取决于GO浓度和植物种类.植物在生态系统中至关重要,研究GO对植物抗病生理生态特征的影响具有重要意义.
Hu等[11]研究认为,GO对植物的抗病性会产生负面影响.一方面,高浓度GO可对植物造成胁迫,引起植物体的氧化应激反应,致使体内活性氧大量增加;另一方面,GO胁迫会抑制植物抗氧化酶系统对活性氧的清除,过量的活性氧会直接攻击蛋白质和脂质等大分子物质,引起脂质过氧化,造成机体损伤,从而增加植株感染病原菌的风险[12].而有关GO对植物抗病性影响的研究还未见文献报道.本文选取豆科植物紫花苜蓿为研究对象,研究土培条件下GO对紫花苜蓿抗病生理生态特征的影响,为揭示GO存在下豆科植物抗病生理的作用机制提供科学依据.
1 材料与方法
1.1 实验材料
供试土壤为天津师范大学校园土,主要理化性质:含水质量分数为16.5%,电导率为1 950μS/cm,速效磷含量为23.2 mg/kg,速效钾含量为473.7 mg/kg,水解氮含量为218 mg/kg,pH值为7.14.紫花苜蓿种子购自于天津市曹庄花卉市场.氧化石墨烯购自于苏州恒球石墨科技有限公司,厚度为3.5~7.0 nm,片层直径为10~50μm,比表面积为100~300 m2/g.
1.2 研究方法
1.2.1 植株培养
采用高18 cm、上直径20 cm、下直径15 cm的花盆为培养容器.每盆装土2.3 kg,GO分别按照0.2%、0.4%和0.6%的质量分数添加,与土壤充分混匀.以不添加GO为对照(CK),每个处理重复4次.每盆中播种150粒大小均一且籽粒饱满的紫花苜蓿种子.花盆随机排列,经常移动位置以保证光照一致,培养期间按需补充水分.实验期间环境温度为14~25℃,相对湿度为15%~30%,光照为自然入射光.种子萌发后60 d测定相关指标.
1.2.2 株高、根长、地上生物量和根瘤数量的测定
选取长势良好、均匀的植株,用直尺测量株高和根长.将收获的植物地上部分用蒸馏水洗净并用滤纸吸水后,在108℃下杀青20 min,80℃下烘干至恒重,称量.采用计数法测定根瘤数量.
1.2.3 抗病相关酶活性的测定
参照Lister等[13]的方法测定PAL活性.取新鲜叶片1.0 g,加入聚乙烯吡咯烷酮0.1 g、5 mmol/L巯基乙醇硼酸缓冲液5 mL和少量石英砂,在冰浴下研磨成浆,4℃下8 000 r/min离心15 min.取上清液0.1 mL,加入3 mL浓度为0.02 mol/L的苯丙氨酸硼酸缓冲液(pH值为8.8),加蒸馏水至6 mL,30℃保温30 min.对照组以蒸馏水为底物.使用紫外分光光度计(UV-1700,Shimadzu,日本)测定290 nm处的OD值.以每分钟OD值变化0.01为1个酶活单位.
几丁质酶活性测定参照Nguyen等[14]的方法并加以改进.取叶片0.4 g,加入0.1 mol/L的乙酸缓冲液(pH值为5.0)2 mL和少量石英砂,在冰浴下研磨成匀浆,4℃下12 000 r/min离心20 min.取上清液0.8 mL,加入0.2 mL胶态几丁质,40℃水浴60 min后,加入0.3 mL的DNS,于沸水浴中显色10 min.静置冷却至室温,再加入2 mL蒸馏水,用紫外分光光度计在540 nm下测定OD值,以零反应时间作对照,以每分钟产生1μmol还原糖所需酶量为1个酶活单位.
β-1,3-葡聚糖酶活性测定参照Kauffmann等[15]的方法.取0.2 g叶片,加入0.1 mol/L的乙酸缓冲液(pH值为5.0)2 mL,4℃下研磨成匀浆,10 000 r/min下离心10 min.两次离心后,取1.0 mL上清液,加入1.0 mL昆布多糖溶液,在40℃下水浴30 min,沸水浴10 min后立即冷却.与2.0 mL的DNS溶液混匀,用紫外分光光度计在550 nm下测定OD值.以每分钟还原昆布多糖释放出1μmol葡萄糖所需的酶量为1个酶活单位.
1.2.4 抗病相关物质含量的测定
参照Pirie等[16]的方法测定类黄酮含量.取叶片0.5 g,加入1%的HCl-甲醇溶液5 mL,在4℃下提取24 h.取0.5 mL提取液,用1%的HCl-甲醇溶液稀释至10 mL,在325 nm下测定OD值,类黄酮含量用每克鲜质量下芦丁的质量(单位为mg)表示.
参照Reddy等[17]的方法并稍作改进测定木质素含量.取叶片0.2 g,加入95%的乙醇3 mL,研磨成匀浆,于5 000 r/min下离心10 min.取出沉淀物,分别用正己烷和95%乙醇冲洗若干次,待沉淀物自然风干后,加入25%的溴乙酰-冰醋酸,65℃下水浴40 min,加入2 mol/L的氢氧化钠0.9 mL和5 mL冰醋酸,1 000 r/min下离心10 min,用紫外分光光度计测定上清液280 nm处的OD值,以每克鲜质量的吸收值表示木质素含量.
参照Kivirikko等[18]的方法测定HRGP.细胞壁中的羟脯氨酸含量与HRGP含量呈正相关,因此,计算出羟脯氨酸的质量即可计算样品中HRGP的质量分数.
1.3 数据处理与分析
采用SPSS19.0软件对所得数据进行单因素方差分析,采用Duncan法在P=0.05水平进行差异统计学意义检验,采用Origin 2017软件绘图.
2 结果与分析
2.1 GO对紫花苜蓿株高、根长和地上干质量的影响
不同质量分数的GO处理下,紫花苜蓿株高、根长和地上干质量如图1所示.由图1可以看出,随着GO质量分数的增加,紫花苜蓿地上干质量和株高均呈现降低的趋势.0.2%GO处理下,紫花苜蓿的株高较对照组有所降低,差异不显著(P>0.05),地上干质量较对照组显著降低(P<0.05).0.4%和0.6%GO处理组中,紫花苜蓿的株高和地上干质量均显著低于对照组,且GO质量分数越大苜蓿生长状况越差.GO质量分数为0.6%时,地上干质量和株高较对照组分别降低了26.7%和20.3%.GO对紫花苜蓿根长没有显著影响.

图1 不同质量分数GO处理下紫花苜蓿的株高、根长和地上干质量Fig.1 Plant height,root length and shoot dry weight of M.sativa under different mass fraction of GO
2.2 GO对紫花苜蓿根瘤数的影响
添加不同质量的GO后,紫花苜蓿单株根瘤数变化如图2所示.由图2可以看出,随着GO质量分数的增加,紫花苜蓿单株根瘤数下降,0.6%GO处理显著抑制了根瘤数的增加(P<0.05),抑制率为22.3%;0.2%和0.4%GO处理对根瘤数的影响不显著.
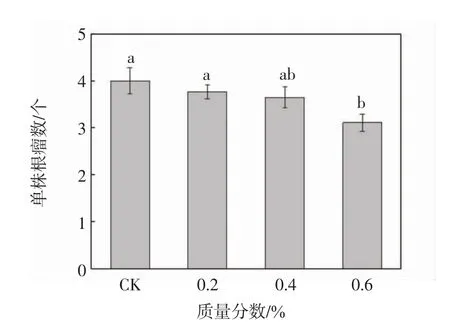
图2 不同质量分数GO处理下紫花苜蓿根瘤数Fig.2 Number of nodules of M.sativa under different mass fraction of GO
2.3 GO对紫花苜蓿抗病酶活性的影响
土壤中添加GO后,紫花苜蓿抗病酶活性变化如图3所示.

图3 不同质量分数GO处理下紫花苜蓿的抗病酶活性Fig.3 Disease resistance enzyme activity of M.sativa under different mass fraction of GO
由图3可以看出,PAL活性随GO质量分数的增加而降低,0.4%和0.6%处理出现了显著的抑制作用(P<0.05),抑制率分别为39.6%和65.7%;0.2%处理与对照组差异不显著(P>0.05).GO抑制了几丁质酶的活性,随着GO质量分数的增加,抑制作用增强;0.2%和0.4%处理几丁质酶活性抑制率分别为11.5%和38.1%,与对照组差异不显著(P>0.05),0.6%处理出现显著抑制作用,抑制率为64.3%.GO对紫花苜蓿体内的β-1,3-葡聚糖酶活性没有显著影响.
2.4 GO对紫花苜蓿抗病物质含量的影响
土壤中添加GO后,紫花苜蓿抗病物质含量的变化如图4所示.

图4 不同质量分数GO处理下紫花苜蓿的抗病物质含量Fig.4 Content of other disease-resistant substances in M.sativa under different mass fraction of GO
由图4可以看出,木质素含量随着GO质量分数的增加而降低,0.4%和0.6%处理出现了显著抑制作用,抑制率分别为31%和45.8%(P<0.05).GO对类黄酮含量没有显著影响,但显著降低了HRGP含量,各处理组与对照组相比分别降低了12.6%、36.1%和47.9%.
3 讨论与结论
PAL是植物体内苯丙烷代谢途径的关键酶和限速酶,其活性与植物抗病性密切相关.Solekha等[19]研究发现,水稻感染稻瘟病菌后抗病品种中PAL的活性显著高于敏感品种的活性.本研究结果显示,紫花苜蓿中PAL活性随着土壤中GO质量分数的增加而降低,并且在高质量分数GO处理组中显著降低,表明GO能够抑制PAL的活性,且随着GO质量分数的增加抑制作用增强.PAL活性的高低通常表示PAL基因表达量的多少,即PAL基因表达受到抑制PAL活性将会降低.Wang等[20]研究发现,GO能够导致拟南芥根系发育相关基因表达下调.因此,可以推测GO抑制了PAL基因的表达从而导致PAL活性降低.木质素作为苯丙烷代谢途径合成的重要次生代谢产物,在植物抵御病原微生物入侵的抗病反应中发挥着重要作用.本研究发现,GO处理降低了紫花苜蓿细胞壁的木质素含量,且随着GO添加量的增加,木质素含量和PAL活性的变化趋势完全一致,在高质量分数GO处理下二者均受到显著抑制作用.Shalitin等[21]研究百日草中苯丙烷类代谢酶与木质素的关系,发现百日草细胞分化过程中,木质素的合成与PAL活性增加呈正相关.Kováˇcik等[22]用PAL活性抑制剂氨基茚磷酸(AIP)处理铝胁迫下的母菊,发现其细胞壁木质素的含量显著降低,这和本研究结果相一致.木质素含量的降低可能是由于GO下调了PAL基因的表达,从而抑制了PAL活性,致使苯丙烷代谢合成途径受阻.类黄酮是一类重要的多酚类次生代谢物,具有抗疫酶活性,能够显著降低多种植物的发病率.类黄酮的合成途径受PAL的间接调控,有研究证实两者具有协同增减的趋势[23].本研究发现,GO处理没有显著影响紫花苜蓿的类黄酮含量,类黄酮含量和PAL活性变化趋势不同,两者并没有表现出一定的协同性,这与前人的研究结果有所不同.可能原因有两方面:一是类黄酮的合成途径不仅受PAL的间接调控,还受外界因素和其他相关酶的直接调控,GO抑制了PAL活性,但对其他直接调控类黄酮合成途径的相关酶未造成显著影响,因此并没有引起类黄酮含量的变化;二是木质素合成受到抑制,导致代谢物改变方向进入类黄酮,引起类黄酮物质的增加,而这些增加的量可能恰好弥补了因GO抑制PAL活性导致类黄酮减少的量,因而类黄酮含量没有发生变化.
HRGP是高等植物细胞壁中的一种特殊结构蛋白,可作为木质素沉积位点,增强细胞壁木质化程度,构成紧密的物理屏障阻止病原菌的穿透侵染.本研究结果显示,在所设质量分数范围内GO处理紫花苜蓿后HRGP含量显著下降,表明GO抑制了HRGP合成,对紫花苜蓿细胞壁造成损伤.植物受到胁迫时通常伴随着乙烯浓度的升高,乙烯对植物次生代谢产物的调控具有浓度依赖性,一定浓度的乙烯可以促进某些次生代谢产物的合成,高浓度的乙烯则会抑制次生代谢产物形成[24].本研究中,GO处理对紫花苜蓿株高和地上生物量具有显著抑制作用,表明紫花苜蓿受到了GO的严重胁迫,这与Liu等[25]在水稻中的研究结果一致.因此推测紫花苜蓿中HRGP含量的降低可能是由GO对紫花苜蓿造成胁迫引起乙烯浓度不断升高所致.
几丁质酶和β-1,3-葡聚糖酶在高等植物体内普遍存在,正常情况下在植物体内保持较低的浓度水平.几丁质酶和β-1,3-葡聚糖酶可通过多种诱导因子诱导产生,能够破坏真菌细胞壁上的几丁质和β-1,3-葡聚糖,直接杀死病原菌,被认为是植物诱导抗病的生理机制之一.Li等[26]用枯萎病菌诱导黄瓜时发现,几丁质酶和β-1,3-葡聚糖酶活性越高黄瓜品种的抗病性越强.本研究中,GO处理降低了紫花苜蓿体内几丁质酶和β-1,3-葡聚糖酶的活性,高浓度GO处理显著抑制了几丁质酶活性,表明GO胁迫严重破坏了紫花苜蓿自身防御系统.GO上的含氧基团能够与酶分子发生静电相互作用,在不使酶变性的情况下显著抑制α-糜蛋白酶(ChT)活性[27].另外,GO可以改变辣根过氧化物酶的结构,从而引起酶活性、动力学常数和酶效率的降低[28].以上研究结果均是通过体外酶活测试所得,而本研究中GO处理使得紫花苜蓿体内2种抗病酶活性降低,GO可能通过植物胞壁进入细胞,引起几丁质酶和β-1,3-葡聚糖酶失活,从而导致酶活性的降低,但有关GO在体内降低酶活性的作用机理尚不明确,有待进一步研究.
综上所述,GO添加到土壤中能够抑制紫花苜蓿的生长,降低其体内PAL、几丁质酶和β-1,3-葡聚糖酶活性,对植物防御系统造成负面影响,且随着添加量的增加抑制作用增强.GO显著降低了紫花苜蓿细胞壁HRGP含量,0.4%GO和0.6%GO显著降低了木质素含量,破坏了植物抵御病原菌的屏障.因此,在GO应用过程中,应该注意其可能使植物抗病能力降低的风险.另外,基于本研究所得结果,在进一步的研究中应进行紫花苜蓿病原菌侵染实验,探究GO在紫花苜蓿抵御病原菌侵染过程中对其抗病性及生理机制的影响.

