预处理纤维素超分子结构变化机制研究进展
凌喆,赖晨欢,黄曹兴,许凤,勇强*
(1. 南京林业大学化学工程学院,南京 210037;2. 北京林业大学材料科学与技术学院,北京 100083)
木质纤维素(lignocellulose)是地球上分布最广泛的生物质资源,其每年捕获和存储的太阳能达到人类需求量的10倍以上,是生产生物质能源及化学品的重要原料[1-2]。对木质纤维原料的深度加工利用,为降低人类对化石资源的依赖、缓解全球气候变暖和环境污染提供了可能,同时也是我国实施石油替代战略,发展醇类燃料,实现可持续发展的重要途径。在木质纤维细胞壁中,纤维素、半纤维素和木质素相互联结形成的三维网络结构,构成了复杂的生物质抗降解屏障,阻碍了木质纤维素的生物转化[3]。生物质预处理主要通过打破细胞壁物理形态结构、降低包覆在纤维素周围的基质组分(主要为半纤维素和木质素)含量,从而实现提高纤维素酶解效率的目的[4]。在预处理过程中,半纤维素易降解为低聚糖,溶解在体系中,从而与纤维素的氢键连接减弱,增加纤维素对纤维素酶的可及性,有利于提高纤维素糖化效率;木质素的脱除则使细胞壁骨架结构坍塌,物料孔隙率和比表面积增加,暴露出更多的纤维素骨架。目前,通过预处理木质纤维素进行生物转化,生产生物质能源和化学品的产业化利用仍然存在预处理成本高、转化效率低等问题。其主要原因是对木质纤维素的内在结构解析还不够充分,致使各种热化学预处理及纤维素糖化难以低成本地逾越细胞壁复杂的抗降解屏障并实现高值化利用。值得关注的是,在预处理过程中,除了半纤维素和木质素的组分含量与内在结构变化常被研究讨论,木质纤维原料的主要成分——纤维素在预处理过程中也发生了不同程度的超分子结构变化,并对后续的酶吸附、水解行为产生重要影响[5]。
纤维素是木质纤维生物质的主要成分,占植物中碳源总量的40%左右,形成植物细胞壁复杂结构的骨架,也是生物质酶解糖化的前驱物质和作用目标[6]。纤维素在细胞壁中存在有序的、多尺度的超分子结构,是造成其抗生物降解屏障的重要因素之一。植物细胞壁中纤维素的超分子结构主要包括在纤维素生物合成后葡萄糖分子的翻转、构象排列,葡萄糖分子内和分子间氢键形成的高度结晶结构,纤维素分子链中结晶和无定形态共存的两相结构,高分子链聚集成为单根基元纤维(elementary fibril)(10-11~10-9m)并在细胞壁中进一步交联排列成微细纤维(microfibril)(10-9~10-7m,如图1)等[7-8]。纤维素的超分子结构由于其中氢键作用形成的高度结晶性、纤丝交联的致密性和纤丝尺度的不均一性,共同形成了复杂而坚固的物理和化学屏障,极大阻碍了纤维素酶在纤维素纤丝聚集体上的吸附和水解。因此,从多尺度研究木质纤维素超分子结构形成机制及其在生物质预处理过程中的动态溶解、润胀、分离行为,可为提高纤维素酶解糖化效率,实现农林生物质高效转化提供理论基础。近年来,预处理过程中纤维素超分子结构变化及其对纤维素酶解效率的影响备受关注,相关研究也逐渐深入。笔者综述了木质纤维生物质预处理研究中纤维素超分子结构的变化特性,并对其与纤维素酶解糖化的构效关系进行总结,以期为木质纤维素多尺度抗降解屏障的破解和高效糖化技术方法的建立提供新思路。
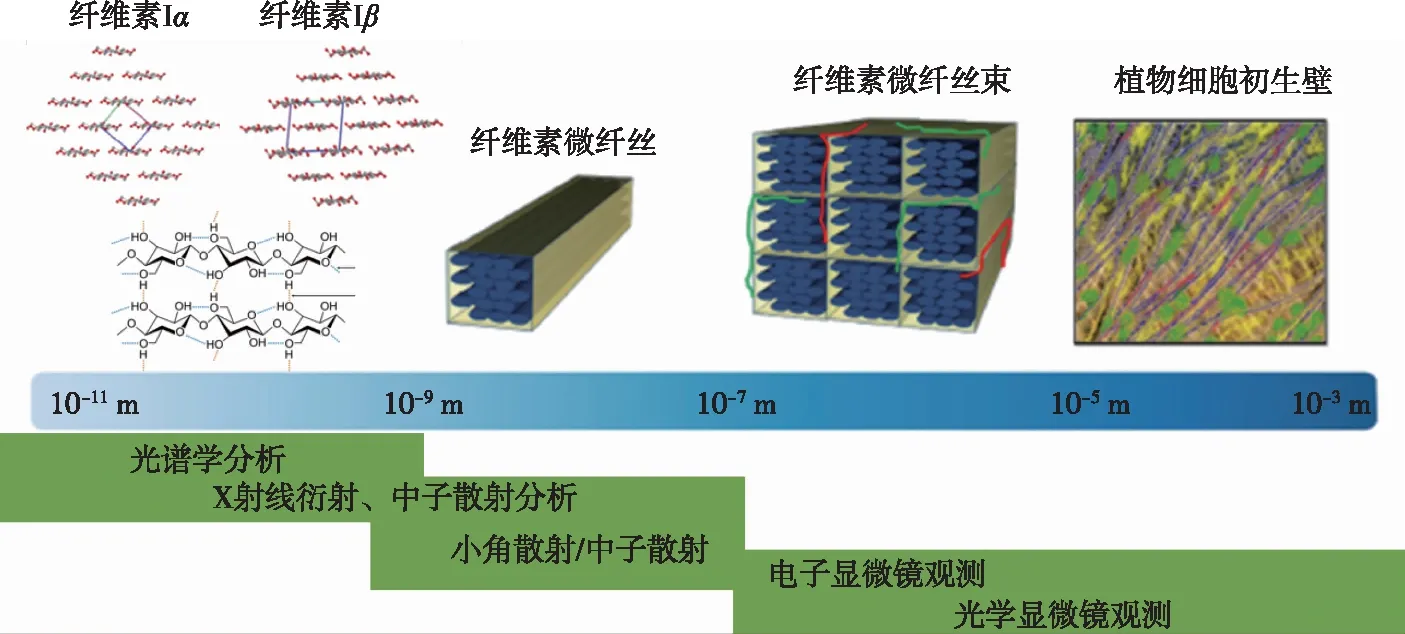
图1 植物细胞壁中纤维素多尺度超分子结构示意图[7]
1 纤维素结晶结构变化
1.1 纤维素晶型
天然的纤维素只存在一种纤维素晶型结构,即纤维素Ⅰ[9]。通过核磁共振碳谱(CP/MAS13C NMR)研究发现,在细菌及藻类纤维素中,纤维素链主要堆砌排列成三斜晶体,定义为纤维素Ⅰα;而高等植物(麻类、棉花、木材等)中的纤维素为单斜晶体结构,定义为纤维素Ⅰβ[10]。木质纤维原料中的纤维素Ⅰβ分子链平行排列,分别处于单斜晶体的四周和中心。葡萄糖分子的O6基团主要偏向C4,形成tg构象。在同一晶胞内,O3与相邻葡萄糖的O5形成分子内氢键,O2与O6之间的氢原子可形成多种形式的分子间氢键和分子内氢键。
由于纤维素Ⅰβ中纤维素大分子的层状二维排列与致密氢键作用体系,该晶型在化学预处理和纤维素酶解过程中更难被解离。因此,纤维素晶型由稳定的纤维素Ⅰβ向其他晶型的转变逐渐成为提高木质纤维素酶解效率的有效措施之一。图2列举了已知的纤维素晶型转变所需条件及相应结构的X射线衍射(XRD)一维图谱。碱性蒸煮是最为常用的预处理方法之一,该法对木质纤维原料中纤维素及其他组分的结构均产生影响,同时也是改变纤维素晶型的经典方法[11]。笔者前期曾研究了梯度碱处理前后毛竹综纤维素的化学组成与纤维素聚集态结构变化[12]。结果表明,不同浓度的碱处理造成纤维素晶型由纤维素Ⅰ型(分子链平行排列)向纤维素Ⅱ型(分子链反平行排列)的递进转化,该变化伴随纤维素结晶区的减少、微纤丝润胀和宏纤丝束的剥离,有利于后续酶解时酶的渗入[13]。该结论与诸多报道中纤维素Ⅱ酶解效率变化趋势一致[14-17]。Jin等[18]将纤维素Ⅰ、Ⅱ型的微晶纤维素制备成去除无定型区的纳米晶体,观察其在石英晶体微天平(QCM-D)上的原子力显微镜(AFM)原位成像,发现两种纤维素晶型的晶粒形态差异较大,纤维素Ⅱ晶体呈颗粒状排列,具有更松散的聚集和更高的比表面积,有利于纤维素酶的吸附。纤维素Ⅱ的分子链呈反平行排列,同时存在角链与相邻内部分子链层附加的分子间氢键,不同于仅有层内氢键纤维素Ⅰ[19]。纤维素Ⅱ的角链存在O3—H…O5 分子内氢键,以及O6—H…O3的分子间氢键,氢键的平均长度为2.72 Å,比纤维素Ⅰ中的2.80 Å 稍短。因此纤维素Ⅱ比纤维素Ⅰ的热稳定性更好,同时也证明了纤维素Ⅰ向纤维素Ⅱ的转变是不可逆过程。
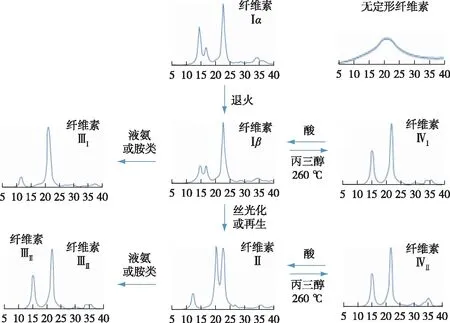
图2 不同纤维素晶型的X射线粉末衍射图及纤维素晶型间相互转化
研究表明,一些有机溶剂(如N-甲基吗啉-N-氧化物、氯化锂/二甲基乙酰胺、磷酸、离子液体等)对纤维素有一定的溶解能力,预处理后的木质纤维细胞壁发生明显的润胀解离[20-23]。在溶解后的体系中添加反向溶剂(如水、乙醇、甲醇等)后,纤维素析出再生,再生纤维素的晶型为纤维素 Ⅱ,其形貌也发生明显变化。此外,纤维素晶型转变过程中,分子间氢键的断裂重排,造成一部分结晶区的结构破坏,结晶度下降,孔隙增多[24]。Cheng等[25]研究了不同的木质纤维原料以1-乙基-3-甲基咪唑醋酸盐为溶剂分别在120和160 ℃ 预处理后的纤维素结晶结构变化。XRD和小角中子散射(SANS)表征证明了离子液体处理后的纤维素均发生由纤维素 Ⅰ 到纤维素Ⅱ的晶型转变,且在更高温度条件下处理时,晶型变化更为明显,酶解效率也更优异。因此,低结晶度的纤维素Ⅱ结构有利于酶解反应,再生纤维素的酶解效率相比存在于天然植物原料中的纤维素Ⅰβ大大提高[26]。但在不同的纤维素溶解体系中,再生纤维素Ⅱ的结晶度也有所差异,酶解效率不尽相同,其具体变化规律有待深入研究。
除天然纤维素Ⅰ和碱处理或溶解再生法得到的纤维素Ⅱ外,通过液氨爆破处理或者有机胺处理纤维素样品得到的纤维素Ⅲ也被深入研究。根据初始纤维素的晶型不同(纤维素Ⅰ或Ⅱ),得到的纤维素样品分别为纤维素ⅢⅠ和纤维素ⅢⅡ。这两种纤维素Ⅲ样品的衍射图样十分相似,但分子链的平行或反平行排列方式与其原始纤维素相同。纤维素Ⅲ中分子发生重排,O6基团偏向O5,形成tg构象。该构象使得纤维素Ⅲ分子内氢键数量减少,同时分子间氢键数量增多(图3)[27-28]。这类分子重排使更多可水解的葡聚糖链疏水平面暴露在表面,显著打破了纤维素的有序结晶结构造成的天然抗降解屏障,使酶解效率提升至原来的5倍。综上,纤维素的晶型转变通常伴随着分子链的重排,进而造成结晶度、结晶尺寸、晶面间距等结晶参数的变化。重排后的纤维素晶体一般具有更疏松的结构,有利于纤维素酶的反应,而这类结晶参数的转变也逐渐成为评价纤维素预处理效果的新指标。
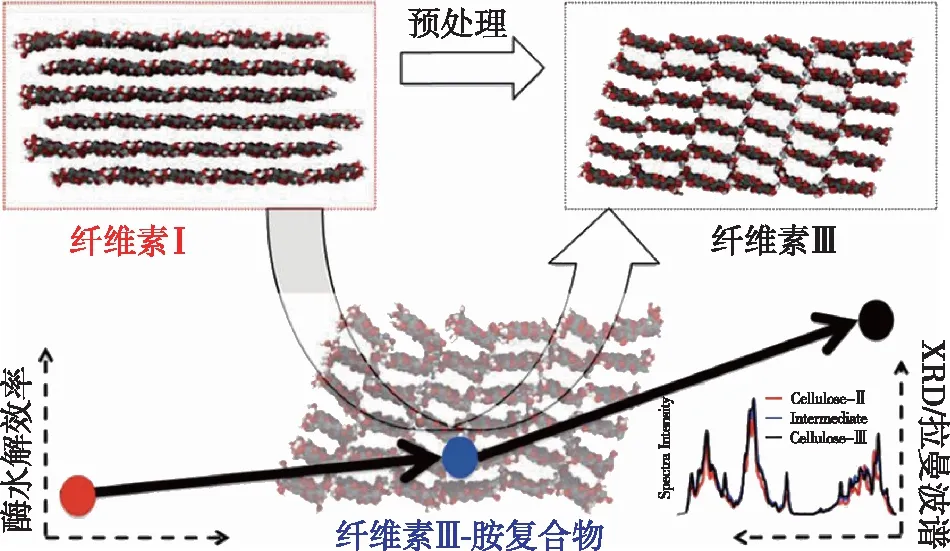
图3 液氨处理纤维素Ⅰ转化为纤维素ⅢⅠ提高酶解效率示意图[27]
1.2 纤维素结晶度
纤维素具有由结晶区和非结晶区组成的两相结构,分子链排列规则的区域,即结晶区在纤维素中占的比例被定义为结晶度。纤维素的高结晶度是形成生物质抗降解屏障、阻碍酶解的主要因素之一。在木质纤维素的研究中,测定纤维素结晶度的方法很多,主要有XRD、红外光谱(IR)、NMR、拉曼光谱(RM)等,其中XRD为最常用的测定手段[29-32]。利用XRD图谱计算纤维素结晶度的方法分为3种:1)Segal法——通过结晶区峰高(I200-Iam)与200面的峰高(I200)的比值来计算结晶度。该方法运用范围最广,但已被证明其准确性有所欠缺[33-35]。2)结构精修法——借助数据处理软件,导入标准纤维素晶型,对实验所得XRD谱图进行分峰拟合,将代表结晶区纤维素的峰进行积分,并计算结晶区域峰强度与各衍射峰积分总强度的比值[36]。此方法相对准确性更高,逐渐得到广泛运用。3)将球磨纤维素作为无定形区的标样,衍射峰积分总强度减去无定形区,即得到结晶区域的衍射峰强度,从而计算出结晶度数值。
木质纤维素预处理过程中,结晶度变化显著。纤维素结晶度的降低,促使纤维素酶进入纤丝聚集体内核,吸附位点增多,从而提高了酶解效率,但并非所有的预处理均能达到理想的去结晶效果。表1总结了多种预处理方法作用于不同木质纤维原料前后结晶度的变化[37-55]。由表1可以发现,木质纤维素的结晶度变化趋势各异,主要随原料种类、预处理方法、反应条件等诸多因素而变化。对于常用的酸、碱、有机溶剂、离子盐等预处理,其主要目的是降解细胞壁中无定形的半纤维素、木质素,使包覆在纤维素周围的屏障去除,同时使微纤丝润胀,孔隙率和比表面积增加[56-57]。但是,这一过程通常伴随排列杂乱的无定形纤维素的降解,使得预处理物料中结晶纤维素的相对含量增加,结晶度反而更高,依然造成较高的生物质抗降解屏障。预处理强度进一步增加,如增加酸碱浓度、提高反应温度等,可更大程度地促进微纤丝的润胀并加剧纤维素链的重排。此时,纤维素结晶结构也随之打破,结晶度降低[58-59]。

表1 多种预处理方法作用于不同纤维素原料前后结晶度的变化
降低纤维素结晶度的有效方式有机械处理法和溶解-再生法[60]。机械处理法,如球磨、超声、研磨法等操作简便,可迅速打破纤维素的高聚集态结构,降低分子量、结晶度等。笔者曾系统研究了球磨处理高结晶棉纤维的降解机制,发现球磨处理2 h后,纤维素结晶度从90%降至10%左右,同时分子量、粒径减小,比表面积和孔隙率增加,有利于纤维素酶的作用[32]。机械处理法常与化学预处理同时或分步进行,以实现木质纤维素的高效转化[61]。化学预处理可有效降解植物细胞壁中的木质素和半纤维素,实现组分分离,暴露纤维素微纤丝;机械处理则有效降低物料的结晶度,两种处理方法共同作用,从多角度破解木质纤维素的抗降解屏障,促进生物转化效率的提升[62]。除机械处理外,通过溶解-再生法制得的纤维素具有较低结晶度,且其晶型为纤维素Ⅱ。Guo等[63]制备了低结晶度纤维素薄膜,并研究其酶解性能,发现即使薄膜中存在木质素,低结晶度样品的酶解速率更高。Arantes等[64]提出一种“无定形化”的纤维素酶解模型,认为纤维素酶解的过程可分为三步:纤维素酶吸附在纤维素的致密表面,此时纤维素分子链逐渐疏松,出现无定形化现象;纤维素链在内切、外切葡聚糖酶的协同作用下被迅速水解为纤维二糖;纤维二糖被β-葡萄糖苷酶进一步水解为葡萄糖。这种模型虽然得到一部分学者的认同,但对于低结晶度纤维素来说,不同方法制备的无定型区结构依旧存在差异,与纤维素酶的吸附、反应情况仍值得深入探索。
1.3 纤维素结晶尺寸与晶面间距
纤维素晶粒的大小(结晶尺寸)和晶面间距是衡量纤维素晶体性质的一项主要指标,对木质纤维素酶解糖化也具有较大影响。纤维素晶粒尺寸指微纤丝中相距最远的晶面间的宽度,与微纤丝中的分子链数量有关。普遍观点认为,单根基元纤维中含有36条纤维素分子链,呈六边形排列,但根据原料的不同,基元纤维可进一步拆分为18条或24条纤维素分子链[65]。一般来说,禾本科原料基元纤维中的纤维素链数量多于木、竹材原料[66]。在针叶木原料脱木质素过程的研究中,氧化脱木质素和亚氯酸钠脱木质素的处理条件不同对结晶度和结晶尺寸均产生影响[67]。氧化脱木质素和亚氯酸钠脱木质素都增加了针叶木中纤维素结晶区所占比例,且氧化脱木质素对结晶尺寸的影响更为明显。同时,结晶尺寸也随处理条件而变化。处理时间、浓度和处理温度等处理强度的提升使纤维素中晶粒聚集、结晶尺寸增加。结晶尺寸的大小决定了结晶区纤维素链的暴露程度,影响其与纤维素酶的接触。Nishiyama等[68]对杨木样品进行液氨爆破、蒸汽及稀酸预处理,结果表明3种预处理方法均提高了结晶尺寸。其原因可能是相邻的纤维素分子链在共晶面处发生了局部共结晶作用。液氨爆破预处理后杨木中纤维素晶型转化为纤维素Ⅲ,且结晶尺寸由未处理样品的2.4 nm增加至2倍以上(5.8 nm),远超过稀酸处理和蒸汽预处理后的结晶尺寸(3.1和4.1 nm),同时,代表200晶面的峰位(约2θ=22.5°)发生右移。根据布拉格公式,该现象证明了纤维素晶体中(200)平面的晶面间距有所降低[69]。类似的情况发生在碱性预处理中,碱液浸透结晶区,扰乱了纤维素晶体的有序堆砌,晶面间距增加,体系中的水分子进入双链晶胞单元,造成晶胞润胀,形成纤维素Ⅱ水合物,打开了纤维素Ⅱ的疏水平面,有利于酶吸附反应[15,70]。因此,通过一定的预处理方法扩展纤维素晶体疏水平面的晶面间距是提高酶解效率的有效方式。最新研究表明,随着酶解的进行,纤维素晶体的疏水晶面面积逐渐增大,且逐步发生自发聚集[71]。这一现象使得暴露在晶体外的羟基进一步减少,纤维素酶在纤维素晶体表面的吸附效率降低,难以进一步水解,直至酶解糖化达到终点。
上述预处理方法均可有效去除纤维素表面的生物基质(木质素与半纤维素),使得更多的微纤丝暴露出来,并在溶剂中发生润胀,增大纤丝与纤维素酶的接触面积。此时,纤维素链的氢键作用减弱,但在一定条件下可能发生共结晶和重结晶作用,造成结晶尺寸增加。Kuribayashi等[72]进一步研究了纤维素结晶尺寸变化和纤维素内部共结晶机理。研究发现,在水热处理温度超过180 ℃时,木材样品中纤维素结晶尺寸增加1倍,该结论与杨木液氨纤维爆破的结果相似[68]。高温打破了纤维间水分的结合,相邻纤维素晶胞之间亲水的(1-10)和(110)平面间距靠近,发生聚集重排,形成与纤维素链垂直的斜方晶系。值得注意的是,纤维素的这种共结晶现象增加了纤维素晶粒的疏水平面间距,使微纤丝进一步暴露,从而增加纤维素酶的接触位点,增效酶解反应。
2 纤维素纤丝聚集体变化
2.1 纤丝聚集体润胀与解离
纤维素大分子组装聚集形成的不同尺度和形态结构的纤维称为纤维素的纤丝聚集体。在木质纤维细胞壁中,具有两相结构的纤维素基元纤维通过氢键以及分子间作用力进一步交联,形成尺度更大的微纤丝,其直径为5~60 nm[73]。小角X射线散射(SAXS)是研究纤维表面粗糙度、孔径大小、纤丝聚集,甚至细胞壁中木质素聚集态结构的优良手段[8,74]。根据布拉格公式[69]:
nλ=2dsinθ
可得:SAXS对样品的入射角度比XRD更小,从而在微纤丝微孔处发生散射现象,并通过接收器获得散射信息,计算材料微观尺度范围较广,可从纳米级延伸至微米级。对不同预处理条件下杨木的SAXS图样观测发现,未处理样品的二维散射图样呈现出与纤维纵轴垂直的长条纹状,说明天然条件下微纤丝的排列具有一定的取向[68]。而经过稀酸、蒸汽爆破和液氨处理的样品,二维散射图具有宝石状结构,且颜色更深,纤维排列无序,呈现各向同性。但在某些未处理的植物纤维样品的SAXS散射图样中也出现了宝石形状的厚条纹形状[75]。该现象是由于未处理样品的微纤丝在沿着纤维方向的排列存在孔隙。但在碱处理后,宝石状的图样向四周发散,出现更为明显的各向同性散射形状,进一步证明碱处理对纤维素纤丝排列结构具有明显的破解作用。笔者曾采用一种新型的乙酰丙酸基低共熔溶剂处理毛竹原料,并进行微纤丝聚集形态研究[76]。发现利用乙酰丙酸与氯化胆碱(图4中LA-Ch样品)所合成的低共熔溶剂处理毛竹纤维素效果优异,其二维SAXS图样也呈现宝石形状,处理后的纤丝排列具有各向异性(图4)。进一步的定量计算表明,纤维素微纤丝在垂直于纤维轴向的方向上受低共熔溶剂预处理影响,出现约为30 nm的微孔。微纤丝的断裂和排列变化显著提高了酶解效率。

图4 乙酰丙酸基低共熔溶剂处理毛竹原料小角X射线散射图[76]
在木质纤维细胞壁中,纤维素的微纤丝束相互交联,进一步聚集成宏纤丝。分子模拟研究表明,由于分子内氢键O2—O6’的存在,微纤丝在交联过程中,发生右手方向的螺旋扭转,这种扭转普遍存在于细胞壁中,且随着微纤丝的长度增加而减弱[77]。该现象对纤维素的排列取向、与细胞壁其他组分的相互连接以及与纤维素酶的吸附作用均产生一定影响。细胞壁中木质素和半纤维素的含量比重仅次于纤维素,且与纤维素共同聚集扩张,形成稳定的三维多尺度结构。纤维素、木质素和半纤维素在细胞壁中的分布具有不均一性,其中木质素在细胞角隅区和胞间层含量最多,而碳水化合物主要存在于细胞初生壁和次生壁中,且以面积最大的次生壁S2层为主[78]。半纤维素在细胞壁三维骨架中充当“黏结剂”的作用,以醚键、酯键等方式连接外层包覆的木质素,又以氢键为主要作用力与内层的纤维素纤丝相连(图5)[79]。在多种化学、物理预处理方法中,半纤维素均可轻易解离、溶出,但其与纤维素连接键的破解机制仍未得到明确解译。其主要原因是,纤维素与半纤维素均属于碳水化合物,官能团结构相似,难以被IR、RM等常规检测仪器有效分辨。Thomas等[80]利用SANS对云杉细胞壁的研究表明,纤维素微纤丝聚集态中存在距离为3.8 nm左右的空隙,供水分子游离;而木聚糖为主的半纤维素片段与微纤丝的亲水面结合,进一步增加了纤丝之间的空隙。但分子模拟研究表明,热化学处理过程中,纤维素-半纤维素这种亲水面的结合孔隙随着温度的升高而减小,该现象可能是由于孔隙中水分的蒸发,使半纤维素与纤维素间的氢键作用增多[81]。这种重构现象使细胞壁结构更致密,加剧了细胞壁的抗降解屏障。
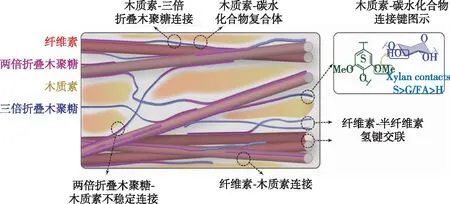
图5 植物次生壁中纤维素、半纤维素(木聚糖为主)及木质素联接机制[79]
2.2 细胞壁解构
细胞壁中的半纤维素和木质素对纤维素微纤丝的排列有显著影响并进一步影响其生物转化。近来,有学者制备细菌纤维素与木聚糖和甘露聚糖的复合物以模仿植物细胞壁中碳水化合物的相互作用。酸处理复合物样品的SAXS图谱研究表明,纤维素微纤丝的形貌和尺寸未发生明显变化,但由于酸处理过程水解大量半纤维素,微纤丝间的孔隙尺寸增加,有利于酶的进入,同时接触面积增加,酶的反应位点增多[82-83]。在细胞壁中,木质素包覆在纤维素微纤丝表面,降低其比表面积,影响纤维素酶的接触,是形成生物质抗降解屏障的主要因素之一[84]。碱预处理可溶解部分木质素,暴露纤维素微纤丝,溶出的碱木质素无规则形状,其尺寸约为3.2~7.0 nm[85]。在不同木质纤维原料中,木质素对纤维素酶解的阻碍作用也有所差异,这是由于木质素的分子结构、分子量、亲疏水性以及预处理后在纤维素表面的残留量不同。Takada等[86]对木质纤维原料的蒸汽预处理研究发现,尽管处理强度均十分剧烈,冷杉和玉米秸秆中的木质素在预处理后的脱除程度和内在结构差异较大,造成纤维素微纤丝形貌也不尽相同。具有更低分子量且更多亲水性木质素的玉米秸秆在预处理后的酶解糖化效率更高,其根本原因是此类木质素对纤维素微纤丝的包覆程度有限,微纤丝结构更为疏松,比表面积更大,有利于酶的吸附与水解。
对木质纤维细胞壁在预处理前后组分的溶出与降解过程的直观检测依赖于多种成像技术。Zhou等[87]利用新型的γ-戊内酯预处理方法在温和条件下处理杨木细胞壁,并通过免疫荧光标记和免疫金标记观测其微观结构变化。研究发现两种细胞壁组分的溶出过程具有协同作用。在纤维细胞次生壁中,木质素醚键的断裂与木聚糖的脱除量变化趋势一致。同时,XRD拟合计算表明,木质素的脱除对纤维素疏水的(200)晶面暴露更为有利,从而促进纤维素酶解。对禾本科原料的纤维细胞壁组分微区分布的共聚焦激光显微镜(CLSM)和透射电子显微镜(TEM)研究发现,化学预处理中木质素和木聚糖的协同脱除从胞间层中开始,并向初生壁和次生壁迁移(图6)[88]。该现象伴随着细胞壁的塌陷和剥离,其表面形貌明显变化,暴露出更多的微纤丝[89]。此外,机械预处理对细胞壁的结构和组分微区分布也存在明显的破坏作用,且这种作用与细胞壁初始的含水率有关[90]。细胞壁中含水率越高,次生壁在机械预处理后受到的破坏更为严重,这是由于次生壁中具有亲水性的碳水化合物含量较其他微区更高,结合水分后更易被破坏降解。综上,生物质预处理效果的影响因素主要包括原料结构特性、预处理方法、预处理强度等。预处理过程中细胞壁三大组分的迁移规律是生物炼制基础研究中的重点,其最终目标是将次生壁中的纤维素微纤丝充分解离,从而使植物细胞壁解构,抗降解屏障完全破除。
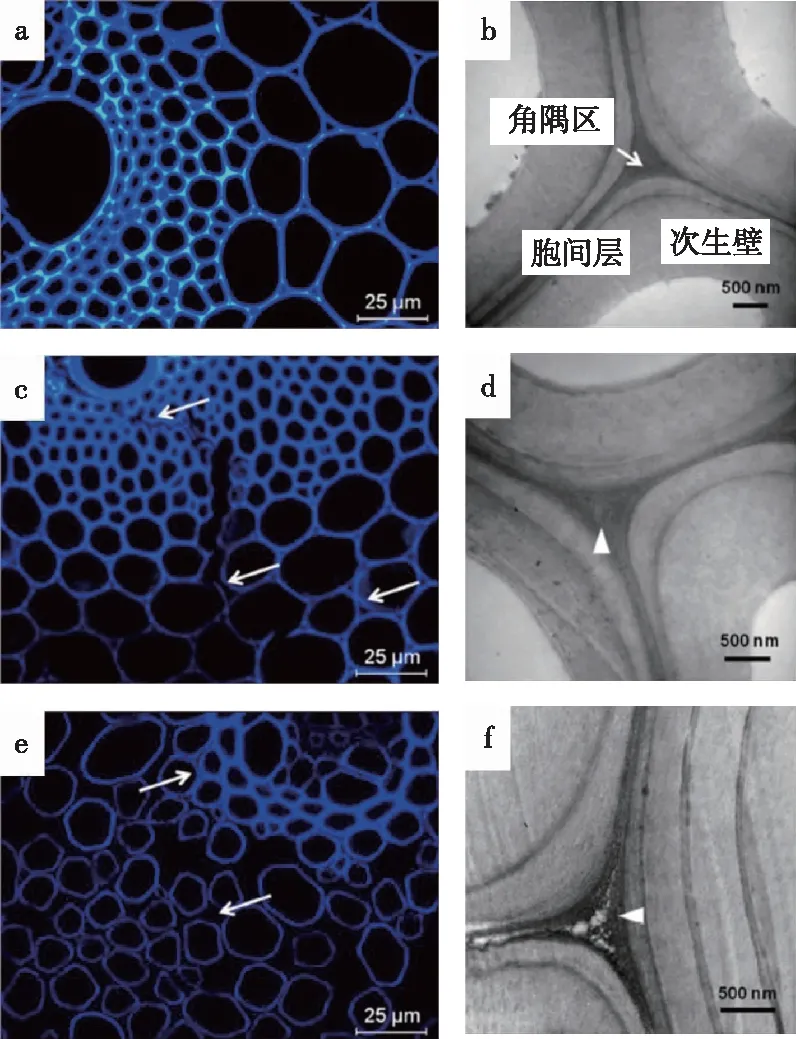
图6 稀酸处理奇岗薄壁细胞壁共聚焦激光显微镜(a,b,c)和透射电子显微镜(d,e,f)成像变化
3 展 望
利用木质纤维原料生产清洁、可再生能源的探索仍是时代发展潮流中的研究热点,其中前期的物料预处理是完成木质纤维素生物转化的必经之路,预处理创新方法的报道也层出不穷。笔者认为未来重点研究方向为:
1)针对纤维素的超分子结构的特异性与纤丝聚集体的尺度复杂性,在高效脱木质素与半纤维素的基础上,建立合理预处理方法,实现微纤丝的高效润胀与解离、结晶纤维素中疏水平面面层间距的扩张以及纤维素的去结晶化,实现全组分协同预处理;
2)细胞壁中纤维素与半纤维素多糖的作用机制研究,即纤维素超分子结构与半纤维素多糖之间的氢键体系构建及在预处理过程中的破解机理。
对预处理过程中纤维素超分子结构的深入研究和发掘,有助于完善生物质抗降解屏障理论体系,并建立宏观、合理的预处理方法策略,全方位破除木质纤维素的抗降解屏障,从而高效服务于生物炼制产业。

