针药结合对脑卒中肢体痉挛大鼠大脑皮质BDNF、TrkB、GABAa受体表达的影响❋
刘未艾, 岳增辉, 谢志强, 谢莉娜, 郭 斌, 王彭汉, 黄麟荇
(1.湖南中医药大学第二附属医院, 长沙 410005;2.湖南中医药大学, 长沙 410208;3.郴州市第一人民医院, 湖南 郴州 423000;4.长沙市第三医院, 长沙 410000)
肢体痉挛在脑血管病中的发生率高达80%[1],严重影响偏瘫肢体的功能康复。如何有效地预防和缓解肢体痉挛,是提高卒中患者生活质量迫切需要解决的问题。研究发现,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF) 通过与其高亲和力的酪氨酸蛋白激酶受体B(tyrosine kinase receptor b,TrkB)结合可促进γ-基丁酸(γ-Aminobutyric acid,GABA)的释放表达,而外源性BDNF增加了GABA能中间神经元的兴奋性。GABA与GABAa受体在突触后膜相结合后,可抑制过度神经元放电,从而防止痉挛的发生[2]。目前针药结合疗法是临床治疗脑卒中后肢体痉挛状态的有效手段。课题组在前期临床研究中证实,经筋刺法结合加味芍药甘草汤能更好地缓解脑卒中后偏瘫患者的肌张力,改善其运动功能,提高生活自理能力[3]。本实验拟进一步探讨电针结合加味芍药甘草汤改善脑卒中后肢体痉挛状态可能的作用机制,为临床筛选有效的治疗方案提供客观的实验依据。本研究已通过湖南中医药大学实验动物伦理委员会审查,伦理审查编号LLBH-20171103。
1 材料与方法
1.1 动物及分组
SPF级健康SD大鼠,月龄3~4个月,体质量240~280 g,实验动物合格证号SCXK(湘)2016-0002,由湖南斯莱克景达动物实验有限公司提供。普通饲料投喂,室温20~25 ℃,相对湿度50%~70%,自然光照,自由进食饮水。动物适应性喂养1周后编号,通过2次随机筛选出的63只SD大鼠分为空白组、假手术组、模型组、电针组、中药组、针药组和西药组共7组各9只。
1.2 药物及其制备
加味芍药甘草汤水煎剂组成:白芍30 g,甘草10 g,炙黄芪30 g,当归15 g,川芎15 g,地龙10 g,鸡血藤15 g,木瓜10 g,桑枝30 g,伸筋草10 g,山茱萸10 g,枸杞子10 g,中药饮片购自湖南中医药大学第二附属医院中药房,按比例配方取药,煎汁将药物浓缩至含生药10 g/ml,置 4 ℃冰箱保存备用。巴氯芬水溶液制作:将巴氯芬片(福安药业集团宁波天衡制药有限公司,批号 180503C01,10 mg/片)研成细粉末,溶于蒸馏水中,配制成为0.27 mg/ml溶液的备用。
1.3 主要试剂及仪器
NMDA受体(M3262),美国 Sigma 公司;Rabbit GABAa抗体(BioswampBioswamp,武汉贝茵莱生物科技有限公司,bs-1232 R);Rabbit BDNF抗体(ab108319),英国abcam公司;Rabbit TrkB抗体(ab18987),英国abcam公司。
大鼠脑立体定位仪(SN-2型号,日本成茂公司);牙科钻(MF4G型号,南京金恒川电子有限公司);微量注射器(5 μl,上海科晓科学仪器有限公司);荧光定量 PCR 仪(CFX-Connect96型号,美国 Bio-Rad 公司);PCR 仪(GE48527型号,杭州柏恒科技有限公司);电泳仪(miniprotean3cell 型号,美国Bio-Rad 公司);全自动化学发光分析仪(Tanon-5200型号,上海天能科技有限公司);电针仪(SDZ-V,苏州医疗用品厂有限公司)及华佗牌针灸针(0.30×13 mm,苏州医疗用品厂有限公司)。
1.4 模型制备
采用改良Zea Longa线栓法+内囊注射NMDA受体法制作脑卒中肢体痉挛大鼠模型[4]。麻醉后,大鼠仰卧固定在手术台上,备皮消毒铺巾;沿颈部正中偏右切口,暴露并钝性分离大鼠右侧颈总动脉和迷走神经,依次向上暴露颈总动脉分叉处、颈内动脉与颈外动脉;分别在颈总动脉远心端、颈内动脉近心端、颈外动脉近心端备用6-0丝线,结扎、夹闭颈内动脉;在离颈总动脉分叉膨大5 mm处剪一小切口,将栓线经切口插入颈内动脉,松开动脉夹。插线完毕后将颈内动脉近心端和栓线一起结扎,逐层缝合切口;大鼠清醒后纳入Zea Longa评分1~3分的大鼠第二天再行内囊注射NMDA法[5]。麻醉后,大鼠俯卧固定于大鼠脑立体定位仪上,备皮消毒铺巾;沿大鼠颅顶矢状缝作纵行切口,逐层分离暴露前囟,暴露右侧顶骨和额骨交界骨缝;按《大鼠立体定位图谱》[6]确定内囊位置,选择前囟后 1.4 mm,矢状缝右侧 2.4 mm,定位用记号笔进行标记;用牙科钻在标记点上钻一直径约2 mm小孔,将微量注射器垂直插入7 mm,缓慢注射5ulNMDA,注射时间维持5 min。完毕后拔出微量注射器压迫止血、消毒,逐层缝合切口。术后均给予以抗感染、防止脑水肿,给予单笼饲养,保持呼吸道通畅。大鼠苏醒后,Ashworth肌张力评分1分,Zea Longa评分1~3分,说明脑卒中后肢体痉挛模型成功。
1.5 分组干预方法
空白组正常饲养;假手术组同模型组一样麻醉,颈部切口,但仅分离不结扎,也不插线,第2天内囊注射生理盐水;各治疗组从造模成功后第1天起开始施以相应治疗方法,每日1次,均治疗5 d。在施以相应治疗措施的同时,除空白组外,各组均同电针组一样行捆绑束缚30 min,假手术组、模型组和电针组均灌服等量生理盐水。
电针组取双侧曲池、阳陵泉。穴位定位参照郭义主编的《实验针灸学实验指导》,并结合解剖学方法进行大鼠穴位定位[7]。阳陵泉:距后三里(在膝关节后外侧,腓骨小头下约5 mm处)上外侧5 mm,直刺6 mm。曲池:桡骨近端的关节外侧前方的凹陷中,直刺4 mm。操作:将大鼠捆绑束缚于鼠板上,采用华佗牌0.30×13 mm一次性使用针灸针,75%乙醇棉签常规消毒针刺,行针时捻转角度在90~180°之间,频率在60~90次/min之间,持续捻转1 min。针后选用SDZ-V电针治疗仪,密波,100Hz,导线的正极接一侧刺入阳陵泉穴毫针的针柄,负极接同侧刺入曲池穴毫针的针柄,以形成刺激回路,以大鼠肢体轻微抖动为度,每次30 min。中药组给予加味芍药甘草汤水煎剂灌胃治疗,针药组先行加味芍药甘草汤灌服再行电针治疗,西药组给予巴氯芬水溶液灌胃治疗。
1.6 行为学检测
1.6.1 大鼠神经功能评分测定 参照Zea longa标准进行神经功能评分。0分为无神经损伤症状;1分为不能完全伸展手术对侧前爪或后爪;2分为行走时向手术对侧转圈;3分为行走时向手术对侧倾倒;4分为不能自发行走,意识丧失。分别在造模后及治疗结束后各进行评分1次。
1.6.2 大鼠肌张力评分的测定 根据改良人类Ashworth肌张力评分法[8]对大鼠综合肌张力进行评分。0级:无肌张力增高,大鼠活动自如;1级:轻微增加,抓握中被动屈伸至最后有小的阻力;1+级:轻度增加,抓握至一半ROM以上有轻度阻力增加;2级:肌张力在大部分ROM中都有较大增加,但肢体被动运动容易;3级:肌张力明显增高,被动活动困难;4级:受累部分肢体强直性屈曲或伸直。为便于数据统计,将0、1、1+、2、3、4级分别记为 0、1、2、3、4、5 分,分数越高说明肌张力越差,并分别在造模后及治疗结束各进行1次评分。
1.7 组织取材
大鼠行为学检测结束后采集标本,断头处死大鼠,冰盘上快速剥离取出大脑皮质放入冻存管,立即放入液氮速冻,-80 ℃保存待测。
1.8 RT-PCR 检测大鼠脑组织皮质区BDNF、TrkB、GABAa受体mRNA 表达
表1示,采用Trizol 一步法提取总 RNA,获得 RNA 溶液,置于-80 ℃冰箱保存备用。RNA 中 DNA 消除:37 ℃ 30 min;Hold,加 1 μL EDTA;65 ℃,10 min。总 RNA 中 DNase1 消除:将反应液加入与其等量的苯酚/氯仿/异戊醇充分混匀,适量 DEPC-H2O 溶解进行反转录。反应条件:42 ℃,60 min;70 ℃,15 min;16 ℃,循环;反转录产物置于-20 ℃保存备用。将制备好cDNA进行PCR扩增,反应程序:95 ℃、3 min,95 ℃、5 s,56 ℃、10 s,72 ℃、25 s,39 个循环;65 ℃、5 s,95 ℃、50 s。计算ΔCt 值,以 2-ΔΔCt分析各基因相对表达量。以β-actin 作为内参基因,引物由南京金斯瑞生物科技有限公司合成。
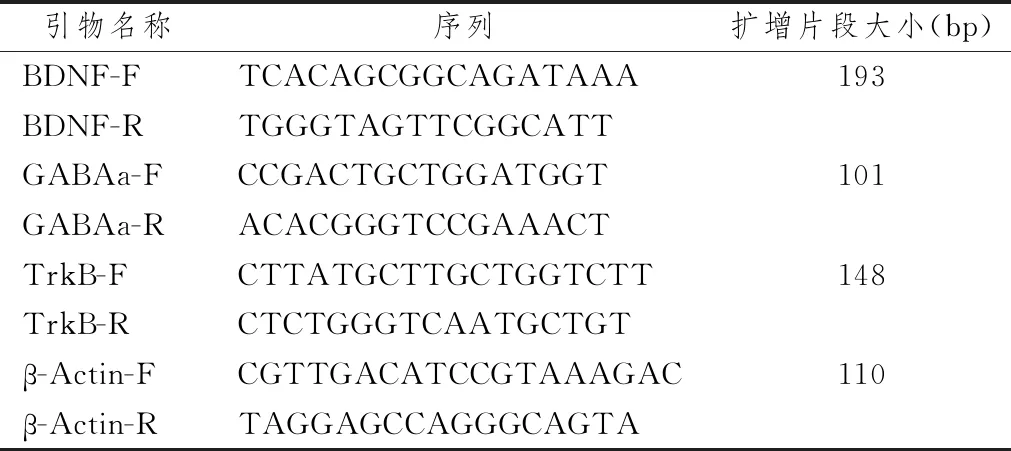
表1 各基因 PCR 引物序列
1.9 Western blot 检测大鼠脑组织皮质区BDNF、TrkB、GABAa受体蛋白的表达
将组织剪成细小的碎片,每20 mg组织加150~250 μL 裂解液,匀浆直至完全裂解。裂解后4 ℃、12000×g 离心15 min,取上清液进行蛋白质定量后贮存于-80 ℃冰箱,根据目的蛋白的分子量选择不同的凝胶浓度(6%、12%),再根据蛋白定量结果取所需蛋白加入适量上样缓冲液,沸水浴10 min使蛋白变性,离心取上清液上样。将配制好的 PAGE 胶放入电泳槽中,加入适量电泳缓冲液转膜。室温封闭 2 h 后加入一抗和膜,室温孵育1 h,膜用PBST洗涤3次×5 min。随后根据用量按1∶10000 稀释 HRP 标记二抗,与膜室温孵育 1 h。PBST 洗3次× 5 min,显色后通过TANON GIS 软件读取相关条带灰度值。
1.10 统计学方法

2 结果
2.1 行为学检测结果
2.1.1 各组大鼠神经功能评分结果 表2示,与假手术组比较,模型组神经功能评分明显上升,差异有统计学意义(P<0.01);与模型组比较,各治疗组神经功能评分下降,差异有统计学意义(P<0.05)。
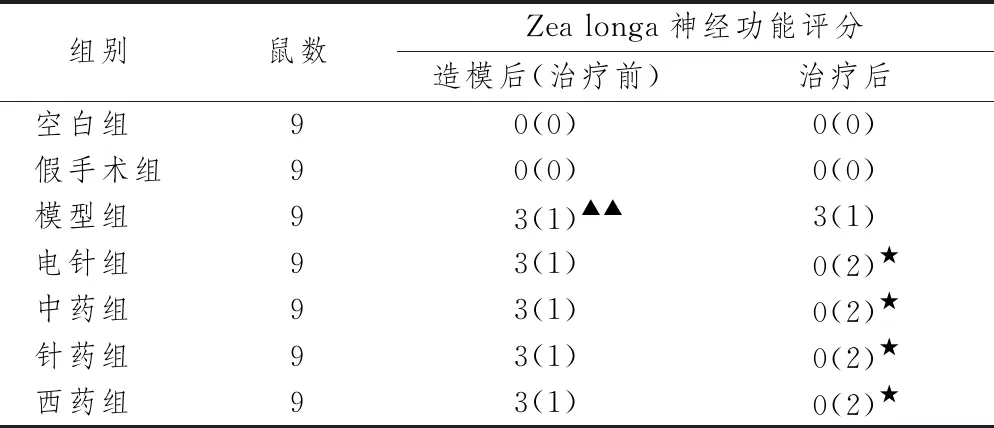
表2 各组大鼠神经功能评分情况比较(M(Q))
2.1.2 各组大鼠Ashworth评分的结果 表3示,与假手术组比较,模型组Ashworth评分明显上升,差异有统计学意义(P<0.01);与模型组比较,各治疗组Ashworth评分下降,差异有统计学意义(P<0.05)。
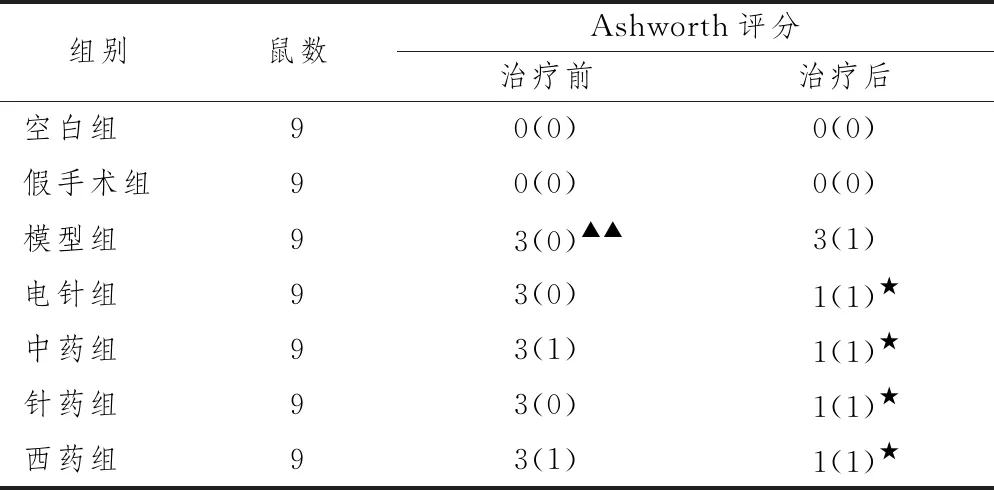
表3 各组大鼠Ashworth评分情况比较(M(Q))
2.2 各组大鼠皮质BDNF、TrkB、GABAa受体mRNA表达的影响
表4示,与假手术组比较,模型组BDNF、TrkB、GABAa受体mRNA表达水平明显下降,差异有统计学意义(P<0.01);与模型组比较,各治疗组BDNF、TrkB、GABAa受体 mRNA表达水平均有显著上升,差异有统计学意义(P<0.05,P<0.01);其中针药组和西药组上升最明显(P<0.05,P<0.01),2组间比较差异无统计学意义。

表4 各组大鼠皮质BDNF、TrkB、GABAa受体 mRNA表达比较
2.3 各组大鼠皮质BDNF、TrkB、GABAa受体蛋白表达的影响
表5图1示,与假手术组比较,模型组BDNF、TrkB、GABAa受体蛋白表达均明显下降,差异有统计学意义(P<0.01);与模型组比较,各治疗组BDNF、TrkB、GABAa受体蛋白表达均有显著上升,差异有统计学意义(P<0.05,P<0.01);其中针药组和西药组上升最明显(P<0.05,P<0.01),2组间比较差异无统计学意义。

表5 各组大鼠皮质中BDNF、TrkB、GABAa受体蛋白表达比较
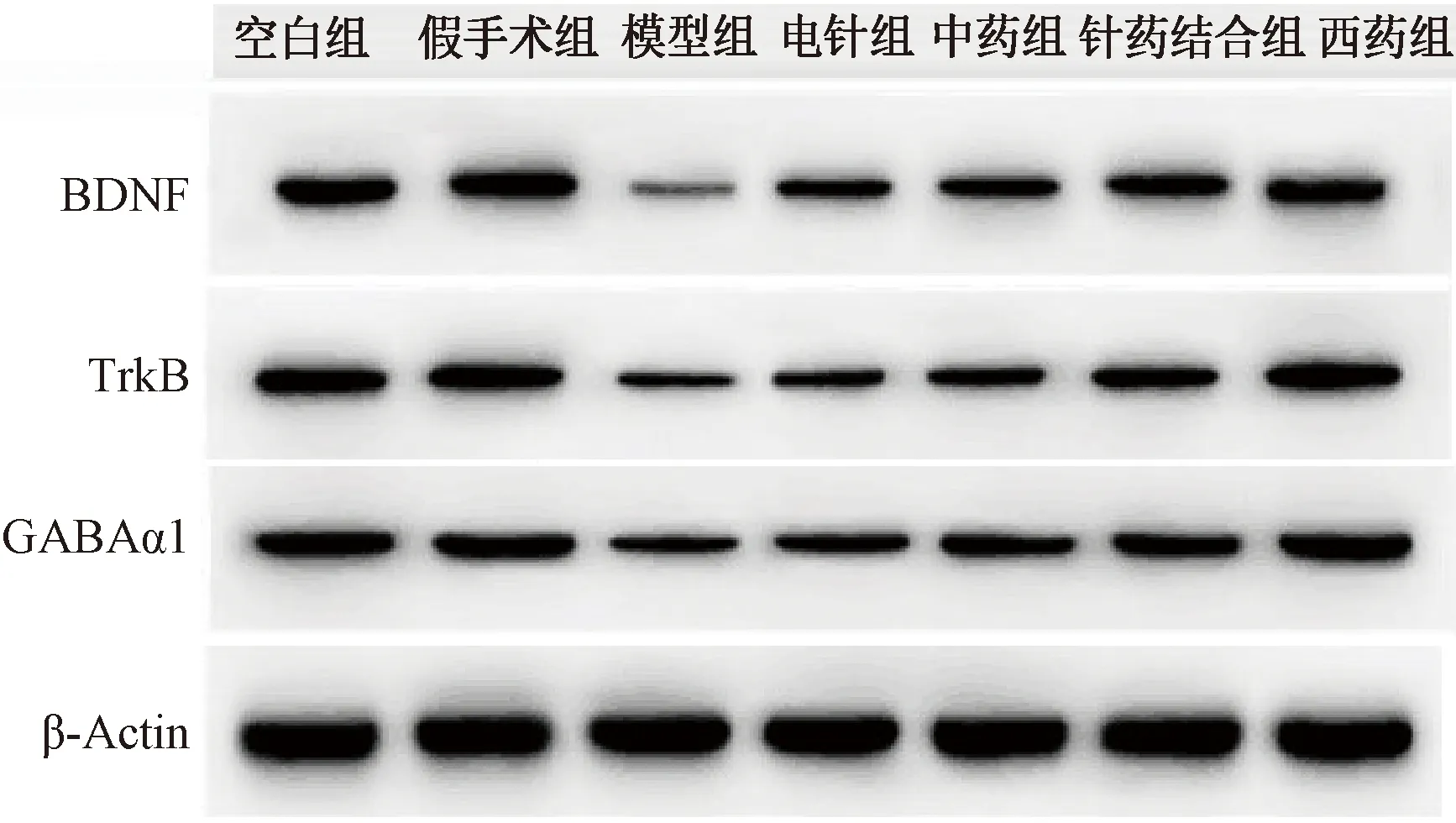
图1 各组大鼠BDNF、TrkB、GABAa受体蛋白免疫印迹图
3 讨论
中医学认为,中风后肢体痉挛状态多因阴虚血少、气滞血瘀、经脉失养所致,其病位在筋,属于十二经筋病候,治则为祛邪扶正、舒筋缓急[9]。阳陵泉是足少阳胆经合穴,为八会穴之筋会,是治疗全身筋病要穴,具有舒筋和壮筋的作用;曲池为多气多血的手阳明经合穴,《太平圣惠方》中说曲池穴能主治中风后痉证“偏风半身不遂,投物不得,挽弓不开,肘臂偏细”[10]。《针灸大成·百症赋》中指出,阳陵泉与曲池二穴在中风病中具有相互联系、协同增效的作用,“半身不遂, 阳陵远达于曲池”[11]。芍药甘草汤是《伤寒论》中治疗“足痉急,不得伸”的名方,具有“酸甘化阴”的作用,临床治疗脑卒中后肢体痉挛具有很好的疗效。方中由白芍、甘草为君药柔肝缓急、解痉止痛;黄芪、当归、川芎、地龙加鸡血藤、木瓜、桑枝、伸筋草为臣药,以益气活血、通经活络,佐以山茱萸、枸杞子滋补肝肾养阴,诸药合用共奏滋阴柔肝缓急、益气活血通络之功[3]。因此,针刺阳陵泉、曲池结合加味芍药甘草汤能更好地缓解脑卒中后肢体痉挛状态,以促进脑卒中患者的康复,提高患者生存质量。
脑卒中痉挛状态是一种以临床肢体偏瘫为表现的运动功能性障碍状态。大脑皮质是人体大脑中掌控运动、认知以及感觉的重要部位[12],大脑皮质激活区模式的变化与脑卒中体感功能障碍恢复有关[13]。BDNF在中枢神经系统特别是在大脑皮质、海马含量极为丰富,TrkB是BDNF的特异性受体,二者高度结合后调控胞内多种信号通路,参与神经元生存、分化、发育,可促进神经元损伤后的再生,维持神经系统的生存及功能,调节海马突触传递和突触可塑性[14]。突触可塑性是脑可塑性的主要表现,脑的可塑性贯穿于脑卒中后神经功能康复的全过程,在保护神经损伤、促进神经功能恢复有重要作用[15]。现代医学认为,神经递质的失衡和紊乱是肢体痉挛发生的物质基础[16]。抑制性递质相对/绝对缺乏或兴奋性递质相对/绝对增加,均可引起和加重痉挛状态[17]。GABA是中枢神经系统中最重要的抑制性递质,与上运动神经元损伤引起的痉挛关系密切。GABA受体可分为三类,即GABAa受体、GABAb受体和GABAc受体,其中GABAa属于离子通道型受体,其与GABA在突触后膜相结合,借助于离子通道可产生快速抑制性突触传递,防止脑内神经元过度兴奋,从而防止痉挛的产生。研究发现,BDNF与GABA存在相互调控作用,除极化的GABAa受体活性触发BDNF的释放;反之,BDNF通过突触前TrkB受体也可促进GABA的释放,并增加细胞表面GABAa受体的表达。BDNF参与调节谷氨酸和GABA能突触的突触后神经递质受体的数量与分布[18],即突触后调控作用,通过升高GABA水平,对GABA能神经可塑性的调节起关键作用[19]。课题组在前期研究工作显示,电针缓解脑卒中肢体痉挛状态疗效显著,其作用机理与调节脑内GABAa受体mRNA表达水平有关[9,20-21]。电针可双向调节大脑皮质中谷氨酸和GABAa受体的表达,从而对脑卒中肢体痉挛产生良好的治疗效果[8]。
本实验为建立一种痉挛状态稳定的脑卒中肢体痉挛大鼠动物模型,造模时注射NMDA受体,通过引起神经元产生迅速而持久的兴奋效应,从而引起肢体痉挛的状态。研究结果显示,针药结合方法优于单纯电针和中药疗法,可促进大脑皮质中BDNF、TrkB、GABAa受体基因和蛋白表达上升,使大鼠的神经功能和肌张力评分明显下降,说明针药结合方法缓解肢体痉挛的作用机制可能与上调BDNF、TrkB、GABAa受体表达水平有关。针药结合方法能有效叠加电针舒筋缓急止痉和加味芍药甘草汤滋阴柔肝缓急的疗效,同时发挥药物和经穴的双重特殊作用。通过影响神经递质,调节大脑皮质运动区神经兴奋功能,从而改善脑卒中肢体痉挛状态。本实验结果为临床应用针药结合治疗脑卒中肢体痉挛提供了一定的实验依据,但其具体是如何通过信号通路来发挥其作用机制的,还有待后续进一步研究探索。

