基于尿液代谢组学探讨咸味致病的生物学机制❋
钟森杰, 李 静, 李 琳, 黄淑敏, 杨 梦, 邱 宏, 程 彬, 胡志希
(湖南中医药大学中医诊断研究所,长沙 410208)
咸味为五味之一,《黄帝内经》中提出咸味由水而生,而肾脏在五行中亦属于水,同气相求,据此明确提出咸味与肾脏相对应,即“咸入肾”理论。“咸入肾”指咸味药食首先作用于肾脏,适量摄入咸味可补益肾气,预防肾脏疾病;过度偏嗜咸味则会影响肾脏功能,并累及他脏而引发疾病,如“味过于咸,大骨气劳,短肌,心气抑”“多食咸,则脉凝泣而变色”等论述[1]。食盐是生活中咸味的主要来源,已有大量研究证据表明,食盐摄入过度是肾脏、心血管功能损伤的常见因素。这与传统中医理论观点不谋而合[2-3]。
代谢组学是系统生物学领域的新兴学科,旨在研究能反映生物体整体功能状态的内源性代谢产物变化规律。代谢组学技术具有整体性、系统性的研究特色,与中医学的整体观存在共性,可作为中医理论研究的延伸与扩展[4]。本研究运用基于气相色谱-质谱联用(gas chromatography mass spectrometer,GC-MS)的代谢组学技术,观察高盐饮食对生物体尿液代谢组学的影响,以期从系统生物学角度阐明过食咸味的影响,探讨与之相关的病理变化机制,并为疾病预防和中医理论客观化发展提供新思路。本研究已通过湖南中医药大学实验动物伦理委员会审查,伦理审查批准编号LL20190902402。
1 材料
1.1 实验动物
SPF级雄性Sprague-Dawley (SD)大鼠16只,6周龄,体质量(200±10) g,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2016-0002。所有大鼠饲养于湖南中医药大学实验动物中心SPF级实验室内,室温18~25 ℃,相对湿度维持在50%~80%之间。
1.2 动物饲料
研究选用实验大鼠普通饲料(0.4%Nacl浓度)与高盐饲料(8%Nacl浓度),高盐饲料由北京科澳协力饲料有限公司制作,质量合格证号1112621900016339。
1.3 试剂与仪器
甲醇(纯度≥99.0%,Cas号67-56-1),美国Thermo科技有限公司;氯仿(纯度>99.0%,Cas号67-66-3),上海沃凯化学试剂有限公司;甲氧基胺盐酸盐(Cas号593-56-6)、吡啶(Cas号110-86-1)、含1%TMCS的BSTFA试剂(Cas号25561-30-2),上海TCI工业发展有限公司。
7890B型气相色谱仪,美国Agilent科技有限公司;Pegasus BT型质谱仪,美国Leco有限公司;H1650-W型低温离心机,德国Eppendorf有限公司;BP-2010A型实验动物血压计,北京Softron有限公司;53050型真空浓缩仪,德国Eppendorf有限公司;QL-866型混匀仪,美国Vortex Mixer有限公司。
2 方法
2.1 饲养方法
所有大鼠给予普通饲料适应性喂养1周,随后以随机数字表法分为高盐饮食组和正常对照组各8只。正常对照组继续给予普通饲料饲养,高盐饮食组给予高盐饲料饲养,每只大鼠每天饲料20 g,自由取水。依据国内外的相关文献报道[5-6],实验大鼠在高盐饮食8周后会出现血压升高、心肾功能损伤等明显的病理表现。故本研究的饲养时间为60 d。饲养期间动态监测大鼠的体质量及鼠尾血压情况,饲养结束后收集大鼠的尿液样本。
2.2 尿液样本采集
尿液样本采集前禁食12 h,采集实验动物的晨间1 h尿液分装至离心管,4 ℃条件下1000 r/min低速离心5 min,提取上清液置于液氮中速冻30 s,-80 ℃冰箱中保存直至上机检测。
2.3 样本处理
样本在4 ℃下融化进行上机检测前的处理。(1)每一样本各取30 μL移至离心管中,加入1 mL乙腈:异丙醇:水溶液(3∶3:2,v/v/v,常温),混匀1 min;(2)4 ℃条件下静置3 min涡旋1 min,重复步骤1操作2次;(3)4℃12000 r/min离心10 min;(4)提取450 μL上清液于真空浓缩仪中浓缩,余下上清液保存备用;(5)样本浓缩后加入80 μL甲氧胺盐吡啶溶液(20 mg/mL)溶解,振荡30 s,80 ℃条件下反应30 min;(6)加入100 μL含1%TMCS的BSTFA试剂,70 ℃条件下反应90 min,12000 r/min离心3 min,取上清液至检测瓶中进行后续的上机检测。
2.4 GC-MS检测条件
气相色谱仪采用DB-5 MS毛细管柱,1μL样品通过自动进样器以分流比10∶1的方式注入。温度设置:进样口为280 ℃,传输线为320 ℃,离子源为230 ℃。升温程序的初始温度为50 ℃,持续0.5 min,以15 ℃/min的上升速率升至320 ℃,并在320 ℃停留9 min。质谱仪采用范围从75到650(m/z)的全扫描方法。
2.5 数据处理
GC-MS检测后获得可用于分析的原始数据,将其格式转换后进行峰识别、峰过滤和峰对齐,获得包含质核比、保留时间和峰面积等信息的数据矩阵。随后进行总峰面积归一化处理,以使不同量级的数据可进行比较。根据Kegg数据库和Metabolon.inc数据库对代谢产物进行鉴定与分类。
2.6 统计学方法
采用SIMCA-P(v13.0)软件和R语言ropls包对处理后的数据进行主成分分析(principal component analysis,PCA)和正交-偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),绘制相对应的得分图。组间差异代谢产物鉴定基于OPLS-DA的第一主成分变量重要性值投影(variable important in projection,VIP),以VIP>1.2视为具有重要贡献的变量,进一步采用单因素方差分析,以P<0.05为最终筛选条件。运用MetaboAnalyst 4.0通路分析软件进行差异代谢产物的代谢路径拓扑分析,以RawP<0.05且Impact>0为条件,筛选出富集性显著的代谢路径。
3 结果
3.1 体质量与血压情况
表1示,高盐饲养60 d后,高盐饮食组与正常对照组比较,高盐饮食组的鼠尾收缩压、舒张压均显著升高,差异有统计学意义(P<0.01);体质量变化不显著,差异无统计学意义(P>0.05)。

表1 2组饲养60 d后大鼠体质量与血压比较
3.2 总离子流色谱图
图1示,GC-MS上机分析后,以离子强度为纵坐标、时间为横坐标,绘制了2组大鼠的代表性总离子流色谱图(total ion chromatogram,TIC)。

注:HS为高盐饮食组(红色),LS为正常对照组(蓝色)
3.3 代谢轮廓分析
经PCA与OPLS-DA分析后得到相应的得分图,以直观反映2组之间的代谢轮廓差异。图2示,2组的样本点均位于置信区间内,分离趋势明显,2组之间无交叉与重合;图3示,2组的样本点均位于置信区间内,呈对称分布趋势,组内聚集良好,组间显著分离。PCA与OPLS-DA得分图反映了2组大鼠的代谢轮廓存在显著差异,提示高盐饮食组大鼠的内源性代谢功能受扰动。

注:HS为高盐饮食组(红点),LS为正常对照组(蓝点)
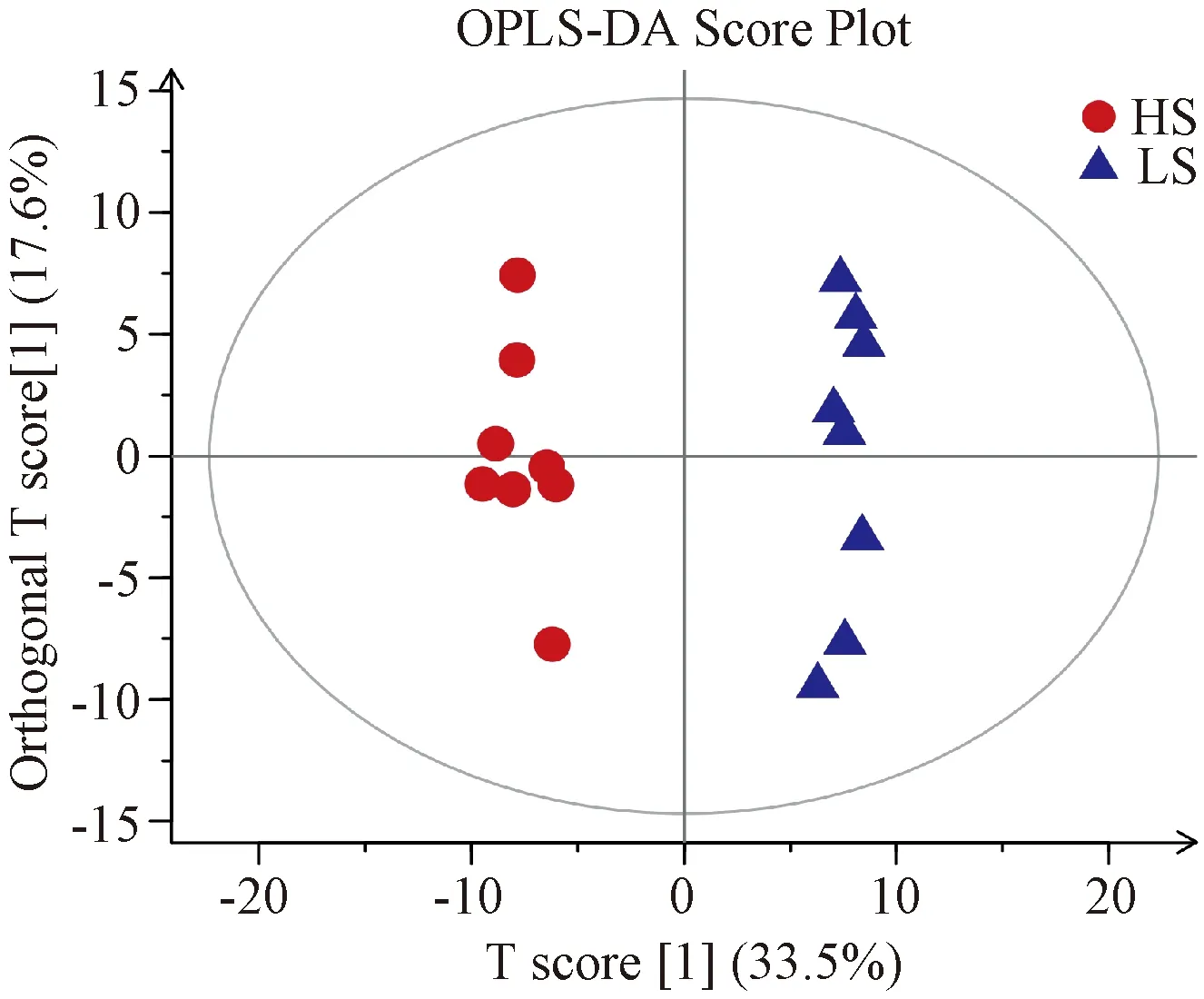
注:HS为高盐饮食组(红点),LS为正常对照组(蓝点)
3.4 差异代谢产物筛选
表2示,本研究以VIP>1.2且P<0.05为筛选条件,挖掘出2组间的差异代谢产物共28种。与正常对照组比较,高盐饮食组的甘露糖、肾上腺素、二氢鞘氨醇、愈创木酚、2-氨基苯酚、木糖醇、来苏糖、蔗糖、核糖、苹果酸、α-酮戊二酸、腐胺、延胡索酸、马来酸表达水平上调;尿嘧啶、草酸、嘌呤核糖苷、N-乙酰基-D-甘露糖胺、2-脱氧-D-半乳糖、腺苷、甘露醇、葡萄糖酸、半乳糖醇、黄嘌呤、尿苷、β-丙氨酸、天冬酰胺、葡萄糖-6-磷酸表达水平下调,并通过Kegg化合物数据检索代谢产物的相关ID号。

表2 差异代谢产物的基本信息表
3.5 代谢路径分析
图4示,代谢路径概要分析结果显示,与高盐饮食组相关的28种代谢产物共参与22条代谢路径,并绘制了代谢路径概要图。表3示,代谢路径拓扑分析结果显示,在RawP<0.05且Impact>0的条件下,共筛选出富集性较为显著的6条代谢路径,视为高盐饮食组大鼠的显著代谢路径。显著代谢路径分别为半乳糖代谢(Galactose metabolism)、丙氨酸、天冬氨酸和谷氨酸代谢(Alanine, aspartate and glutamate metabolism)、嘧啶代谢(Pyrimidine metabolism)、淀粉和蔗糖代谢(Starch and sucrose metabolism)、泛酸和辅酶A生物合成(Pantothenate and CoA biosynthesis)、三羧酸循环(Citrate cycle)。

表3 显著代谢路径分析结果

图4 代谢路径分析概要图
4 讨论
盐的主要成分是Nacl,咸味则是Nacl离解的正负离子共作用的结果。盐的摄入量增加可激活交感神经系统和肾素-血管紧张素系统(renin-angiotensin system,RAS)的活性,增加血容量,多种因素均可导致血压升高[7]。RAS中血管紧张素Ⅰ活性增加,进而刺激肾上腺髓质分泌肾上腺素,因此高盐饮食组的肾上腺素呈高水平表达。高血压是持续高盐饮食的病理表现,而血管炎症则是高血压的关键病理机制,炎症反应可扰动细胞膜并影响细胞膜结构中的鞘脂类物质,体现在二氢鞘氨醇的水平紊乱[8]。肾上腺素、二氢鞘氨醇可作为盐诱导高血压的尿液代谢标志物,值得更为深入研究。
在已鉴定的差异代谢产物与显著代谢路径中,涉及糖类代谢的占比最重。2-脱氧-D-半乳糖、甘露糖和蔗糖参与了半乳糖代谢通路。半乳糖是食物中乳糖水解的产物,半乳糖被生物体吸收后在肝细胞内先后经过一系列酶促反应生成l-磷酸葡萄糖,并进入葡萄糖代谢途径[9]。蔗糖、葡萄糖-6-磷酸参与淀粉和蔗糖代谢通路,淀粉由葡萄糖分子聚合而成,其被生物体摄入后,一部分经唾液淀粉酶水解为麦芽糖,另一部分经胰液淀粉酶水解为葡萄糖而被吸收利用;蔗糖由一分子葡萄糖的半缩醛羟基与一分子果糖的半缩醛羟基相互缩合脱水而成,在生物体内蔗糖酶的作用下可转化为葡萄糖与果糖[10]。此外,葡萄糖经磷酸化生成葡萄糖-6-磷酸。葡萄糖-6-磷酸是糖酵解途径的首个产物,同时作为起始底物参与磷酸戊糖途径,它是各糖代谢途径的共同中间体。上述产物与路径反映糖代谢紊乱是高盐饮食组大鼠的主要代谢表征,提示过食咸味可通过扰动体内的多种糖代谢途径,最终影响葡萄糖的生成与利用。
在丙氨酸、天冬氨酸和谷氨酸代谢通路中,谷氨酰胺在线粒体内经脱氨反应转化为谷氨酸,谷氨酸在谷氨酸脱氢酶、丙氨酸、天冬氨酸转氨酶的作用下转化为α-酮戊二酸,此通路的异常必然导致α-酮戊二酸水平紊乱[11]。α-酮戊二酸是生物体内三羧酸循环(tricarboxylic acid cycle,TCA)的关键中间产物,延胡索酸则是TCA的循环底物,上述物质代谢异常是TCA紊乱的标志[12]。机体获得能量的TCA途径受扰动,同时心脏产能的重要底物葡萄糖呈代谢紊乱状态,将进一步影响心脏稳态和能量代谢,这也可能是在高盐诱导的血压升高后,继而逐步导致心室肥厚、心功能衰竭等病理改变的关键因素[13]。
尿苷、尿嘧啶和β-丙氨酸参与了嘧啶代谢通路,β-丙氨酸和尿嘧啶参与了泛酸和辅酶A生物合成通路,上述两条通路与众多心血管疾病的形成密切相关。泛酸和辅酶A生物合成通路在脂肪酸的合成与氧化方面发挥着重要作用,通路紊乱可导致脂质过氧化反应,进而损伤血管内皮,影响血管的舒缩功能[14]。而在嘧啶代谢通路中,尿苷和尿嘧啶可通过改善心肌细胞线粒体功能和抗氧化系统从而保护心肌,尿液中2种代谢产物的表达水平异常反映机体的心功能受损[15]。
《彭祖摄生养性论》提出“咸多伤心”,即过食咸味会克伐心脏,损伤心之功能并影响血脉运行。基于本次研究结果发现,可能与心脏摄取能量的TCA途径与葡萄糖代谢受抑制相关。心脏的能量代谢效率降低,氧化功能障碍,伴随着耗氧量增加和舒缩功能减退,故可导致心悸、气短、血流缓慢等表现,同时泛酸和辅酶A生物合成通路的异常可致过氧化物堆积,进一步加剧血液运行障碍。这也与中医学理论关于过食咸味的“心气抑”“脉凝泣而变色”等相关症状描述相契合。综上所述,本研究从代谢角度初步阐述了过食咸味的影响及其致病的潜在生物学机制,发现过食咸味的影响机制涉及扰动糖代谢、能量代谢、嘧啶代谢、脂质代谢等多个层面,是一个多因素、多层次的复杂过程。研究结果进一步揭示了与中医理论五味之“咸”相联系的生物学信息,延伸与扩展了中医学五味理论的研究内容,并为疾病的预防提供新思路。

