法舒地尔对慢阻肺合并肺动脉高压患者的MMP-9及血小板指标的影响
周 佳
黑龙江省佳木斯市中心医院呼吸内科 154002
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)合并肺动脉高压(PH)是COPD的严重并发症,肺血管重构是PH持续不可逆的重要病理[1]。全身炎症反应密切参与了COPD合并PH的发生、发展。近年研究表明,基质金属蛋白酶(Matrix metalloproteinase,MMP)在PH血管重构中发挥了重要作用,MMP-9参与了气道及肺血管重建[2],其活性可受到肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白介素-1(Interleukin-1,IL-1)等炎性细胞因子的调节。血小板也被认为是一种炎症介质,在炎性疾病的发展中扮演了重要角色[3]。法舒地尔是新型的异喹啉磺酰胺衍生物类Rho激酶选择性抑制药,近年研究表明,其具有抑制肺动脉平滑肌增殖、改善血管舒张、抑制炎性细胞浸润等作用,能够有效降低肺动脉收缩压[4]。本文采用法舒地尔治疗COPD合并PH患者,并观察了对MMP-9和血小板指标的影响,报道如下。
1 对象与方法
1.1 观察对象 选择2017年5月—2020年5月我院收治的160例COPD合并PH患者。纳入标准:吸入支气管扩张剂后第1秒用力呼吸容积/用力肺活量≥70%;肺动脉平均压安静时>25mmHg(1mmHg=0.133kPa),运动时>30mmHg。排除标准:合并肺炎、支气管哮喘、支气管扩张、肺栓塞等其他呼吸系统疾病;合并原发性血小板增多;合并肢体残疾不宜运动等。其中男89例,女71例,年龄49~82岁,随机分为两组,各80例。
1.2 方法 对照组予常规药物治疗,包括吸氧、止咳、化痰、平喘、强心、利尿等,研究组在常规药物治疗的基础上加法舒地尔(广州白云山明兴制药有限公司,国药准字H20133129)治疗,取30mg药液加入250ml生理盐水静滴,2次/d。两组均连续治疗2周。
1.3 观察指标 (1)两组患者的年龄、性别、体质量指数(Body mass index,BMI)、吸烟指数(计算方法为每日吸烟包数×年数)、COPD病史、年加重次数及严重程度分级(参考2015年GOLD慢性阻塞性肺疾病指南[5])。(2)治疗前后测患者的肺动脉平均压和6min步行实验以判断临床疗效。(3)治疗前后分别抽取空腹静脉血2ml,后离心取上清液,采用酶联免疫吸附测定法 (Enzyme-Linked ImmunoSorbent Assay, ELISA)检测MMP-9水平,试剂盒为美国Promega公司产品。(4)使用BC-5390CRP全自动血细胞分析仪测定血小板计数(PLT)、血小板平均体积(MPV)、红细胞分布宽度(RDW)、血小板淋巴细胞比值(PLR)。
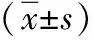
2 结果
2.1 两组患者一般资料比较 两组患者的年龄、性别、BMI、吸烟指数、COPD病史、年加重次数及严重程度分级等一般资料比较差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较
2.2 两组治疗前后临床效果比较 治疗后,两组肺动脉平均压较治疗前明显降低(P<0.05),且研究组明显低于对照组(P<0.05);两组6min步行实验较治疗前明显延长(P<0.05),且研究组明显长于对照组(P<0.05),见表2。
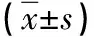
表2 两组治疗前后临床效果比较
2.3 两组患者治疗前后血清MMP-9水平比较 治疗后两组血清MMP-9水平均较治疗前明显降低(P<0.05),且研究组明显低于对照组(P<0.05),见表3。

表3 两组患者治疗前后血清MMP-9水平比较
2.4 两组患者治疗前后PLT、MPV、RDW、PLR比较 治疗后两组PLT、MPV、PLR均较治疗前明显降低(P<0.05),RDW无明显变化(P>0.05),且研究组PLT、MPV、PLR明显低于对照组(P<0.05),见表4。
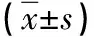
表4 两组患者治疗前后PLT、MPV、RDW、PLR比较
3 讨论
COPD是一种气道慢性炎症病变,具有气流受限与组织重构的特征,反复急性发作可致肺功能加速恶化,是全球重要的公共卫生问题。COPD合并PH是肺心病的危险信号,其主要病理改变为肺小动脉痉挛、血管重构及原位血栓形成,从而引起肺动脉收缩压与肺血管阻力进行性升高。研究发现,Rho激酶信号通路的激活参与了肺血管损伤[6]。法舒地尔作为一种新型的Rho激酶抑制剂,可通过阻断Rho激酶通路而下调多种蛋白酶的活性,抑制血管平滑肌收缩,从而促使血管扩张,有效降低肺血管阻力。大量研究表明,其对COPD合并PH的效果肯定[7]。本文结果显示,治疗后研究组的肺动脉平均压和6min步行实验的改善均较对照组更明显,亦再次证明法舒地尔的效果良好。
COPD合并PH患者存在自身免疫过度激活和持续的炎症反应。肺部炎症反应伴随慢性低级别全身性炎症反应,是肺实质损伤、肺动脉重构及血流动力学改变的重要原因。PH血管重构的发生与细胞外基质失衡有密切关系。MMP-9是一组Zn2+依赖的内肽酶系,研究表明它能通过调控肺动脉胶原纤维的降解参与PH的发生,其分泌增加可导致细胞外基质的动态平衡状态被打破。动物实验表明,抑制MMP-9合成能够减少平滑肌细胞周围基质降解,改善血管弹性,从而降低肺动脉高压[8]。此外,MMP-9可通过调节物理屏障,如劈开4型胶原和变性胶原,从而利于白细胞和淋巴细胞等进入病变部位,促使炎症发生。几乎在所有炎症性疾病中都存在MMPs表达上调,MMP-9主要在炎症细胞表达。研究发现,TNF-α可使单核巨噬细胞MMP-9过度表达,促进炎症细胞浸润。通过诱发的炎症反应,MMP-9发挥了对组织的破坏与重建作用。本文结果显示,治疗后,两组的血清MMP-9水平均较治疗前明显降低,且研究组进一步降低,优于对照组。提示,法舒地尔能够有效降低COPD合并PH患者的MMP-9水平,抑制肺动脉重构。
血小板颗粒可通过分泌并释放大量的生物活性物质引起嗜中性粒细胞及单核细胞黏附和趋化,引发炎症反应。近年研究表明,血小板持续激活是肺心病患者的一个显著特征[9]。COPD患者的血小板激活途径增强,且随着病情的加重,活化程度越强,致使炎症信号扩增,最终引起血小板聚集、血栓形成及组织损伤。动物实验表明缺氧可使血小板增多,有学者因此提出了不成熟的血小板从巨核细胞“脱落”这一学说,即MPV较大的不成熟网状血小板的活跃度很高,可引起血小板功能异常,从而参与到慢性缺氧性肺血管损伤过程中[10]。血小板活化形成血栓过程中可促进炎症介质产生,靶血管病变越严重,PLR升高越明显。MPV与肺动脉收缩压呈正相关[11]。本文结果显示,治疗后两组患者的PLT、MPV、PLR均较治疗前明显降低,且研究组则较对照组进一步降低。提示,法舒地尔能够有效改善COPD合并PH患者的血小板指标。
综上所述,法舒地尔对COPD合并PH具有良好疗效,其中的机制可能与下调MMP-9活性和改善血小板指标,从而抑制炎症反应、逆转肺动脉高压有关。

