IL-33、IL-37在乙肝相关肝硬化患者中的表达及对预后的预测价值
许君伟
河南科技大学第一附属医院感染科,河南省洛阳市 471000
乙型肝炎病毒(HBV)是一种在全球呈现普遍流行的病原菌,数据预估全球约有20亿人曾感染过HBV,约有4亿人携带有HBV病毒,约有2 000万慢性乙型肝炎(CHB)患者,流调学指出,每年死于HBV感染引发的肝功能衰竭、肝硬化后肝癌病例数可达80万人,位居各类致死性疾病的第15位,提示HBV感染已成为全球性的公共卫生事业问题[1-3]。临床实践发现,个体感染HBV后,病原菌会对机体造成持续而慢性的损伤,晚期患者可出现肝功能失代偿、肝硬化或肝细胞癌等多种并发症,因而临床上建议及早对HBV感染患者开展干预[4-5]。近些年随着对乙型肝炎研究的深入,免疫应答机制在肝硬化进程中的作用逐渐被发掘出来,已有多项动物实验表明细胞因子在急性肝炎以及CHB的免疫致病进程中起到了重要作用,其中以T淋巴细胞清除病毒过程中会造成肝细胞损伤为主[6]。白介素-33(IL-33)与白介素-37(IL-37)都是近些年新发现的细胞介素家族成员,上述细胞因子主要通过介导免疫应答来影响炎症反应的发生、调节免疫应答的平衡,已有的研究证实IL-33在慢性病毒性肝炎患者的病程进展中起到重要作用,IL-37则是Treg细胞发挥免疫机能的重要介质[7]。本文旨在探究IL-33与IL-37在乙肝相关肝硬化患者中的表达,并就其对预后的预测价值进行探究,以期为乙肝相关肝硬化患者的临床治疗提供理论依据,现详述如下。
1 资料与方法
1.1 一般资料 选择2014年1月—2019年1月于我院接受治疗的96例乙肝相关肝硬化患者为研究对象,将其按照是否出现肝硬化区分为慢性乙型肝炎组(CHB,50例)和HBV相关性肝硬化组(HBV-LC,46例),另选取同期于我院接受体格检查的50例健康个体为健康对照组(HC)。CHB组中男27例,女23例,平均年龄为(45.98±4.33)岁;HBV-LC组中男23例,女23例,平均年龄为(45.99±5.01)岁,HC组中男28例,女22例,平均年龄为(46.01±4.29)岁。三组患者的性别、年龄对比差异无统计学意义(P>0.05),具有可比性。
1.2 选择标准 纳入标准:(1)入组对象均符合《慢性乙型肝炎防治指南》[8]中关于乙肝相关肝硬化的诊断标准;(2)意识清晰能够配合进行调研;(3)病历资料齐全;(4)调研经医院伦理学会批准实施;(5)患者及其家属对本次调研过程、方法、原理清楚明白并签署知情同意书。排除标准:(1)合并精神疾患者;(2)近1个月内服用抗菌药物治疗者;(3)合并恶性肿瘤患者;(4)合并其他病毒感染者;(5)合并自身免疫系统疾患者;(6)酒精性肝硬化者;(7)合并其他肝脏疾患者。剔除标准:(1)调研期间主动要求退出者;(2)调研期间未按照要求服药者;(3)调研期间失联者。
1.3 干预方法 入组对象采血前1d需清淡饮食,清晨保持空腹状态,使用不抗凝管采集三组个体的外周静脉血5ml,使用低速离心机3 000r/min转速下离心5min,收集三组个体的血清并储存于-80℃条件下,待样本收集完毕后统一采用酶联免疫吸附法(ELISA)开展IL-33与IL-37水平的检测,所应用试剂盒均购自莱尔生物科技有限公司,每个指标检测3次,操作过程严格按照试剂盒说明书进行,取平均值作为最终结果。
入组的CHB与HBV-LC患者按照其病情的差异选择抗病毒药物开展积极治疗,于治疗14d后再次进行血样采集与生物因子水平检测工作。
1.4 观察指标及评测标准 主要观察指标为干预前CHB、HBV-LC、HC三组个体的外周血IL-33和IL-37水平,以及抗病毒治疗后CHB与HBV-LC组患者外周血中的IL-33与IL-37水平;同时在治疗前对CHB和HBV-LC患者使用Child-Pugh量表进行评分,Child-Pugh量表参考如下评分标准:胆红素低于34μmol/L计1分,34~51μmol/L计2分,51μmol/L以上计3分;白蛋白高于3.5g/L计1分,2.8~3.5g/L计2分,2.8g/L以下计3分;无腹水计1分,易控制腹水计2分,难控制腹水计3分;无肝性脑病计1分,轻度计2分,重度计3分;凝血酶原时间延长1~3s计1分,4~6s计2分,6s以上计3分;将上述维度得分相加,即为Child-Pugh量表总分,得分越高代表受试者肝功能损伤越严重[9]。
1.5 统计学方法 将采集的数据录入到Excel表格中,使用统计学SPSS22.0软件进行数据分析,对采集数据开展正态分布检验,如数据符合正态分布,计数资料以[n(%)]表示,对组间差异性分析选择χ2检验,计量资料以(均数±标准差)表示,组间的差异性分析选择t检验,相关性分析使用Spearman进行,多组间差异性比较采用单因素方差分析,取P<0.05为差异具有统计学意义。
2 结果
2.1 三组外周血IL-33与IL-37水平差异比较 经组间比较发现,HBV-LC组患者的IL-33与IL-37水平最高,明显高于CHB组与HC组(P<0.05),同时CHB组的IL-33与IL-37水平也明显的高于HC组,组间比较差异明显(P<0.05),见表1。
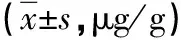
表1 三组外周血IL-33与IL-37水平差异比较
2.2 细胞因子水平与肝功能量表评分相关性分析 经Spearsman相关性分析发现,乙肝相关肝硬化患者外周血的IL-33与IL-37水平与其Child-Pugh量表评分呈现明显的正相关性(r=0.879 5,r=0.636 1,P<0.05),见图1。
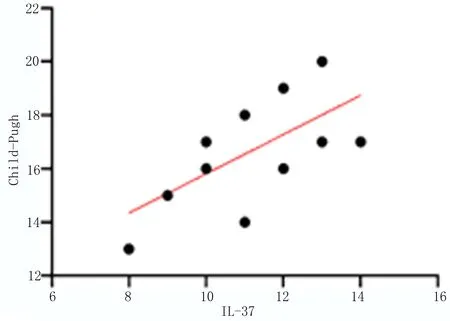
图1 细胞因子水平与肝功能量表评分相关性分析
2.3 治疗前后CHB与HBV-LC组患者细胞因子水平变化分析 经规范化抗病毒治疗后, CHB与HBV-LC组患者的外周血IL-33与IL-37水平均较治疗前有了明显的降低,前后比较差异明显(P<0.05),见表2。

表2 治疗前后CHB与HBV-LC组患者细胞因子水平变化分析
3 讨论
当前的统计数据显示,中国仍然是HBV感染率最高的国家之一,HBV的感染是导致目前国内终末期肝病以及肝硬化相关的肝衰竭以及肝癌致死的主要原因,一项2014年的流调学显示,我国肝癌的新增病例以及死亡人数位居世界前列,其中主要的原因之一即HBV感染[10]。乙型肝炎仍然是当前国内较严重的公共卫生事件,给社会、国家带来了沉重的负担,也对居民健康造成了明显威胁,虽然当前针对HBV感染的研究较多,但乙型肝炎的发病机制尚不明确,其治疗方式更新仍然较为缓慢。近几年关于HBV感染与免疫机制应答方面的研究有所进展,有学者通过动物实验发现,HBV感染机体入侵肝细胞后,会释放出抗原引发机体对其产生免疫应答,该进程中多种免疫细胞(如Th1、Th2、Treg细胞等)均广泛参与并分泌对应的细胞因子参与其中[11]。已有的研究证实,Th1细胞与Th2细胞之间的平衡是维持机体正常免疫的重要前提,而HBV感染后,Th1细胞会处于异常激活状态,Th2细胞则明显功能被抑制,从而导致了肝脏出现炎症病变[12]。
本文就HBV感染与乙型肝炎的相关性进行了初步分析,鉴于免疫应答在乙型肝炎进程中发挥的重要作用,有学者提出是否可通过对细胞因子水平的监测来评估乙型肝炎病情严重程度。IL-33与IL-37都是免疫细胞分泌的细胞因子,其在炎症性与自身免疫性疾病发生、发展中发挥的作用也引起了部分学者的关注。IL-33是一种具有多种生理功能的细胞因子,既能够在细胞核中调节基因表达,又能够分泌到胞质中诱导Th2类细胞炎症,IL-37是抑制性细胞因子的一种,有研究显示,IL-33具有促进细胞分裂和激活NF-κB细胞信号通路的作用,IL-37具有抑制Th1细胞分化及功能表达、促进Treg细胞分化的作用,上述两种因子广泛参与了机体的多种感染性疾病、过敏性疾病和自身免疫性疾病[13]。
本研究通过设立不同分组的方式,就IL-33与IL-37在乙肝相关肝硬化患者中的表达以及对患者预后的预测价值进行了分析,结果显示,同健康个体相比较,CHB和HBV-LC组患者的IL-33、IL-37水平明显升高,且HBV-LC组患者明显高于CHB组患者,提示IL-33和IL-37可能与乙型肝炎相关肝硬化的病理进程存在一定关联。一项针对80例慢性乙型肝炎患者开展的调查研究结果显示,对慢性乙型肝炎患者开展动态病情评估后发现,随着治疗的进行,慢性乙型肝炎患者的IL-33水平也呈现了逐渐降低趋势,且相关性分析显示IL-33水平同患者的HBV-DNA、ALT水平呈现一定的正相关性[14]。本文作者分析认为,IL-33和IL-37都属于IL细胞因子家族的一员,受到炎症刺激后在细胞内表达,并在细胞溶解后大量释放,当个体被HBV感染后,IL-33可以通过激活Th2细胞相关免疫功能来起到宿主保护作用,这提示IL-33与IL-37均与肝脏的炎症进程相关,HBV-LC、CHB、HC病情呈现减轻趋势,因而其IL-33和IL-37的水平也在逐渐降低。文中进一步对入组对象开展Child-Pugh量表评估,展开了IL-33、IL-37与肝功能的相关性研究,结果显示,乙肝相关肝硬化患者外周血的IL-33与IL-37水平与其Child-Pugh量表评分呈现明显的正相关性,这与张晓慧等[15]的研究结果相一致。本文经过积极的抗病毒治疗后,患者的IL-33和IL-37水平明显降低,这说明随着慢性乙型肝炎患者临床症状的改善,患者外周血中免疫细胞因子的水平也有所变化,这与前文中不同病程患者外周血IL-33和IL-37水平不同相呼应。
综上所述,乙肝相关肝硬化患者外周血中的IL-33与IL-37水平明显升高,合并肝硬化患者尤为明显,经抗病毒治疗后患者的IL-33与IL-37水平明显降低,提示其在CHB的发生、发展和转归中具有重要作用,可考虑将上述因子作为疗效免疫评估指标之一。

