基因突变与转移性肾透明细胞癌患者VEGF靶向治疗预后的关系
刘睿 张铭鑫 李丹 梁晔 梁志娟 王丽萍 牛海涛
(青岛大学附属医院泌尿外科,山东 青岛 266003)
肾细胞癌是人类最常见的恶性肿瘤之一[1],全世界每年新确诊的患者超过30万,其中肾透明细胞癌(ccRCC)占肾细胞癌的70%~85%,死亡率也最高[2]。近年来,随着治疗技术的不断发展,靶向治疗已经成为晚期肾癌患者除手术外的常规治疗方案。目前美国食品药物监督管理局(FDA)批准的一线治疗方案主要有舒尼替尼、帕佐帕尼等[3],其中晚期肾癌临床最常用的是以血管内皮生长因子受体(VEGFR)为靶点的药物,如舒尼替尼和索拉非尼等。另外,随着对肾癌基因组学的研究发现,某些基因如PBRM1、BAP1和SETD2等的突变能够抑制肿瘤的进展[4],但目前尚不清楚这些基因突变与VEGF靶向治疗临床反应的相关性。为了进一步研究ccRCC基因突变与患者VEGF靶向治疗反应之间的相关性,本研究收集了转移性ccRCC患者的肿瘤组织标本,通过全外显子组测序分析高频突变基因在转移性ccRCC患者VEGF靶向治疗中的临床意义。
1 对象与方法
1.1 研究对象
选取我院15例转移性ccRCC患者进行全外显子测序。纳入标准:转移性ccRCC患者,且进行了舒尼替尼或索拉非尼靶向治疗。同时选取TCGA数据库中符合纳入标准的转移性ccRCC患者5例,纳入其全外显子组测序结果。共20例接受一线VEGF靶向治疗的ccRCC患者被纳入本研究,患者中男17例,女3例。患者中位随访时间为3年,中位无进展生存期(PFS)为14.5个月。有11例患者从诊断到接受靶向治疗的时间小于1年。其中IMDC风险分层低、中、高度风险的患者分别为3、14和3例。使用索拉非尼和舒尼替尼的患者分别为15、5例。有3例患者曾接受过免疫因子治疗。肿瘤最常见的转移部位是肺和淋巴结。本研究获得青岛大学附属医院伦理委员会的批准(审批号:QDFYWZLL26239),并严格按照《人类和动物权利声明》以及《赫尔辛基宣言》的要求进行相关研究工作。
1.2 全外显子测序方法
1.2.1石蜡标本DNA的提取 取患者术中切除的肾癌病理组织制成的石蜡切片,进行脱蜡并以无水乙醇干燥。用石蜡样本DNA提取试剂盒(MagMax FFPE DNA/RNA Ultra Kit,cat# A31881, Thermo Fisher)在全自动核酸提取仪 (Thermo Fisher)上提取DNA并纯化。
1.2.2全外显子测序样本库的制备 将纯化后的DNA在超声波破碎仪(Covaris S220 sonicator)上打断为长度小于350 bp的片段;用核酸纯化试剂盒(AMPureXP,cat#A63881,Agencourt/Beckman) 磁珠纯化后加上接头的DNA片段;通过Herculase Ⅱ Fusion HS DNA聚合酶系统进行捕获前PCR预扩增并同时添加引物;随后,在PCR仪上进行外显子杂交捕获(65 ℃ 1 min,37 ℃ 3 s,循环60次);利用链霉亲和素磁珠(T1 Steptavidin magnetic beads)净化提纯捕获到的DNA外显子库;最后,进行捕获后PCR扩增并再次用磁珠(AMPure XP)净化提纯。
1.2.3全外显子测序及基础变异分析 将制备好的全外显子DNA库在测序仪(Illumina NovaSeq-6000)上进行测序。测序原始照片用RT3(Illumina)软件进行碱基识别,然后用cutadapt程序进行适配性调整,用Sentieon(San Jose, CA, USA)软件集成环境滤去低质量读数量,并调用BWA算法与NCBI hg19人类参考基因组比对,GATV 3.5软件处理后得到患者全外显子序列。VarscanIndel, CNVnator软件分别得到患者的单核苷酸变异、插入缺失和拷贝数变异等基因突变数据。
1.3 统计学方法
采用SPSS 22.0软件进行有关统计学分析,采用Kaplan-Meier方法对PFS进行分析,并且基于Logrank检验对基因变异情况进行比较。结合风险标准和突变状态,利用Cox回归评价突变型(MT)与野生型(WT)患者发生肿瘤进展概率的比值即风险率(HR)。
2 结 果
本研究结果显示,突变率最高的基因为VHL(55%),其次为BRM1(35%),后依次为SETD2(20%)、PRDM16(15%)和BAP1(15%)。见图1。为了保证数据分析的准确度,本研究仅选取了研究队列中突变频率≥5%的基因进行分析,其中VHL和PBRM1基因的突变频率与TCGA数据库中的结果基本吻合,而BAP1和SETD2基因的突变频率较TCGA数据库中相关基因的突变频率高。同时,在本研究中被发现的具有较高突变频率的PRDM16基因在TCGA数据库中的突变率较低,仅为0.6%。
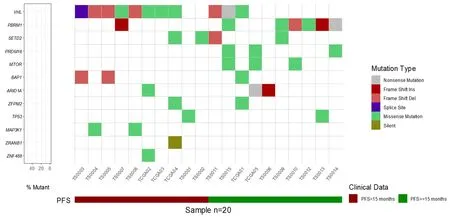
图1 入组患者高频突变基因分布情况
本组患者PFS为3~32个月,大部分患者的PFS小于20个月。VHL、SETD2、BAP1、MTOR以及ARID1A基因突变与患者PFS无明显关联。PBRM1基因MT患者的中位PFS较WT患者明显延长(χ2=5.45,P<0.05;HR=0.34,95%CI=0.12~0.96)。PRDM16基因MT患者的PFS较WT患者明显延长(χ2=8.22,P<0.05;HR=0.09,95%CI=0.01~0.76)。见表1。

表1 患者PFS、HR与基因突变的关系
3 讨 论
近年来已有多种VEGF靶向药物用于ccRCC的一线治疗,临床获得明显疗效。本研究通过全外显子测序技术探讨转移性肾透明细胞癌的基因突变与患者VEGF靶向治疗预后的相关性,为VEGF靶向治疗提供与预后相关的基因突变标志物。
本研究结果显示,PBRM1和PRDM16基因突变与患者VEGF靶向治疗预后相关联。研究显示PBRM1和PRDM16基因突变参与了HIF-VEGF轴的调控过程[5-6],而BAP1与SETD2基因突变频率增加可能与ccRCC患者的晚期进展有关[7-8]。本研究中VHL基因突变对患者预后无明显影响,迄今为止对VHL基因突变和VEGF靶向治疗预后关系的研究结论并不一致,可能还需要深入研究进行验证[9-12]。在ccRCC中,VHL基因是HIF轴最常见的调控因素[13],而HIF是影响肾癌发展的关键因素,其靶基因编码包括VEGF在内的多种可以促进肾癌发生和进展的蛋白质,而HIF积累会导致VEGF调节失控,进而促进肿瘤血管化程度的升高。
PBRM1是晚期ccRCC中最常见的突变基因,其编码的含溴结构域蛋白BAF180参与多种DNA修复过程,而PBRM1基因突变通常表现为基因表达的缺失[14]。在肾癌细胞系当中HIF-1α蛋白表达缺失非常常见,而HIF-1α缺失的细胞系主要通过HIF-2α调节VEGF产生[15]。因此当HIF-1α不表达时,PBRM1作为HIF-1α和HIF-2α的共同激活因子会诱导HIF-2α的表达,进而促进肿瘤生长[16]。已有研究表明,PBRM1基因突变在局限性和晚期肾癌中具有不同的作用,在局限性肾癌中PBRM1基因突变会导致预后不良,而在晚期肾癌中则与预后良好相关[17]。一份来自RECORD Ⅲ的临床试验报告表明,PBRM1基因的突变可能是一种靶向治疗预后良好的预测标志物[6,12]。本研究的结果显示,PRDM16基因突变与患者PFS延长有关。研究表明PRDM16基因可以通过抑制HIF的靶基因SEMA5B来下调VEGF的表达,从而抑制肿瘤的生长和侵袭[18]。通常,肾癌组织中的PRDM16基因甲基化水平会发生明显升高,导致其表达量较正常组织显著下降[19]。这会导致肾癌组织中本应被PRDM16基因产物抑制的下游HIF应答基因SEMA5B被激活,而激活的SEMA5B基因则会通过促进VEGF表达来支持体内肿瘤的生长[5]。由此我们推测PRDM16基因突变可能改变了其启动子区域的甲基化修饰状态,解除肾癌组织中PRDM16沉默。总之,以上研究揭示了PBRM1和PRDM16对VEGF表达的分子调控机制。
本研究中仍存在着一些局限性:①肿瘤的异质性。这是一个重要的混杂因素,本研究仅对所选取的20例患者全外显子组测序结果进行分析评估,无法识别肿瘤进化过程中的所有驱动因素。一项针对原发性肾癌的多核心活检研究指出,要保证肿瘤基因分型的准确性至少需要在3个不同的肿瘤区域进行采样[20],然而这在常规的临床工作中比较困难。②纳入本研究的患者存在接受多种靶向药物治疗的情况。虽然收录使用多种VEGF靶向药物治疗的样本会增加结果的异质性,但这种分布却也更符合临床治疗中患者的实际情况。③样本数量限制。虽然在本次研究中得出了一些具有统计学意义的结论,但样本数量有限,希望以后这些结论可以在更大的样本中得到进一步验证。
综上所述,本研探索ccRCC中VEGF靶向治疗预后和基因突变之间的关系,发现PBRM1以及PRDM16基因突变与转移性肾透明细胞癌VEGF靶向治疗预后良好密切相关,有助于指导临床治疗中VEGF靶向药物的应用。虽然本研究仅阐明了以上基因突变与患者VEGF靶向治疗之间的潜在联系,但在基因突变的基础上预测靶向治疗效果并筛选预后良好标志物,有助于为患者选择最佳个体化治疗方案,从而为ccRCC患者的临床靶向治疗提供一定的理论指导和依据。

