基于平扫MRI机器学习模型评估兔肝纤维化分期
李 硕,付雅晴,郭冬梅*,董 洋,刘 惠
(1.大连医科大学附属第二医院放射科,辽宁 大连 116027;2.大连理工大学电子信息与电气工程学部,辽宁 大连 116024)
肝纤维化为肝硬化早期阶段,去除病因并早期干预可逆转纤维化[1]。目前肝活检是诊断肝纤维化的“金标准”,但因有创而应用受限。基于影像学图像的计算机辅助诊断(computer-aided diagnosis, CAD)技术可挖掘人眼无法识别的图像信息以辅助诊断疾病。机器学习是CAD技术中应用最广泛的一种,已逐渐用于肿瘤等[2-4]并取得一定进展。MRI定量参数可用于分期诊断肝纤维化[5],但基于影像学图像的CAD技术预测肝纤维化分期的研究尚不成熟,且多采用图像纹理特征提取与统计学分析相结合或传统分类器识别方法[6-7]。本研究建立兔肝纤维化模型,基于脂肪抑制T1WI(T1WI-fat suppression, T1WI-FS)构建半监督学习(semi-supervised learning, SSL)与主动学习(active learning, AL)相结合的新兴分类器模型,评价该模型分期诊断肝纤维化的价值。

图1 腹部T1WI-FS示兔各期肝纤维化 A.F1期(轻度肝纤维化); B.F2期(中度肝纤维化); C.F3期(重度肝纤维化); D.F4期(肝硬化早期)
1 材料与方法
1.1 实验动物及肝纤维化模型建立 清洁级雄性新西兰大白兔35只,体质量2.5~3.0 kg,由大连医科大学动物实验中心提供,动物许可证编号:SYXK(辽)2013-0006;随机分入实验组30只及对照组5只。实验组予颈部皮下注射四氯化碳与橄榄油1∶1混合溶液建立肝纤维化模型,每周2次,注射10周,1~3周0.1 ml/kg体质量,4~6周0.2 ml/kg体质量,7~10周0.3 ml/kg体质量;对照组每周2次颈部皮下注射等量生理盐水。
1.2 仪器与方法 采用GE Discovery MR 750W 3.0T MR扫描仪,8通道膝关节HD线圈。于注药后第5、6、7、10周末分批次采集2组兔腹部MRI,实验组第5、6、7周末每次扫描7只兔,第10周末扫描9只;对照组第5、6、7周末每次扫描1只,第10周扫描2只。
扫描前8 h前停饲,4 h前停饮。于兔耳缘静脉注射2.5 ml/kg体质量10%水合氯醛麻醉后,取仰卧位腹带加压保定,采集腹部T1WI-FS(图1),TR 4 000 ms;TE 2.9 ms;FOV 20 cm×16 cm,层厚 4 mm,层间距 1 mm,矩阵192×192,NEX 3次。

图2 组织病理图示兔各期肝纤维化(Masson, ×100) A.汇管区扩张(F1期); B.汇管区周围纤维化(F2期); C.大量纤维间隔形成(F3期); D.肝纤维化早期(F4期)
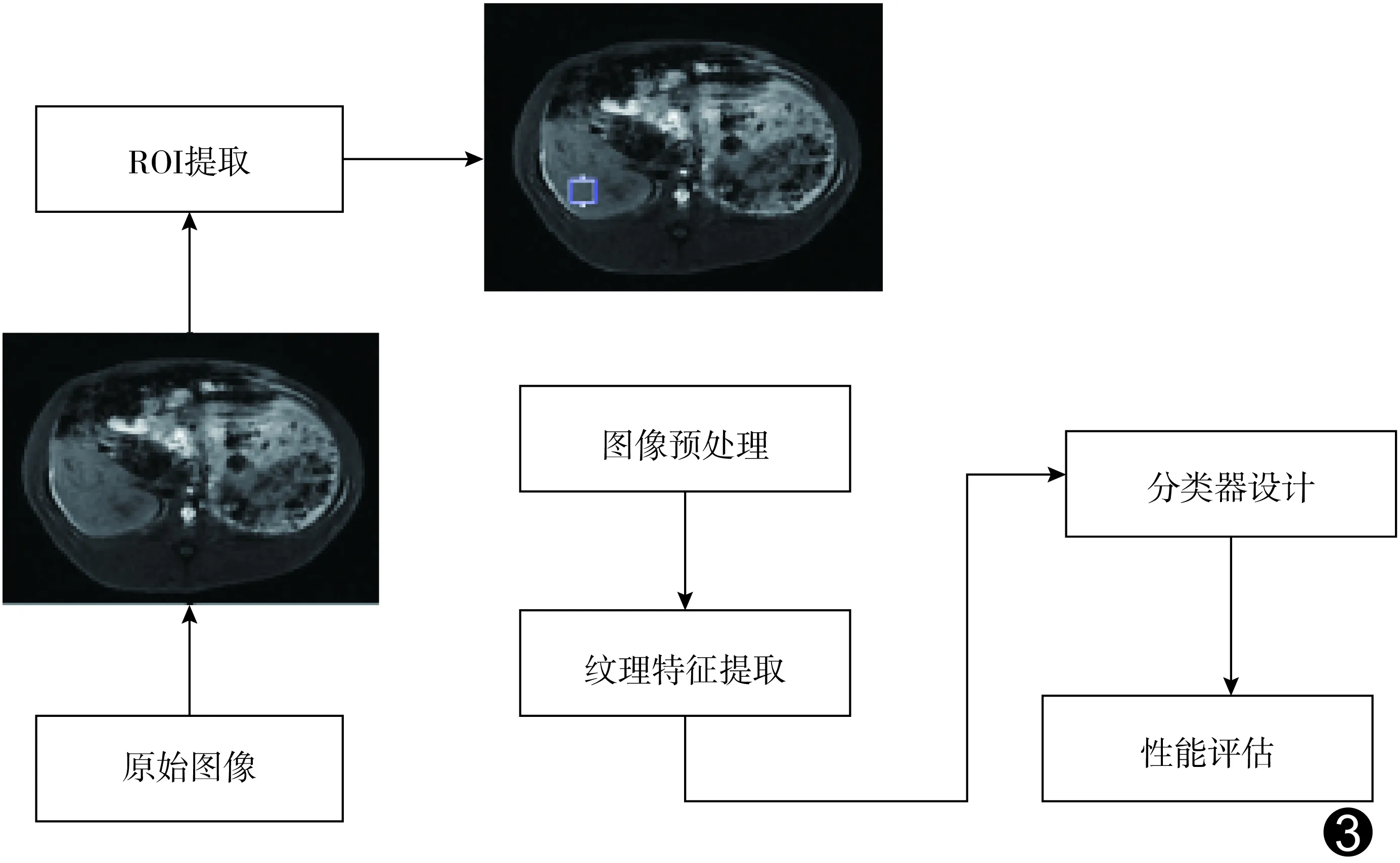
图3 机器学习模型建立流程图
1.3 病理检查 MR检查结束后立即处死动物,取出肝脏,置于10%甲醛溶液中固定后制成病理切片,行HE染色及Masson染色(图2)。由2名病理科主任医师根据METAVIR评分系统对每个肝叶的纤维化程度进行分期,分为F0~4期,再合并为正常肝(F0期)、早期肝纤维化(F1~2期)、晚期肝纤维化(F3~4期)3组[8]。
METAVIR分期标准:F0,无纤维化;F1(轻度纤维化),无纤维间隔形成,小叶结构完整;F2(中度纤维化),少量纤维间隔形成,小叶结构大部分保留;F3(重度纤维化),出现大量纤维间隔,小叶结构破坏,尚未出现肝硬化;F4,肝硬化早期。
1.4 机器学习模型建立 流程见图3。
1.4.1 提取ROI 依据扫描层厚、层间距及大体标本情况,以3 mm为基准单位切割标本,测量实验组阳性部分与肝边缘的距离,以此为标准在T1WI-FS上定位ROI:对照病理结果,在显示相应肝叶的连续3个层面上采用Matlab软件勾画20×20像素的方形ROI,尽量避开伪影、肝内血管、胆管、胆囊及肝缘等区域[9]。对照组依据所切取标本肝叶位置勾画ROI,方法同上。
1.4.2 提取与选择纹理特征 采用灰度共生矩阵(gray-level co-occurrence matrix, GLCM)算法提取纹理特征。以Python软件将图像自动量化至统一的灰度等级0~32级。选取常见16种纹理特征,将量级化ROI图像按照病理结果所示肝纤维化分期输入Python软件,分别计算4个方向(0°、45°、90°及135°)的16维特征向量,即每个ROI对应64个纹理特征参数值;采用取均值方法选择特征,最终每个ROI对应1个16维特征向量[10],分别为能量、对比度、逆差距、方差、熵、惯性矩、相关性、和平均、和熵、和方差、差熵、差方差、相关度量信息1、相关度量信息2、平均灰度值及标准差。
1.4.3 设计分类器模型 以五折交叉验证测试经图像量级化的ROI,设置10个有标签数据,其余作为未标记数据。采用SSL与AL相结合算法构建分类器模型。
1.4.4 评估肝纤维化分期 对输入分类器模型中的ROI分别进行五期分类(F0~4期)和两两分类(F0 vs F1~4、F0 vs F1~2、F0 vs F3~4、F1~2 vs F3~4、F0~2 vs F3~4)测试与训练,以Python软件中机器学习模型库中的标签传播算法计算分期准确率及平均准确率。准确率=正确判断(简称正判)肝纤维化分期ROI数目/本期ROI总数,平均准确率=肝纤维化各期正判ROI数目之和/各期ROI总数之和。
2 结果
实验组造模过程中2只兔死亡,对照组全部存活。依据病理结果共选取180个ROI,其中F0期32个、F1期37个、F2期33个、F3期54个、F4期24个;F1~2期70个、F3~4期78个。
2.1 五期分类识别 分类器模型正确判断F0期28个(均为对照组)、F1期15个、F2期22个、F3期35个、F4期9个,F0、1、2、3、4期评估准确率分别为87.50%(28/32)、40.54%(15/37)、66.67%(22/33)、64.81%(35/54)及37.50%(9/24),平均准确率60.56%(109/180)。
2.2 两两分类识别 分类器模型对F0 vs F1~4、F0 vs F1~2、F0 vs F3~4、F1~2 vs F3~4及F0~2 vs F3~4的评估平均准确率为95.56%、95.10%、96.36%、68.92%及65.56%,见表1。
3 讨论
3.1 以T1WI-FS建立机器学习模型评估肝纤维化分期的依据 增强图像在医学图像与机器学习相结合分析各种疾病中的应用价值较高,如LI等[11]发现增强MRI可分析非WNT激活型及非SHH分子分型髓母细胞瘤患者的预后;FENG等[12]报道,增强MRI可评估肝细胞癌分化程度;但增强图像存在扫描时间长、对比剂不耐受可能等不足。本研究基于平扫MRI构建机器学习模型,以预测肝纤维化分期。肝纤维化的实质是纤维结缔组织增生,T1WI可更大限度凸显肝脏纹理特征。SCHAWKAT等[13]认为基于T1WI的纹理分析鉴别早期纤维化与晚期纤维化的准确率高于T2WI-FS。HOUSE等[14]采用基于T2WI的机器模型评估肝纤维化分期,其区分F0与F1~4期的准确率为91%。本研究基于T1WI-FS建立机器学习模型,区分F0与F1~4期的准确率达95.56%。此外,T1WI-FS还可减少脂肪变性对结果造成的偏差。
3.2 纹理特征提取与特征选择方法 GLCM除可计算医学图像灰度值外,还可分析灰度的空间分布情况。肝纤维化纹理特征具有弥散性,应计算不同方向的特征,故本研究分别计算了4个方向的GLCM,每个ROI对应64个纹理特征参数值;但特征参数过多可能造成计算时间延长,故需要优选参数特征,依据经验采用取均值方法,使其每个ROI对应1个16维特征向量,以减少特征参数的数量,提高计算速度。
3.3 分类器预测结果 分类器模型对F0~4五期分类中F0期的评估准确率为87.50%,提示规避肝脏边缘、血管、胆管等提取纹理特征可用于区分健康肝与肝纤维化。模型对F1期误判概率较高,原因可能是F1期肝小叶结构完整,但其内已出现纤维瘢痕,其纹理特征介于F0期与F2~3期之间,故可能误判;对F4期识别准确率较低,可能因F4期肝纤维弥漫性增生,肝实质受损甚至存在炎性改变,原始图像灰度值较低,较难区分纤维成分与肝内细小血管,导致勾画ROI时存在一定误差。两两分类识别可降低五期分类时计算机误判误差,准确率优于五分类,F0与F1~4期对比时准确率达90%以上,且区分F0与F3~4期准确率最高,为96.36%。扩大样本量并对置信区间较低的标签样本进行人为标记后可有效减少误差,但包含F4期分组的混淆矩阵误判仍较F1~2期稍高,说明当细胞外基质过量持续沉积时,MRI呈现的不均匀网格状信号分布杂乱无章,导致出现预测偏差。TAKESHI等[15]发现,合并分期有利于分期诊断肝纤维化,且诊断≥F2期肝纤维化的效能较好;KAYAALTI等[16]采用CT图像纹理特征评估肝纤维化分期,证明基于支持向量机(support vector machine, SVM)分类器及K近邻(K-nearest neighbor, KNN)分类器的合并分期评估效能较好,准确率达95%。本研究构建的SSL与AL相结合的分类器模型评估准确率与传统SVM等分类器相仿,甚至略高于传统分类器,可预测兔肝纤维化分期。
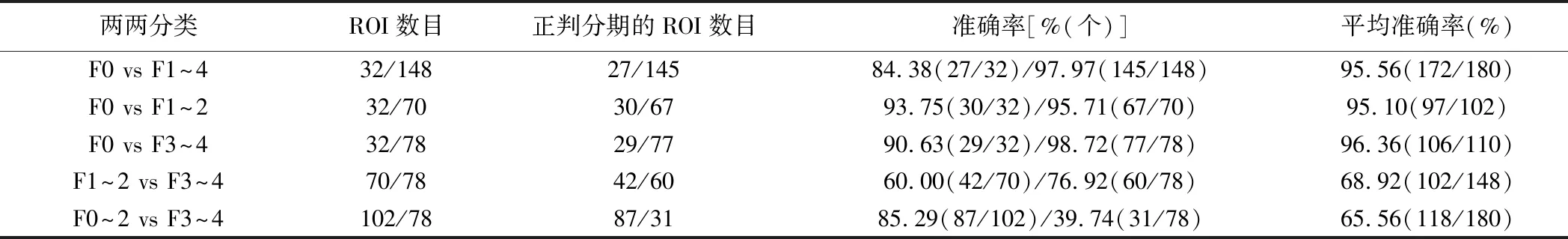
表1 两两分类识别肝纤维化分期的准确率
本研究的主要局限性:样本量不足,导致测量结果存在偏差;体外肝脏形态与在体形态并非完全一致,病理与ROI定位对照仍存在一定误差;未对比分析基于T2WI及增强图像的机器学习模型。