常规超声联合声脉冲辐射力成像预测新辅助化疗对乳腺癌的效果
彭 娟,刘 娜,蒲 欢,贾 妍
(武汉大学人民医院超声影像科,湖北 武汉 430060)
新辅助化疗(neoadjuvant chemotherapy, NAC)指对未发现远处转移的初治乳腺癌患者于局部治疗前进行的全身化学治疗(简称化疗)。早期准确预测NAC疗效对选择手术时机及个体化治疗具有重要意义[1]。常规超声(ultrasound, US)主要通过观察肿瘤形态学变化评估NAC疗效,主观性较强。声脉冲辐射力成像(acoustic radiation force impulse imaging,ARFI)技术能提供肿瘤硬度变化的生物力学依据,且重复性较好[2]。本研究观察US联合ARFI技术预测NAC对乳腺癌疗效的价值。
1 资料与方法
1.1 一般资料 回顾性分析2018年8月—2020年7月武汉大学人民医院收治的52例女性乳腺癌患者,年龄33~79岁,平均(48.0±9.1)岁。纳入标准:经穿刺活检证实乳腺癌,病灶单发且无远处转移;接受NAC,疗程结束后手术切除肿瘤并获取病理学结果;入组前未接受其他抗肿瘤治疗。
根据穿刺活检肿瘤分子分型确定NAC方案,包括以蒽环类为主的“CEF”方案(环磷酰胺600 mg/m2、表阿霉素75 mg/m2及5-氟尿嘧啶600 mg/m2)和以紫杉类药物为主的“TEC”方案(多西紫杉醇75 mg/m2、表阿霉素75 mg/m2、环磷酰胺500 mg/m2),每周期21天;患者接受6~8个周期NAC,并于全部疗程结束1周内接受手术。
1.2 仪器与方法 由2名具有5年以上工作经验的乳腺超声专科主治医师进行检查与测量。采用Siemens Acuson S3000超声扫描仪,9L4线阵探头,频率4~9 MHz,配备ARFI软件,分别于NAC前1周内(T0)和4个周期NAC后(T4)行US检查,测量病灶最大径(D),计算最大径缩小率(ΔD),ΔD=(DT0-DT4)/DT0×100%;以CDFI观察病灶内部及周边血流分布情况,采用Adler半定量法对血流信号进行分级[3],并归为 0~1级和2~3级予以评价。
分别于病灶最大径纵切面行声触诊组织成像(virtual touch tissue imaging, VTI)及声触诊组织定量(virtual touch tissue imaging quantification,VTIQ)检查。VTI弹性评分采用1~3分和4~6分两分法。在VTIQ图像所示病灶内部及周边硬度最高区域勾画感兴趣区(region of interest, ROI),测量剪切波速度(shear wave velocity, SWV),对每个病灶选6个以上取样点进行测量,计算SWV平均值(Vmean)。测量T0与T4时Vmean,计算Vmean缩小率(ΔVmean),ΔVmean=(VmeanT0-VmeanT4)/VmeanT0×100%。
1.3 组织学疗效判定标准 对比NAC前空芯针穿刺组织标本与4个周期NAC后手术标本病理学检查结果,根据Miller & Payne(MP)病理评估系统分为5级[4]:1级,浸润癌细胞无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少;2级,浸润癌细胞轻度减少,但总数量仍高,癌细胞减少<30%;3级,浸润癌细胞减少30%~90%;4级,浸润癌细胞减少>90%,仅残存散在小簇状癌细胞或单个癌细胞;5级,原肿瘤瘤床无浸润癌细胞,但可存在导管原位癌。将MP3~5级患者归入组织学显著反应(major histological response, MHR)组,MP1~2级患者归入组织学非显著反应(non-major histological response, NMHR)组[5]。
1.4 统计学分析 采用SPSS 21.0统计分析软件。计量资料均符合正态分布,以±s表示,组间比较采用t检验;以χ2检验或Fisher确切概率法比较计数资料。采用单项随机效应模型计算组内相关系数(intraclass correlation coefficient, ICC),评估2名医师测量结果的一致性,ICC>0.80一致性较好。采用受试者工作特征(receiver operating characteristic,ROC)曲线观察US、ARFI参数评估NAC疗效的效能。P<0.05为差异有统计学意义。
2 结果
52例中,穿刺病理示11例分子亚型为Luminal A型,17例Luminal B型,13例人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性,11例三阴性乳腺癌(triple-negative breast cancer, TNBC);术后病理示浸润性导管癌48例,浸润性小叶癌2例,浸润性乳头状癌2例。18例患者接受6个周期化疗,34例接受8个周期化疗。
2.1 一般资料 术后病理示30例MP3~5级(MHR组,图1)、22例MP1~2级(NMHR组,图2),组间患者年龄、月经状态、体质量指数,化疗前病灶最大径、穿刺分子亚型、病理分级及腋窝淋巴结转移差异均无统计学意义(P均>0.05),见表1。
2.2 US及ARFI参数的一致性 2名医师对肿瘤病灶最大径、血流分级、弹性评分及Vmean的ICC值分别为0.90、0.93、0.92和0.93。
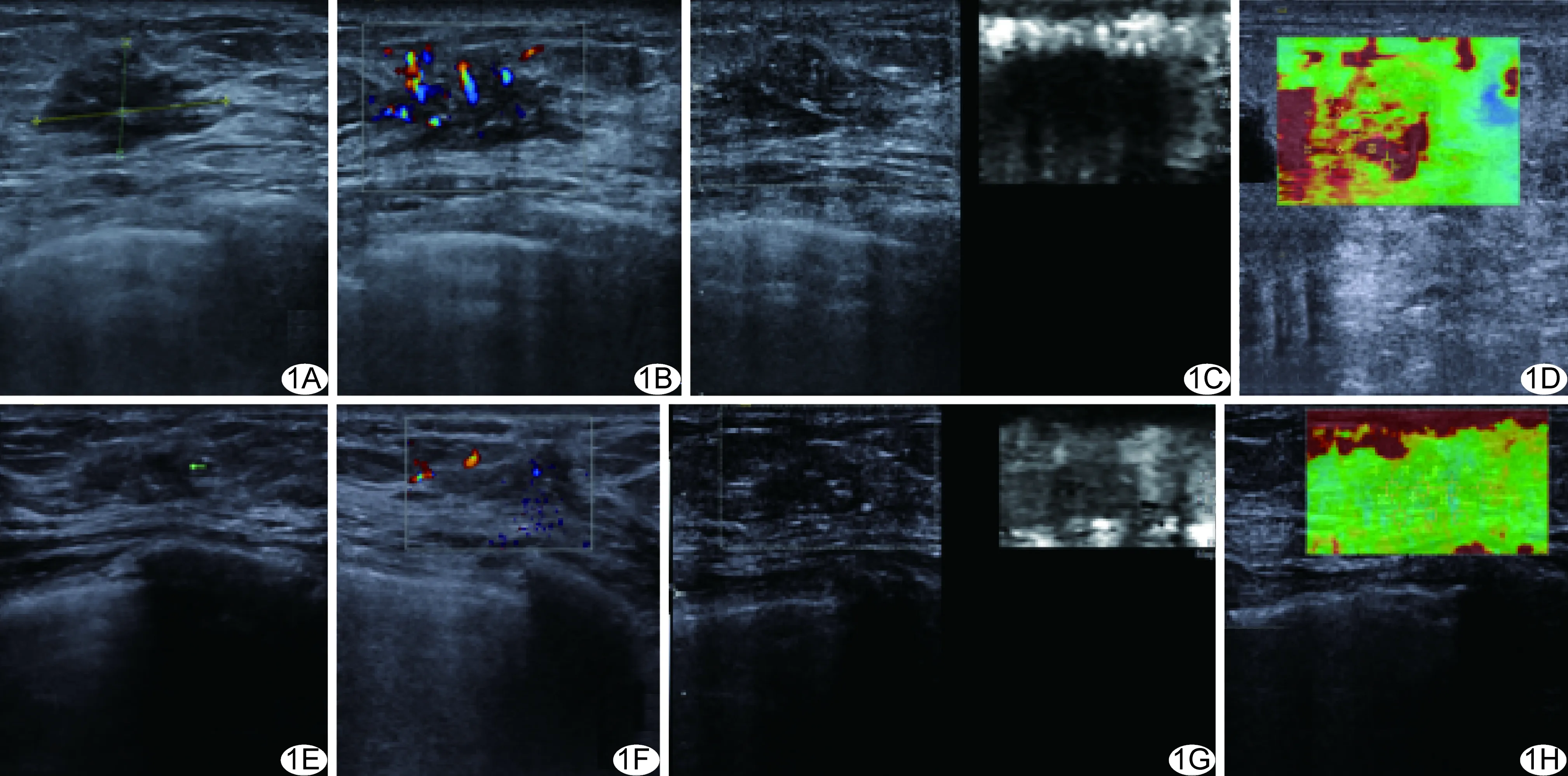
图1 患者女,42岁,乳腺癌(HER-2阳性),术后病理MP5级 A~D.NAC前超声声像图示病灶最大径2.1 cm(A),CDFI示血流分级3级(B),ARFI示弹性评分6分(C),VTIQ示Vmean=4.91 m/s(D); E~H.4个周期NAC后声像图示病灶最大径约0.8 cm(E),CDFI示血流分级1级(F),ARFI示弹性评分2分(G),VTIQ示Vmean=3.15 m/s(H)
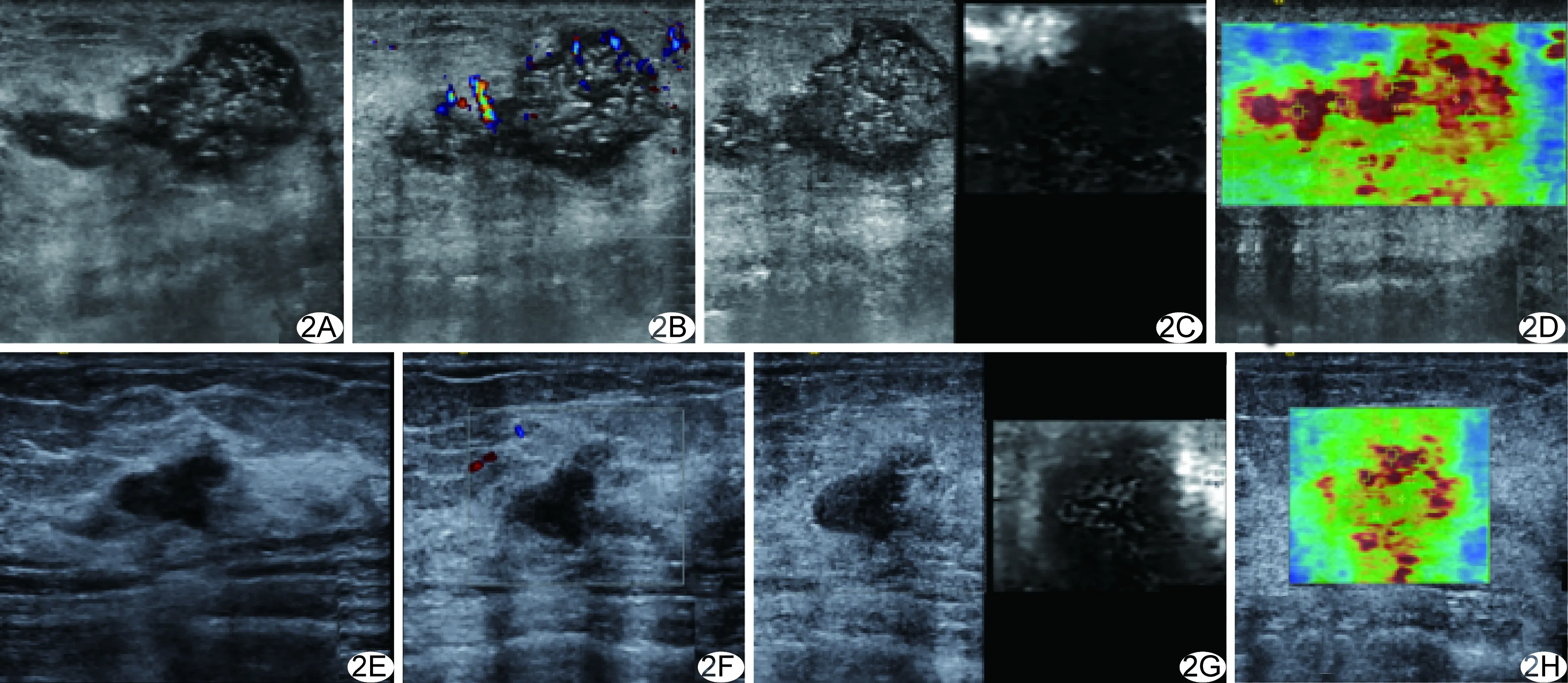
图2 患者女,60岁,乳腺癌(TNBC),术后病理MP2级 A~D.NAC前声像图示病灶最大径3.0 cm(A),CDFI示血流分级3级(B),ARFI示弹性评分6分(C),VTIQ示Vmean=7.23 m/s(D); E~H.4个周期NAC后声像图示病灶最大径约1.2 cm(E),CDFI示血流分级0级(F),ARFI示弹性评分5分(G),VTIQ示V mean=5.92 m/s(H)
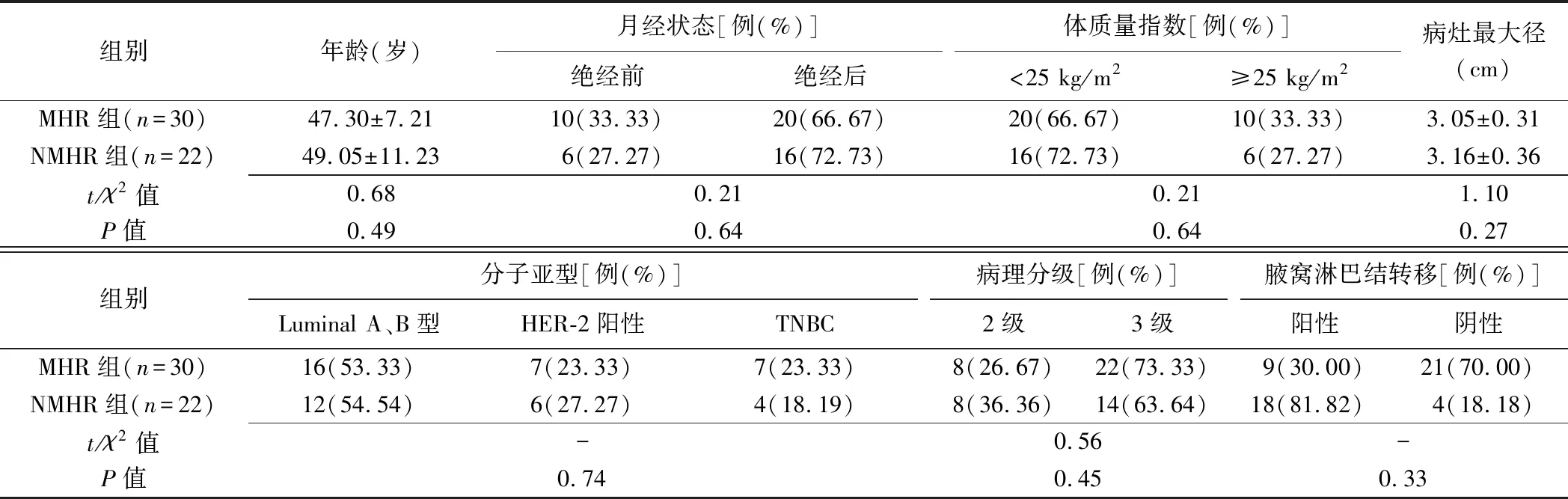
表1 MHR组与NMHR组间患者一般资料及化疗前病灶临床病理特征比较

表2 MHR组与NMHR组间NAC前(T0时)US及ARFI参数比较

表3 MHR组与NMHR组间4个周期NAC后(T4时)US及ARFI参数比较
T0时,组间血流分级、弹性评分及Vmean差异均无统计学意义(P均>0.05),见表2。T4时,与NMHR组相比,MHR组残余病灶ΔD增加,血流分级0~1级比率增加、2~3级比率减少;弹性评分4~6分比率减少、1~3分比率增加,ΔVmean增加(P均<0.01)。见表3。
2.3 US、ARFI参数评估NAC疗效的效能 ROC曲线结果显示,US联合ARFI评估NAC疗效的曲线下面积(area under curve, AUC)为0.95,见表4及图3。
3 讨论
乳腺癌发病率逐年上升,且呈年轻化趋势,严重威胁女性身心健康[6]。NAC可使无法手术切除的局部晚期乳腺癌患者获得手术治疗机会,提高患者保乳率,已广泛用于临床[7]。
US是监测NAC疗效的常用影像学手段,可明确显示病灶位置、形态和治疗前后体积变化,但存在一定局限性[8],如“筛网状”非向心性退缩病灶治疗前后体积及形态无明显变化,其癌细胞消退表现为坏死和纤维化,而US难以鉴别坏死、纤维化病灶与残余癌。CDFI技术可通过观察病灶血流变化而评估疗效,如MHR病灶出现血管萎缩、闭塞,血流信号可从化疗前的2~3级降为化疗后的0~1级,但易受病灶位置及声束与血流方向夹角等因素影响而丢失低速血流信号。本研究根据ΔD和血流分级预测NAC疗效的准确率分别为75.00%和71.15%,与苏琳等[9]结果相近。
ARFI利用声辐射脉冲力使组织产生纵向位移和横向传导的剪切波,可反映组织生物力学特性;利用VTI可实现半定量诊断乳腺病变,VTIQ则可通过定量参数SWV反映病灶硬度而成为US的重要补充[10]。本研究发现NAC后MHR组病灶弹性评分下降比例高于NMHR组,且ΔVmean显著增加;分析可能原因,乳腺癌细胞不断侵袭周围乳腺间质及脂肪组织,导致细胞外基质结缔组织增生及纤维化,使组织硬度增加;肿瘤对化疗产生显著反应时,肿瘤细胞生长、浸润及转移受到抑制,随之细胞外基质减少,其结构和生物力学特征发生改变,导致硬度降低[11]。本研究根据弹性评分和ΔVmean预测NAC疗效的准确率分别为90.38%和88.36%。EVANS等[12]采用剪切波弹性成像技术检测乳腺癌单一ROI硬度,发现NAC反应性与病灶平均硬度呈负相关。本研究针对6个以上ROI的平均值获得病灶Vmean,更加客观地反映病灶硬度。NAC病理反应性为渐进过程,故本研究以结束4个化疗周期作为预测NAC疗效的时间节点,以尽早根据疗效评估结果调整治疗方案。HAYASHI等[13]采用应变力弹性成像技术发现NAC前肿瘤硬度预测其对NAC反应性的价值较好。本研究发现NAC前MHR组与NMHR组病灶最大径、血流分级、弹性评分及SWV差异均无统计学意义,可能与本组乳腺癌病理分子亚型中HER-2阳性和TNBC者占比较低有关。ROC曲线结果显示US联合ARFI多参数指标预测疗效可使准确性上升至92.30%,提示ARFI可作为US的重要补充,二者联合应用可显著提升评估NAC疗效的效能。
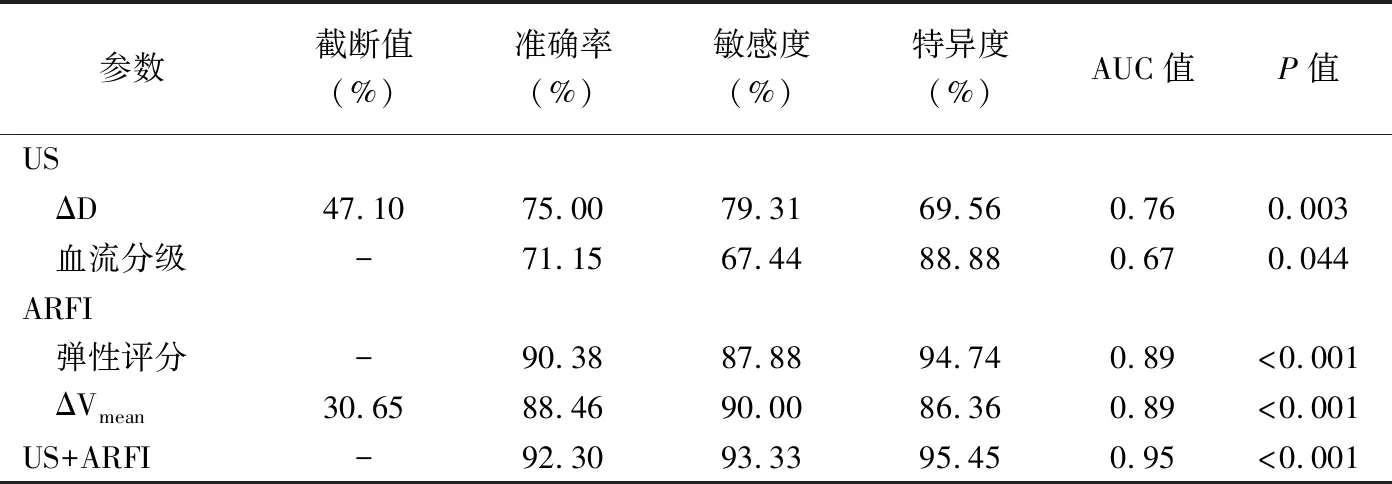
表4 US、ARFI参数对NAC疗效的评估效能
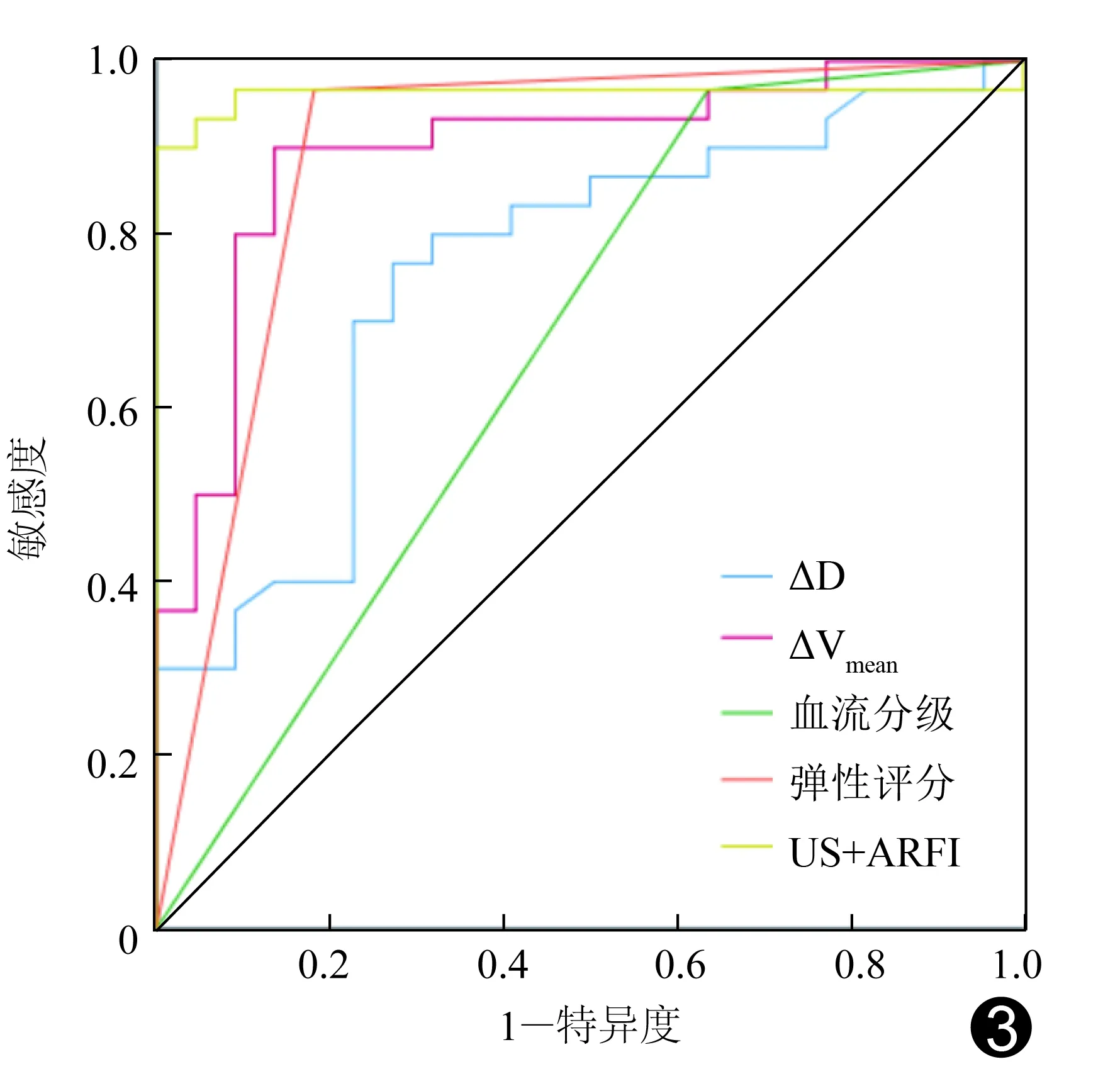
图3 US、ARFI各参数单独及联合评估NAC疗效的ROC曲线
综上,US、ARFI均可预测NAC对于乳腺癌的疗效,二者联合可提高预测效能。本研究的主要局限性:样本量少;且化疗后部分病灶体积小于ROI,测量时可能包含病灶周边正常腺体,影响测值准确性,有待进一步完善。