Ⅰ期结直肠癌转移基因突变特征及临床特征分析
李 娟 白 瑞 潘月龙
结直肠癌是一种常见的恶性肿瘤,在所有恶性肿瘤中发病数居第三位[1-2]。随着结直肠癌筛查的发展,T1/T2 结直肠癌的发现比例提高,但确诊为结直肠癌的患者大约50%~60%发生转移[3],肝脏为最常见的转移器官[4-6]。Yaeger 等[7]在2018 年通过测序平台MSK-IMPACT 341、IMPACT 410、IMPACT 468 对1134 个结直肠癌(CRC)样本(1099 患者)进行了前瞻性靶向测序,确定APC 内含子区域的剪接改变、96%的结直肠癌增加了致癌性WNT 途径改变等。纪念斯隆凯特琳癌症研究中心(MSK)的癌症基因检测分析平台(MSK-IMPACTTM)是一种基于二代测序(NGS panel)的杂交捕获技术,可快速检测与癌症相关的468 个独特基因上的所有蛋白质编码突变、拷贝数变异、启动子突变以及结构重排,不同于常规检测,MSK-IMPACTTM 适用于任何肿瘤类型。本研究借MSKCC 数据发掘Ⅰ期结直肠癌转移的基因突变特征及临床特征,发现较小的肿瘤可能存在较大的转移潜能,影响预后。
1 研究方法
使用cBioPortal 数据库,该数据库是由纪念斯隆凯特琳癌症研究中心(MSK)开发的一款集数据挖掘、数据整合及可视化等多功能于一体的综合性开放网络平台,是经过专业杂志Cancer Discovery 认可的数据分析工具,通过其可视化功能查看结直肠癌及Ⅰ期结直肠癌转移组相应的基因突变内容。
从cBioPortal 数据库下载结直肠癌及Ⅰ期结直肠癌转移组相关的基因突变数据。
使用R 语言3.6.1 中maftools 工具对下载数据进行再分析。
2 结果
2.1 整体CRC-2017-MSK 数据观 从整体数据来看,结肠腺瘤样息肉(Adenomatous Polyposis Coli,APC)基因突变最为明显,为76%,其次是TP53、KRAS,分别为73%、44%,BRAF 突变在这个整体数据中的比例约是11%。既往研究发现,不同的BRAF突变可能与生存率有着明显的关联,其中BRAF V600E 突变与预后较差有关[8]。见图1。
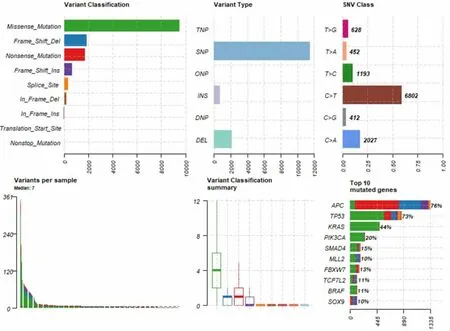
图1 整体CRC-2017-MSK 基因突变数据
2.2 Ⅰ期肿瘤(T1/T2N0)的数据库分析
2.2.1 初始诊断为Ⅰ期结直肠癌患者(包含有转移和无转移)基因测序数据特征。从数据来看,TP53 基因突变最为明显,为68%,其次是APC、KRAS,分别为65%、28%,但在初始诊断为Ⅰ期患者中APC、TP53、KRAS 基因突变比例相对于结直肠癌整体数据而言均偏低(整体数据分别为76%、73%、44%)。见图2。
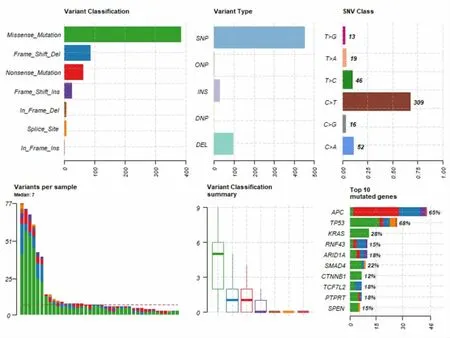
图2 Ⅰ期肿瘤(T1/T2N0)的数据库分析
2.2.2 初始诊断为Ⅰ期结直肠癌患者(包含有转移和无转移)临床数据特征汇总 Ⅰ期发生转移与未发生转移相比,在分子亚型及性别方面均有显著差异,Ⅰ期结直肠癌,女性患者较男性患者更容易发生转移,分子亚型方面Ⅰ期发生转移者均为微卫星稳定型(MSS),微卫星不稳定型(MSI)无一例发生转移。见表1。
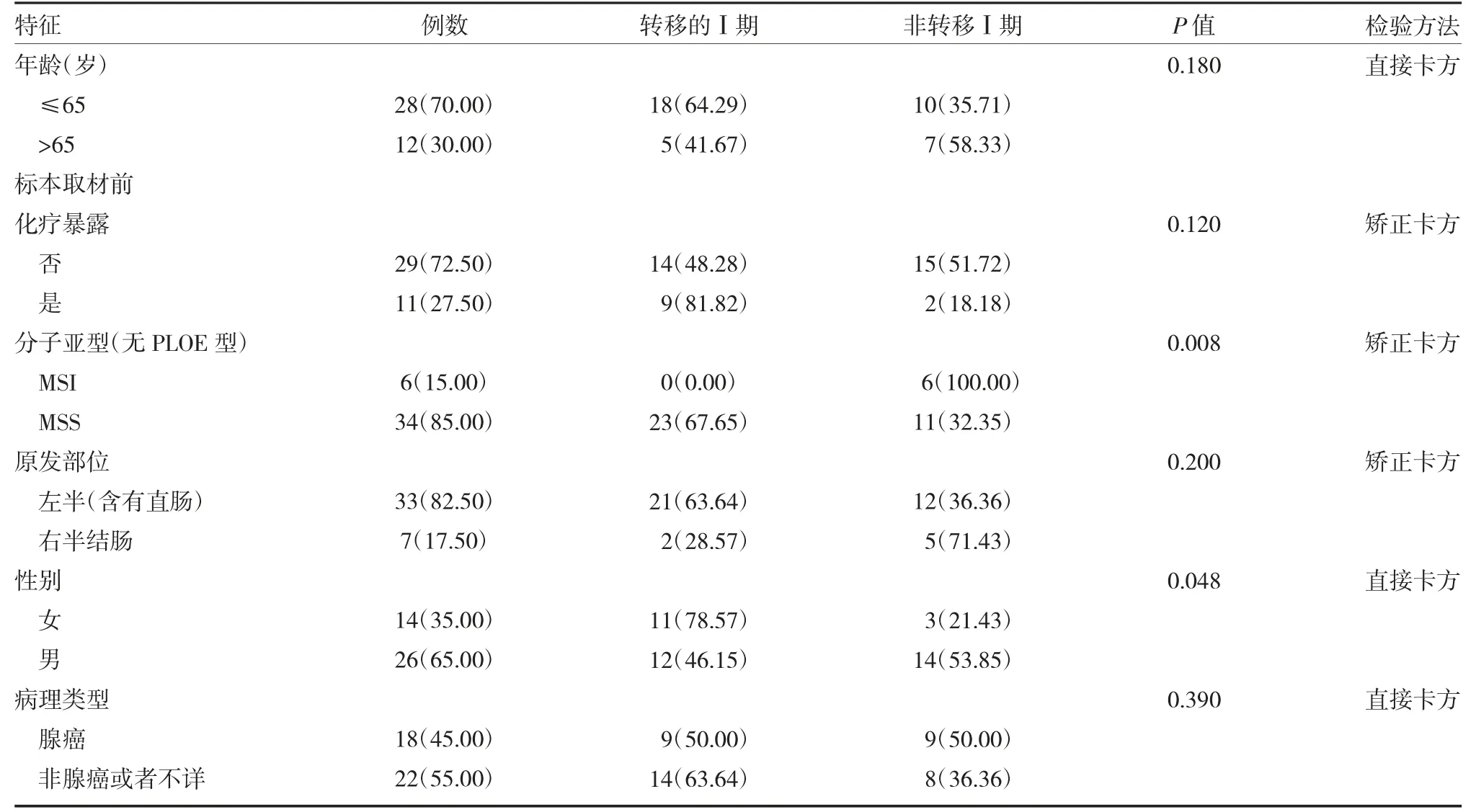
表1 初始诊断为Ⅰ期结直肠癌患者(包含有转移和无转移)临床数据特征汇总[例(%)]
2.2.3 进一步分析23 例Ⅰ期转移患者与17 例非转移患者基因突变特征,我们不难发现Ⅰ期发生转移的患者中TP53 和APC 突变的比例均高于未发生转移的患者。Ⅰ期发生转移患者TP53 突变最明显,占比78%,其次为APC、KRAS 突变,分别占比70%、26%。Ⅰ期未发生转移患者APC 突变最明显,占比59%,其次为TP53、ARID1A 突变,分别占比53%、35%,KRAS 突变占比29%。见图3-4。
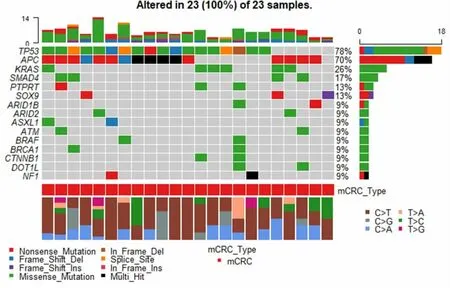
图3 23 例Ⅰ期转移患者基因突变数据分析
3 讨论
经典结直肠癌发生是一个不断积累Wnt、P53、RAS 等信号通路上突变的过程。APC 基因是Wnt/βcatenin 信号通路负向调节的关键因子,APC 失活是结直肠癌发生的早期分子事件。70%~80%的散发性结直肠癌存在APC 缺失或突变,产生截短型APC 蛋白,激活Wnt/β-catenin 信号通路,在细胞迁移、染色体分离和转录调节等方面具有多样性作用。APC 可以通过与DNA 直接相互作用从而抑制DNA 复制来负调控细胞周期[9]。研究还发现,APC 可以通过调节与之相关的长链非编码RNA(Long noncoding RNAs,lncRNAs)的表达,减少外泌体产生,调节细胞增殖、侵袭以及血管生成,从而抑制结直肠癌的发生[10]。
P53 是一种肿瘤抑制基因,50%以上的恶性肿瘤中会出现该基因的突变。TP53 是人类恶性肿瘤中最常见的突变基因,其编码的蛋白是P53 蛋白。既往研究发现,不同大小的肿瘤中TP53 阳性表达率存在明显差异,TP53 的高表达和肿瘤的高侵袭性有关。不同淋巴转移分组TP53 阳性表达率也存在明显差异,TP53 高表达与肿瘤的转移能力关系密切,可作为预测结直肠癌预后的指标。在这部分患者中,对于转移和非转移差异基因突变筛选出来的基因,TP53 突变在转移性结直肠癌中占比更多。
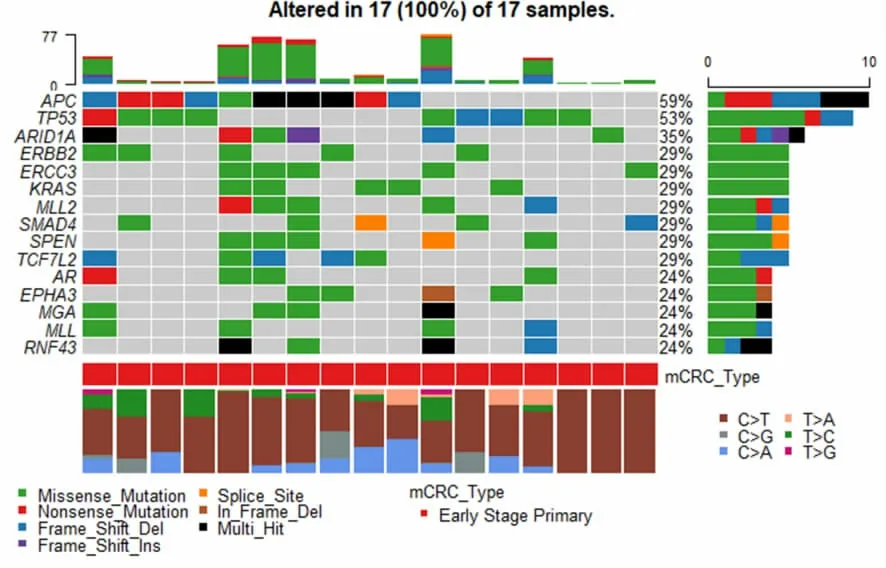
图4 17 例Ⅰ期非转移患者基因突变数据分析
结直肠癌中转移患者TP53 突变比例较高,无转移 的 病 灶 中 ARID1A,FBXW7,PTCH1,AMER1,CTNNB1,FAT1,MLL2,NOTCH3,MLL,PTPRS,ZFHX3均有较高比例突变。ARID1A 是维持KRAS 突变CRC 细胞MEK/ERK 途径的癌症相关下游靶标表达所必需的,因此,在Ⅰ期非转移患者KRAS 突变比例较高的背景下,ARID1A 的丢失对增殖具有抑制作用[11]。ARID1A 丢失在原发性结直肠癌肿瘤中并不少见,并且与结直肠癌患者总生存期更差相关[12]。
Ras 基因家族中与人类肿瘤发生相关的基因有三种,分别是:KRAS、HRAS 和NRAS,其中KRAS 在肿瘤中作用最大。当KRAS 基因表达异常时,则导致细胞内信号传导紊乱,从而使细胞不断生长,细胞无限增殖,最终发生癌变。KRAS 突变是结直肠癌肝转移患者接受肝切除术的预后因素,应在评估肝切除术时考虑[13]。与未突变的患者相比,具有KRAS 突变的mCRC 患者对西妥昔单抗高度耐药[14-15]。KRAS 突变与右侧结肠肿瘤相关,而NRAS 突变与不良预后、左侧原发肿瘤和女性性别相关[16]。与野生型患者相比,NRAS 突变患者的OS 短[17]。NRAS 外显子2、3、4突变也被证明是抗EGFR 治疗的阴性预测因素[18]。
本研究借助现有的MSKCC 数据进行挖掘,突变特征分析,发现了Ⅰ期结肠癌可能存在的突变分子特征,为进一步开展早期肿瘤转移的临床和基础研究,提供了理论依据,为未来的转化医学研究提供了一个方向。

