细胞色素P450 2C19 基因多态性与老年急性脑梗死发生及预后的关系
刘慧纯,王从平,刘群会,李文静,贾 敏
脑卒中是目前严重威胁人类健康和生命的主要疾病之一,主要包括缺血性和出血性脑卒中两种类型;在我国缺血性脑卒中占70%~80%[1-2]。缺血性脑卒中又名脑梗死,多见于老年人群,因具有高发病率、高复发率、高致残率和高死亡率等特点而被重点关注[3]。近年来有研究发现,脑梗死有明显家族聚集倾向;此外,双生子女发病一致和一级亲属发病率增高也提示脑梗死的发生与遗传因素密切相关[4-5]。研究表明,抗血小板治疗可明显降低脑梗死等严重血管事件(如非致命性脑卒中、心肌梗死和血管源性死亡等)发生风险,而在我国以氯吡格雷和阿司匹林抗血小板较为多见[6]。有研究发现,与氯吡格雷单药比较,氯吡格雷、阿司匹林联合治疗在减少急性脑梗死(ACI)病人缺血性事件方面并无明显性优势,且可增加严重出血事件的发生率[7]。但有研究发现,部分病人在口服氯吡格雷治疗或预防脑梗死时存在氯吡格雷抵抗[8]。究其原因发现与细胞色素P450(cytochrome P450,CYP450)酶系统相关,Shuldiner等[9]通过参与氯吡格雷反应的全基因组关联研究发现,CYP2C19基因多态性是氯吡格雷抗血小板聚集变异的主要决定因素,但其与脑梗死发生、疗效及预后的关系尚不十分清楚。为此,本研究选取116例老年ACI病人和100名健康体检者作为研究对象,探讨CYP2C19基因多态性与老年ACI发生及预后的关系。
1 资料与方法
1.1 研究对象 选取2017年1月—2019年1月恩施土家族苗族自治州中心医院收治的116例老年ACI病人作为病例组,纳入标准:①临床表现及各辅助检查符合中华医学会神经病学分会和中华医学会神经病学分会脑血管病学组联合制定的《中国急性缺血性脑卒中诊治指南2014》[10];②首诊,且发病至给药时间<5 h;③年龄>60岁;④病人及家属知情且签署知情同意书。排除标准:①因烟雾病或动脉炎引起的脑梗死;②合并脑肿瘤、脑血管畸形、脑出血或脑外伤者;③近半年存在重大外科手术者;④近期服用过氯吡格雷、华法林等影响血小板功能药物者;⑤临床资料或随访资料不完整者。116例老年ACI病人,其中男66例,女50例;年龄(73.17±8.95)岁;ACI亚型:大动脉粥样硬化型(LAA)50例,小动脉闭塞型(SAO)60例,其他原因型(SUE)6例。选取同期100名健康体检者作为对照组,其中男54名,女46名;年龄(74.22±9.31)岁。两组性别和年龄比较,差异均无统计学意义(P>0.05)。本研究获得恩施土家族苗族自治州中心医院医学伦理委员会批准(批号:2017L014)。
1.2 方法
1.2.1 治疗方法 病例组病人入院后立即给予吸氧、扩血管、营养神经、脑保护等常规治疗,并给予氯吡格雷口服治疗,其首次负荷剂量为300 mg,从第2天起以75 mg/d维持治疗,连续治疗7 d;此外还须针对高血压、糖尿病等基础疾病进行对症治疗。病人在治疗过程中禁止使用质子泵抑制药、阿司匹林、双嘧达莫及溶栓药等。
1.2.2 检测方法 采用多聚合酶链反应-限制性内切酶片段长度多态性(PCR-RFLP)技术检测各组CYP2C19基因多态性,具体为:①标本收集,抽取病例组治疗前和对照组空腹静脉血3 mL于EDTA抗凝管中,并将其保存于-80 ℃冰箱中备用,待标本集齐后一起检测。②外周血基因DNA提取,用基因组DNA抽提试剂盒(购自北京天根生化科技有限公司)提取外周血中基因DNA,并用核酸定量分析仪测定其浓度和吸光度(A260/A280)比值,合格者(比值在1.7~2.0)进行后续实验。③引物设计与聚合酶链式反应(PCR)扩增,参考美国Sequenom公司报道的CYP2C19基因序列(基因型包括G681A和G636A),用Primer Premier 6.0软件设计CYP2C19基因引物,其中G681A位点正向、反向引物分别为5′-ACGTTGGATGGCAATAATTTTCCCACTATC-3′和5′-ACGTTGGATGACTTTCTCCAAAATATCC-3′;G636A位点正向、反向引物分别为5′-ACGTTGGATGAACATCAGGATTGTAAGCAC-3′和5′-ACGTTGGATGGACTGTAAGTGGTTTCTCAG-3′;PCR扩增:反应体系(25 μL)为DNA模板3 μL,其中正向、反向引物各0. 5 μL,Taq酶0. 25 μL,2倍预混合液10 μL和蒸馏水6 μL,反应条件为94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s(共循环35次),72 ℃ 10 min。④电泳,用SmaⅠ和BamH I限制性内切酶酶切扩增产物后进行1.2%琼脂糖凝胶电泳,并在凝胶成像分析仪下观察结果,主要包括快代谢型(GG)、中间代谢型(AG)和慢代谢型(AA)。⑤测序,同时将PCR扩增产物送至上海吉凯生物有限公司进行测序。本实验在专业技术人员指导下完成。
1.3 评定标准 参考相关文献[11]制定氯吡格雷抵抗标准:血小板聚集抑制率<50%为氯吡格雷抵抗,血小板聚集抑制率≥50%为氯吡格雷不抵抗。随访6个月,采用改良Rankin量表(mRS)[12]评价病例组病人神经功能恢复情况,mRS评分≥3分为预后不良,mRS评分≤2分为预后良好。

2 结 果
2.1 Hardy-Weinberg平衡检验 经卡方拟合优度检验发现,病例组和对照组CYP2C19-G681A不同基因型和CYP2C19-G636A不同基因型的分布符合Hardy-Weinberg平衡定律(χ2=3.657,P=0.161;χ2 =2.538,P=0.281)。详见表1。
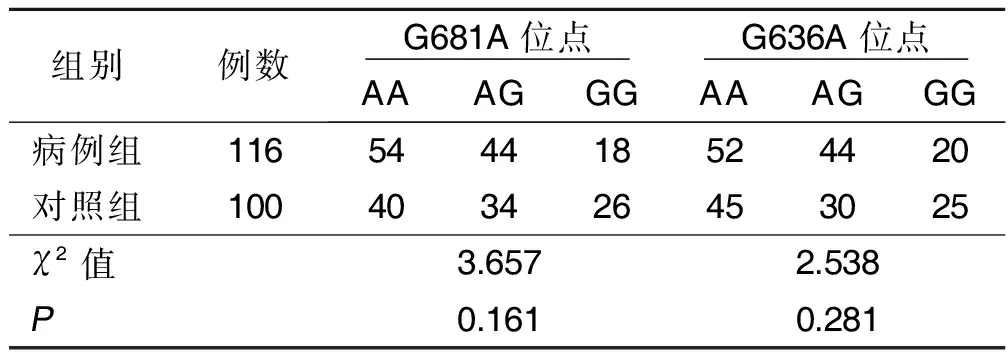
表1 病例组和对照组基因型分布 单位:例
2.2 CYP2C19基因多态性对ACI发生的影响 以ACI发生情况为因变量,将性别、年龄、CYP2C19-G681A和CYP2C19-G636A等位基因纳入非条件Logistic回归分析模型,发现CYP2C19-G681A和CYP2C19-G636A等位基因A均为ACI发病的影响因素(P<0.05)。详见表2。

表2 CYP2C19基因多态性对ACI发生的影响
2.3 ACI不同亚型中CYP2C19-G681A和CYP2C19-G636A不同基因型分布 ACI不同亚型中CYP2C19-G681A和CYP2C19-G636A不同基因型比较,差异均无统计学意义(P>0.05)。详见表3。

表3 ACI不同亚型中CYP2C19-G681A和CYP2C19-G636A不同基因型分布 单位:例
2.4 抵抗组与不抵抗组CYP2C19-G681A和CYP2C19-G636A不同基因型分布 116例ACI病人中30例存在氯吡格雷抵抗(抵抗组),86例不存在氯吡格雷抵抗(不抵抗组)。抵抗组与不抵抗组CYP2C19-G681A不同基因型和CYP2C19-G636A不同基因型比较,差异均有统计学意义(P<0.05)。详见表4。
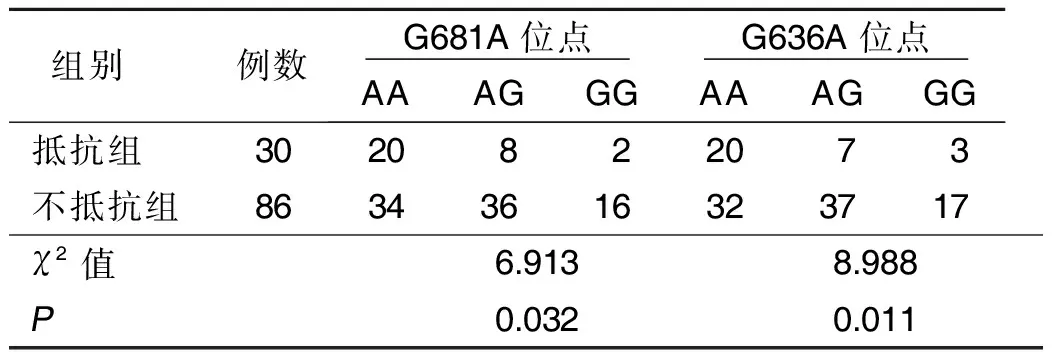
表4 抵抗组与不抵抗组CYP2C19-G681A和CYP2C19-G636A不同基因型分布 单位:例
2.5 CYP2C19基因多态性对ACI预后的影响 随访6个月,116例ACI中预后良好者76例,预后不良者40例。以预后为因变量,将性别、年龄、ACI亚型、CYP2C19-G681A位点基因型、CYP2C19-G636A位点基因型、氯吡格雷抵抗情况纳入非条件Logistic回归分析模型,发现CYP2C19-G681A和CYP2C19-G636A基因AG型均为ACI预后不良的影响因素(P<0.05)。详见表5。

表5 影响ACI预后的非条件Logistic回归分析
3 讨 论
目前从分子遗传学水平解释脑梗死的发病本质和遗传规律,以期为病人提供最佳诊疗方案,是国内外脑血管疾病研究热点[13]。CYP450家族是药物代谢的主要酶系统,其存在遗传多态性现象,由Wedlund等[14]在不同个体中S-美芬妥英代谢研究中首次发现并提出,后续研究指出,若编码CYP450家族DNA序列发生变化可增加或降低,甚至消除酶的表达活性,严重影响其肝脏代谢,而CYP1、CYP2和CYP3家族则是参与人体内外源化合物相关代谢[15]。随着研究不断深入发现,其中CYP2C19基因遗传多态性具有最强种族间变异性[16]。CYP2C19基因位于人类染色体10q24.1-q24.3,有9个外显子和8个内含子,可编码由490个氨基酸构成的酶蛋白,目前已知的突变等位基因有25个,我国以CYP2C19-681 G/A(rs4244285)和CYP2C19-636G/A(rs4986893)最常见,以上两种突变基因型均可造成 CYP2C19酶活性降低或丧失,氯吡格雷代谢功能受抑制,临床表现为氯吡格雷抵抗[17-18]。 近年来,关于CYP2C19基因多态性的研究相对较多,但大多数集中在因CYP2C19基因多态性产生的氯吡格雷抵抗对疾病治疗的影响,尤以脑梗死为主[19]。但关于其与脑梗死发生是否存在关系,对脑梗死预后是否有影响的研究相对较少。
本研究发现,病例组CYP2C19基因G681A位点和G636A位点的AA基因型和AG基因型比例均大于对照组,提示A等位基因可能与ACI发生相关;进一步将性别、年龄等混杂因素及CYP2C19基因G681A位点和G636A位点各等位基因纳入非条件Logistic回归分析得知,CYP2C19-G681A和CYP2C19-G636A等位基因A均可增加ACI发病风险(P<0.05),其OR值分别为 1.647和1.604,提醒临床工作者除传统危险因素外可增加老年病人CYP2C19基因多态性检测,对携带等位基因A病人做好提前干预,最大限度降低脑梗死发生率。ACI临床类型不同,其疗效及预后存在差异,那么CYP2C19基因多态性是否也影响ACI临床分型?为此,本研究对比了ACI病人LAA型、SAO型和SUE型CYP2C19基因G681A位点和G636A位点各基因型分布,发现其差异无统计学意义,说明ACI临床分型与CYP2C19基因多态性无明显关联。本研究还比较了116例ACI病人中氯吡格雷抵抗者和不抵抗者CYP2C19基因G681A位点和G636A位点各基因型分布差异,发现抵抗者基因型以AA和AG为主。此外,本研究非条件Logistic回归分析发现,CYP2C19-G681A和CYP2C19-G636A基因型AG均为ACI预后不良的影响因素(P<0.05),提示临床工作者在ACI诊疗过程中尤其须要重视基因型为AG病人的个体化治疗。
综上所述,CYP2C19基因多态性与老年ACI发生及预后均相关,其中等位基因A和基因型AG分别可增加ACI发病及不良预后的风险。

