非瓣膜性心房颤动患者血液T淋巴细胞亚群及其细胞因子的变化及意义
吴四云,林玲 ,陈金银,黄文乾,张芳,李洁瑕
1昆明医科大学研究生院,云南昆明 650000;2昆明医科大学第一附属医院心血管干疗科,云南昆明 650000
心房颤动(以下简称房颤)的发病率逐年升高,研究发现60岁以上患病比例显著增加,且男性患病率是女性的1.5倍[1]。大多数房颤属于非瓣膜性房颤(NVAF)。NVAF是指在无风湿性二尖瓣病变、没有行机械瓣和生物瓣置换术以及二尖瓣成形术的情况下出现的房颤[2],具有很高的致残率和致死率。目前,NVAF的发病机制复杂且不明确,可能的机制有异位起搏点致电重构、心肌纤维化致心脏结构重塑、自主神经功能失调、炎症反应和氧化应激等。T淋巴细胞亚群作为参与心肌促炎、抗炎反应及心肌纤维化过程的重要物质,其分泌的细胞因子可影响心脏的传导系统,与NVAF密切相关。在现有的研究中也发现白介素(IL)家族、干扰素γ(IFN-γ)及肿瘤坏死因子(TNF)等细胞因子与房颤的发生及心肌纤维化存在密切联系,通过干扰信号通路上调mRNA表达来调节人心房成纤维细胞的表达,从而促进心房肌纤维化和炎症反应[3-7]。但上述机制目前尚无明确定论。本研究通过检测NVAF患者血液中T淋巴细胞亚群及其细胞因子水平,探讨两者在疾病发生、发展及改善预后中的作用,评估两者对诊断NVAF的预测价值,为NVAF的治疗提供新思路。
1 资料与方法
1.1 临床资料 选取2019年11月—2020年12月在昆明医科大学第一附属医院心内一病区就诊的NVAF患者56例为NVAF组。选取同期窦性心律患者49例为对照组。NVAF组纳入标准:心电图、动态心电图检查提示为房颤的患者。排除标准:①瓣膜性房颤患者,即伴有机械人工心脏瓣膜或中重度二尖瓣狭窄的房颤;②有急慢性肝肾功能不全、各种恶性肿瘤、血液系统疾病、严重感染和各种自身免疫性疾病,如结缔组织疾病、系统性红斑狼疮等患者。对照组纳入标准:窦性心律。排除标准:有急慢性肝肾功能不全、各种恶性肿瘤、血液系统疾病、严重感染和各种自身免疫性疾病,如结缔组织疾病、系统性红斑狼疮等患者。NVAF组56例,男37例、女19例,平均年龄(67.48±12.65)岁。对照组49例,男27例、女22例,平均年龄(58.12±14.52)岁。患者签署知情同意书。
1.2 资料收集
1.2.1 基础资料和生化指标 收集两组患者的基础资料,包括性别、年龄、高血压史、糖尿病史、冠心病史。所有患者抽取空腹静脉血液,分别置于枸橼酸钠抗凝管及促凝管,由检验科检测肝肾功能、甲状腺功能、抗核抗体(ANA)16项。
1.2.2 心脏指标 所有患者入院后行心脏彩超检查,收集左心室舒张末期内径(LVEDD)、左心室射血分数(LVEF)、左心房内径(LAD)、右心房内径(RAD)、右心室流出道内径(RVOT)等指标。
1.2.3 T淋巴细胞亚群和细胞因子水平 所有患者次日抽取空腹静脉血液分别置于枸橼酸钠抗凝管及促凝管,使用细胞流式分析仪BD FACSCANT0Ⅱ检测T淋巴细胞亚群水平、12项细胞因子水平,收集CD45+、CD3+/CD45+百分比及绝对值、CD3+CD8+/CD45+、CD3+CD4+/CD45+、Th/Ts、IL-6、IL-1β、IL-8、TNF-α、IFN-γ、IL-12p70、IL-10、IL-4等指标。
1.3 统计学方法 采用SPSS26.0统计软件。针对分类变量选择χ2检验,针对连续数值型变量,先进行正态性检验,服从正态分布选择独立样本t检验,结果用±s表示;如果不服从正态分布,则选择两个独立样本的非参数检验,结果用中位数和四分位数表示。对单因素筛查出来的因素行二元logistic回归分析,根据logistic回归分析结果得出联合预测因子L。采用ROC曲线进行诊断价值评价,以敏感度为纵坐标,1-特异度为横坐标绘制ROC曲线,计算约登指数,选取约登指数为最大值时ROC曲线上的坐标点(1-特异度,敏感度)对应的临界值为最佳截点,根据最佳截点获得对应的敏感度及特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基础资料和生化指标比较 NVAF组年龄高于对照组(P<0.01)。两组性别、高血压病史、糖尿病病史、冠心病病史、甲状腺功能、ANA16项的差异均无统计学意义(P均>0.05)。见表1。
2.2 两组患者心脏彩超结果比较 两组患者心脏彩超中的RVOT差异无统计学意义(P>0.05);NVAF组、对照组的LVEF分别为63.50%(54.00~72.00)、70.00%(65.00~74.00),NVAF组的LVEF低于对照组(P=0.008)。NVAF组的LAD、LVEDD、RAD均高于对照组(P均<0.01),见表2。
表2 两组患者心脏彩超结果比较(mm,±s)
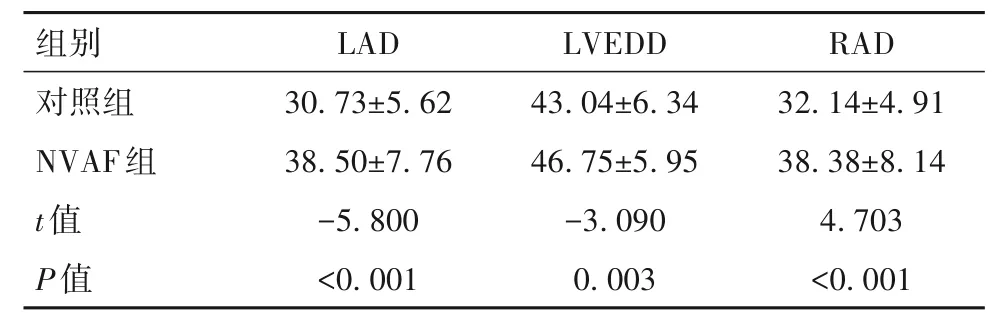
表2 两组患者心脏彩超结果比较(mm,±s)
组别对照组NVAF组t值P值LAD 30.73±5.62 38.50±7.76-5.800<0.001 LVEDD 43.04±6.34 46.75±5.95-3.090 0.003 RAD 32.14±4.91 38.38±8.14 4.703<0.001
2.3 两组患者T淋巴细胞亚群水平比较 两组患者在T淋巴细胞亚群方面的差异均无统计学意义(P均>0.05)。见表3。
表3 两组患者T淋巴细胞亚群水平比较(±s)
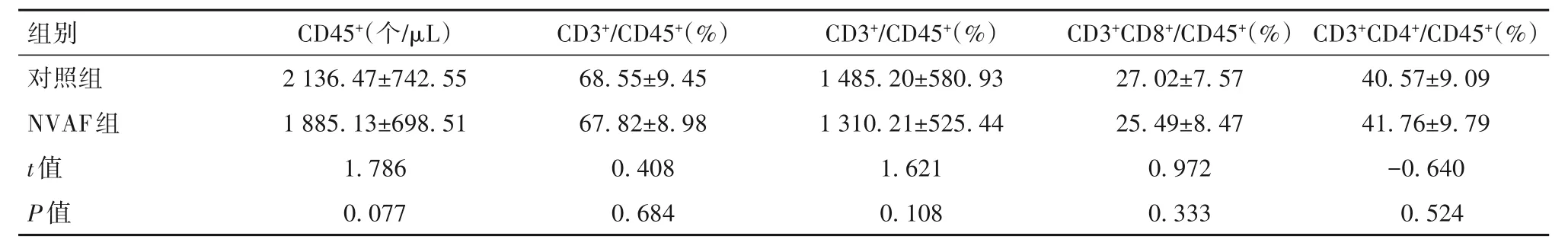
表3 两组患者T淋巴细胞亚群水平比较(±s)
组别对照组NVAF组t值P值CD45+(个/μL)2 136.47±742.55 1 885.13±698.51 1.786 0.077 CD3+/CD45+(%)68.55±9.45 67.82±8.98 0.408 0.684 CD3+/CD45+(%)1 485.20±580.93 1 310.21±525.44 1.621 0.108 CD3+CD8+/CD45+(%)27.02±7.57 25.49±8.47 0.972 0.333 CD3+CD4+/CD45+(%)40.57±9.09 41.76±9.79-0.640 0.524
2.4 两组患者细胞因子水平比较 NVAF组IL-6、IL-1β、IL-8、IL-4水平高于对照组,IFN-γ、IL-12p70水平低于对照组(P均<0.05)。见表4。

表4 两组患者细胞因子水平比较[pg/mL,M(P25~P75)]
2.5 NVAF发生的多因素回归分析 将单因素分析中有统计学意义的因素进一步行logistic回归分析,结果显示,IL-1β、IFN-γ、IL-12p70、IL-4、LAD是NVAF发生的独立影响因素(P均<0.05)。IFN-γ、IL-12p70与NVAF的发生均呈负相关(P均<0.05)。见表5。
2.6 IL-1β、IFN-γ、IL-12p70、IL-4、LAD及联合预测因子L的ROC曲线分析 IFN-γ、IL-12p70、IL-1β、IL-4、LAD的曲线下面积(AUC)分别为0.618、0.618、0.636、0.797、0.797(P均<0.05)。联合预测因子L的AUC为0.959(95%CI为0.927~0.990,P<0.01)。最大约登指数为0.781,联合预测因子值为0.909,敏感度为82.1%,特异度为95.9%。结果见表5、图1。

图1 IL-1β、IFN-γ、IL-12p70、IL-4、LAD及联合预测因子L的ROC曲线
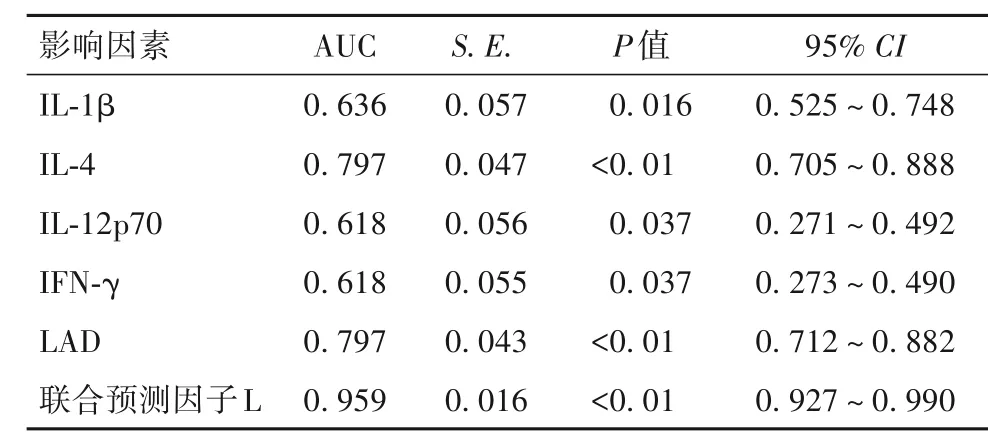
表5 NVNF发生的多因素回归分析
3 讨论
房颤是最常见的心律失常,其患病率在世界范围内呈上升趋势,NVAF占主要方面,其与中风的发生、复发和发病后1年内缺血性中风的病死率显著相关,并且显著高于窦性心律患者[8]。随着社会经济的不断进步和人口老龄化程度的日益加剧,NVAF势必会对社会和公共卫生构成更大的威胁。
NVAF一直是临床工作的研究热点,随着医疗手段的不断更新,除了年龄、性别、家族史、高血压、糖尿病、冠心病、吸烟、血脂代谢异常等一些传统危险因素外[9],免疫激活及炎症反应[10]等一些非传统危险因素已经被证实与NVAF的发生发展有密切关系,其中T淋巴细胞亚群及其细胞因子是近年来的研究热点。T淋巴细胞亚群主要分为辅助性T(Th)细胞、调节性T(Tregs)细胞和抑制性T(Ts)细胞,不同亚群可以分泌不同细胞因子,导致心肌纤维化,进一步影响心脏的传导系统[11]。从分子机制来说,学者们将这一反应过程概括为miR-128-3p-SP1-TGFB1-Smad轴反应[12],由于成纤维细胞的增殖和迁移导致心肌细胞重构,同时TGF-β1通过上调mRNA来调节人心房成纤维细胞的表达,从而促进或抑制房颤的发生[13]。从动物实验模型研究来看,通过对比房颤组与非房颤组动物血清T淋巴细胞亚群及细胞因子水平,结果发现房颤组 TNF-α、IFN-γ、IL-4、IL-6、IL-9、IL-10、IL-17、IL-18、IL-1β 及可溶性 IL-2受体α等炎性细胞因子水平均升高,表明了炎症反应在房颤发生发展中的重要性[14-15]。从临床研究来看,全身性低度炎症是房颤发生的危险因素,影响心房肌纤维化,房颤组患者血清TNF-α、IL-18、可溶性IL-2受体α等指标均升高[16]。既往还有研究发现房颤患者心房脂肪组织中CD45+、CD3+细胞数量均显著升高,且心房炎症程度影响临床预后[17]。对于慢性心力衰竭患者,研究发现其并发房颤的患者Tregs细胞比例明显下降,CD4+细胞明显增多,并据此提出Th17/Treg失衡可能是房颤发生的潜在机制[18]。
在针对发生NVAF患者的临床特征分析研究中发现,年龄是常见危险因素,年龄越大,NVAF患病率越高[19]。本研究发现,NVAF组患者年龄较对照组增大,这与NVAF的发病特点相一致。还有研究表明,NVAF发病率、患病率和生存率均存在明显的性别差异,且近年来女性中的患病率和死亡率显著下降[20]。高血压、糖尿病、冠心病等常见危险因素影响NVAF的预后。结果表明,非瓣膜性房颤患者收缩压≥140 mmHg和糖尿病前期增加了全因死亡和心脑血管死亡的风险[21-22],且NVAF患者的血压变异性与所有不良事件均显著相关[23]。在本研究中,NVAF组与对照组在性别和病史方面无统计学差异,这与以往的研究结果相反。这可能与本研究纳入的病例较少有关,需要进一步扩大样本量进行研究。
心脏结构改变是NVAF发生的影响因素之一,心脏各房室结构变化会影响房室功能,进一步导致NVAF的发生。LAD导致心脏重构,是NVAF发生机发展的独立危险因素[9]。在本研究中,LAD增大是NVAF发生的独立影响因素,与上述研究结果一致。
有关NVAF的发生与T淋巴细胞亚群及其细胞因子的关系,心房炎症反应占重要地位。在Krish⁃nan等[15]的动物实验中发现,引起心房炎症的抗原含有多个T淋巴细胞表位,诱导疾病与CD4 T细胞应答相关。其他研究对房颤患者进行了荧光素激活细胞分选实验,发现与非房颤患者相比,房颤患者的调节性T细胞比例明显降低,细胞毒性T细胞数量明显增加[24]。除了研究NVAF与T淋巴细胞亚群的相关性外,不同细胞因子引起的NVAF病的发病机制也是研究的重点。近年来,已经进行了实验来探索不同生物标记物影响房颤的机制,特别是对于NVAF,血清炎性细胞因子如IL-4、IL-5、IL-6、IL-10、IL-17和IL-22的水平显著增加,表明炎症反应的程度更高[25]。其他研究发现,IL-6、IL-8水平是急性心肌梗死术后发生房颤的独立预测因子[26],在Watt等[27]的研究中也有相似的结论,其研究结果显示房颤组IL-6、TNF-α水平较高。在本研究中,两组患者的各T淋巴细胞亚群水平无统计学差异,但细胞因子IL-6、IL-1β、IL-4水平明显高于对照组,与NVAF呈正相关;而IL-8、IFN-γ、IL-12p70水平较对照组明显降低,结果与先前的研究有相似之处。通过统计分析发现细胞因子 IL-1β、IFN-γ、IL-12p70、IL-4是NVAF发生的独立影响因素,与LAD进行联合预测因子L的分析后,结果提示联合预测因子L对是否发生NVAF具有较高的诊断价值,其敏感度为82.1%,特异度为95.9%,表明不同类型细胞因子分别参与促炎或抗炎过程,从而影响NVAF的发生发展。
综上所述,细胞因子IL-1β、IFN-γ、IL-12p70、IL-4是NVAF的独立影响因素,且联合预测因子L对判断是否患病具有较高的准确性。但本研究样本数据有限,会对结果造成一定影响,还有待进一步扩大样本量并进行优化,进一步探究血液T淋巴细胞亚群及其细胞因子对NVAF发生的预测意义。

