包涵体重组蛋白不同纯化方法的比较
常恒祯,常江,战俊澎,杨馨,郭珣,刘益辛,邹德颖,2,任洪林
1.吉林大学人兽共患病研究教育部重点实验室/动物医学学院/人兽共患病研究所,吉林长春130062;2.辽宁省盘锦检验检测中心,辽宁盘锦124000
目前应用最广泛的重组蛋白表达系统为E.coli原核表达[1],但由于蛋白表达速度过快、不正确折叠或多肽链疏水区域间非特异性相互作用等原因[2],该系统表达的蛋白多以无活性的包涵体形式存在,难以获取可溶性目的蛋白[3]。目前,多通过缩短表达时间及降低IPTG浓度来降低包涵体表达量[4];另有研究在培养基中加入金属离子,或使用麦芽糖结合蛋白(maltose binding protein,MBP)标签等增加可溶性表达[5-6]。但这些方法均未达到理想效果,部分蛋白仍稳定表达于包涵体中,且表达量较低,另外,制备抗体不宜加入MBP标签蛋白,因其可能干扰目标蛋白的正确结构和功能[7],且不保证可溶性蛋白正确折叠[8]。
因此,增加包涵体蛋白的表达量及纯化量显得尤为重要。本研究通过优化包涵体蛋白表达条件及对3种常用包涵体纯化方法(切胶、包涵体复性及Ni-NTA亲和层析纯化)进行比较,获得最佳表达及纯化方法,以期提高包涵体表达量及可溶性蛋白纯化量。
1 材料与方法
1.1 菌株及质粒 感受态E.coli DH5α、E.coli BL21(DE3)、E.coli BL21(DE3)PLysS及E.coli BL21-Codon Plus(DE3)-RIPL购自上海唯地生物技术有限公司;全长IL-1β与全长IL-1Ra重组质粒[9](以下简称IL-1β-1Ra-2重组质粒)、全长IL-1Ra重组质粒由吉林大学人兽共患病细菌室保存。
1.2 主要试剂 IPTG购自北京博奥拓科技有限公司;KCl、NaH2PO4及Na2HPO4购自北京化工厂有限责任公司;EDTA、Tris、Urea购自广州赛囯生物科技有限公司;蛋白预染marker购自北京聚合美生物科技有限公司;BSA标准蛋白购自北京索莱宝科技有限公司;小鼠抗His标签单克隆抗体购自北京义翘神州科技有限公司;PEG 20000购自北京索莱宝科技有限公司;HRP标记的山羊抗小鼠IgG购自美国Immunoway公司。
1.3 溶液配制
1.3.1 包涵体复性纯化试剂 TE缓冲液:20 mmol/L Tris,1mmol/LEDTA,pH 8.5;洗涤缓冲液Ⅰ:20mmol/L Tris、1 mmol/L EDTA,1%TritonX-100,pH 8.5;洗涤缓冲液Ⅱ:20 mmol/L Tris,1 mmol/L EDTA,1%TritonX-100,2 mol/L Urea,pH 8.5;变性缓冲液:20mmol/LTris,10mmol/LEDTA,8mol/LUrea,pH 9.5;复性缓冲液Ⅰ~Ⅳ:2 mmol/L GSH,0.2 mmol/L GSSG,20 mmol/L Tris,等差数列依次加入6、4、2、0 mol/L Urea,pH均为9.5。
1.3.2 Ni-NTA亲和层析纯化试剂 Buffer A:2 mol/L Urea,20 mmol/L Tris,0.3 mol/L NaCl,1%Triton-X100,1 mmol/Lβ-巯基乙醇,pH 8.0;Buffer B~E:100 mmol/L NaH2PO4,10 mmol/L Tris·Cl、8 mol/L Urea(pH分别为:8.0、6.3、5.9、4.5);平衡缓冲液:50 mmol/L NaH2PO4、300 mmol/L NaCl,10 mmol/L imidazole,pH 8.0。
1.4 包涵体蛋白表达条件的优化
1.4.1 感受态菌株 将10μLIL-1β-1Ra-2重组质粒和全长IL-1Ra重组质粒分别转化至感受态E.coli BL21(DE3)、E.coli BL21(DE3)PLysS及E.coli BL21-Codon Plus(DE3)-RIPL中,涂布于含卡那霉素(100μg/mL)的LB固体培养基,于37℃恒温培养箱中培养8 h;挑取单菌落,接种于含卡那霉素(100μg/mL)的LB液体培养基中,于37℃,165 r/min振荡培养至A600约为0.6时,加入IPTG至终浓度为1 mmol/L,继续培养8 h,进行15%SDS-PAGE分析,同时以未诱导菌为对照。
1.4.2 IPTG诱导浓度 将10μL IL-1β-1Ra-2重组质粒和全长IL-1Ra重组质粒分别转化至感受态E.coli BL21-Codon Plus(DE3)-RIPL,涂布于含卡那霉素(100μg/mL)的LB固体培养基,于37℃恒温培养箱中培养8 h;挑取单菌落,接种于含卡那霉素(100μg/mL)的LB液体培养基中,于37℃,165 r/min振荡培养至A600约为0.6时,加入IPTG至终浓度分别为0.1、0.2、0.4、0.6、0.8、1 mmol/L,继续培养8 h,进行15%SDS-PAGE分析。
1.4.3 诱导温度 将10μL IL-1β-1Ra-2重组质粒和全长IL-1Ra重组质粒分别转化至感受态E.coli BL21-Codon Plus(DE3)-RIPL,涂布于含卡那霉素(100μg/mL)的LB固体培养基,于37℃恒温培养箱中培养8 h;挑取单菌落,接种于含卡那霉素(100μg/mL)的LB液体培养基中,于37℃,165 r/min振荡培养至A600约为0.6时,加入IPTG至终浓度为1 mmol/L,分别于16和37℃,165 r/min培养8 h;取2 mL菌液,于4℃,13 460×g离心2 min,收集菌体,超声破碎,分别收集上清和沉淀,进行15%SDS-PAGE分析。
1.5 包涵体蛋白的纯化 采用最佳蛋白表达条件对IL-1β-1Ra-2重组质粒进行诱导表达,当菌液A600达0.8时,收菌,进行蛋白纯化。
1.5.1 切胶纯化 菌体经15%SDS-PAGE分离后,将蛋白胶加入0.25 mol/L KCl溶液至完全浸泡,4℃反应5 min,切下目的条带放入透析袋,加常规电泳液至完全浸泡目的条带,密封,置放有冰水混合物的电泳槽中,于70 V电压下作用2 h;置4℃,0.01 mol/L的PBS中透析6 h;4℃,6 080×g离心30 min,取上清,进行15%SDS-PAGE分析。
1.5.2 包涵体复性纯化 用0.01 mol/L的PBS将菌体沉淀洗涤3次,按菌体湿重与TE缓冲液1∶80(质量 ∶体积)的比例加入TE缓冲液,充分混匀,超声破碎,收集包涵体沉淀。将包涵体湿重与洗涤缓冲液Ⅰ按1∶50(质量 ∶体积)的比例加入洗涤缓冲液Ⅰ,于室温,200 r/min搅拌洗涤2 h;4℃,6 080×g离心40 min,收集包涵体沉淀(重复该步骤1次);相同条件下采用洗涤缓冲液Ⅱ洗涤包涵体1次,溶解于变性缓冲液中,于室温下120 r/min搅拌过夜;25℃,6 080×g离心30 min,收集上清,即变性包涵体。将变性包涵体装入透析袋中,依次浸入复性缓冲液Ⅰ、Ⅱ、Ⅲ、Ⅳ中进行复性(变性液与复性缓冲液的体积比为1∶100),于4℃层析柜中缓慢搅拌,每次透析6~12 h;再置0.01 mol/L的PBS缓冲液(pH 7.4)中透析6 h;4℃,6 080×g离心30 min,取上清。取各步骤样品进行15%SDS-PAGE分析。
1.5.3 Ni-NTA亲和层析纯化 收集沉淀,按每克菌体湿重加入80 mL Buffer A重悬,超声破碎,收集包涵体沉淀;用30 mLBuffer A洗涤2次,6 080×g离心30 min;收集包涵体沉淀,按每克湿重加入50 mL Buffer B,室温涡旋溶解2 h(或缓慢搅拌过夜)至溶液为半透明;25℃,6 080×g离心30 min,取上清液。将镍柱用5~10倍柱体积的平衡缓冲液平衡柱体,待流穿后,加入4倍柱体积的上清液,于室温,200 r/min混合1~2 h;流穿后分别用4倍柱体积Buffer C洗涤2次、0.5倍柱体积Buffer D洗脱4次、0.5倍柱体积Buffer E洗脱4次;收集洗脱液,于含6~0 mol/L Urea的Tris缓冲液中透析6~12 h,再置0.01 mol/L的PBS中透析6 h;4℃,6 080×g离心30 min,取上清。取各步骤样品进行15%SDS-PAGE分析。
1.6 纯化方法的验证 采用最佳蛋白表达条件对IL-1β-1Ra-2重组质粒和全长IL-1Ra重组质粒进行诱导表达,当菌液A600达0.8时,收菌,采用最佳纯化方法进行纯化。通过Bradford法测定蛋白浓度,计算蛋白量。纯化产物经15%SDS-PAGE分离蛋白后,转移至PVDF膜,用5%脱脂奶于4℃封闭12 h;加入小鼠抗His标签单克隆抗体(1∶2 000稀释),于37℃孵育1 h;用PBST洗涤3次,加入HRP标记的山羊抗小鼠IgG(1∶4 000稀释),用PBST洗涤4次,ECL法显色。
2 结果
2.1 最佳蛋白表达条件
2.1.1 感受态菌株 IL-1β-1Ra-2重组质粒转化感受态E.coli BL21-Codon Plus(DE3)-RIPL后可见相对分子质量约10 560的目的蛋白条带,大小与预期相符,转化其他两种感受态菌株后均未见该目的蛋白条带;全长IL-1Ra重组质粒转化3种感受态菌株后可见相对分子质量约19 770的目的蛋白条带,大小与预期相符。见图1(全长IL-1Ra重组质粒以感受态E.coli BL21-Codon Plu(sDE3)-RIPL为例,其他略)。因此确定采用感受态E.coli BL21-Codon Plus(DE3)-RIPL进行后续试验。

图1 转化感受态菌株的优化Fig.1 Optimization of competent strains
2.1.2 IPTG终浓度 经不同IPTG终浓度诱导的IL-1β-1Ra-2重组蛋白及IL-1Ra重组蛋白产物均可见相对分子质量约10 560和19 770的目的蛋白条带,大小与预期相符。当IPTG终浓度为1 mmol/L时,IL-1β-1Ra-2重组蛋白表达量最高;IPTG终浓度为0.4 mmol/L时,IL-1Ra重组蛋白的表达量最高。见图2。因此,确定IL-1β-1Ra-2重组质粒及全长IL-1Ra重组质粒最佳IPTG终浓度分别为1和0.4 mmol/L。

图2 IPTG终浓度的优化Fig.2 Optimal of final concentration of IPTG
2.1.3 诱导温度 IL-1β-1Ra-2重组质粒于16℃诱导时,未表达;37℃诱导时,可见相对分子质量约10 560的目的蛋白条带,大小与预期相符,于包涵体中表达;全长IL-1Ra重组质粒于16及37℃诱导时,均可见相对分子质量约19 770的目的蛋白条带,大小与预期相符,可稳定表达于包涵体中,37℃的表达量更高。见图3。因此确定IL-1β-1Ra-2重组质粒及全长IL-1Ra重组质粒最佳诱导时间均为37℃。
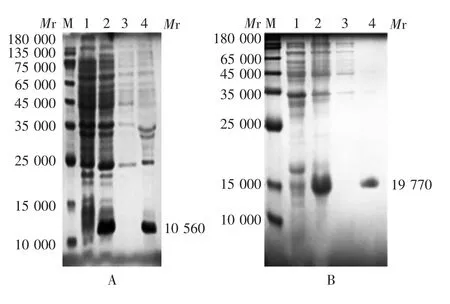
图3 诱导温度的优化Fig.3 Optimization of temperature for induction
2.2 包涵体的纯化
2.2.1 切胶纯化 切胶纯化浓度极低,浓缩后才可见相对分子质量约10 560的目的蛋白条带,大小与预期相符,纯化回收量约为5.1 mg。由于蛋白回收量过少,条带颜色较浅,见图4。因此,切胶纯化法不适用于大批量生产。
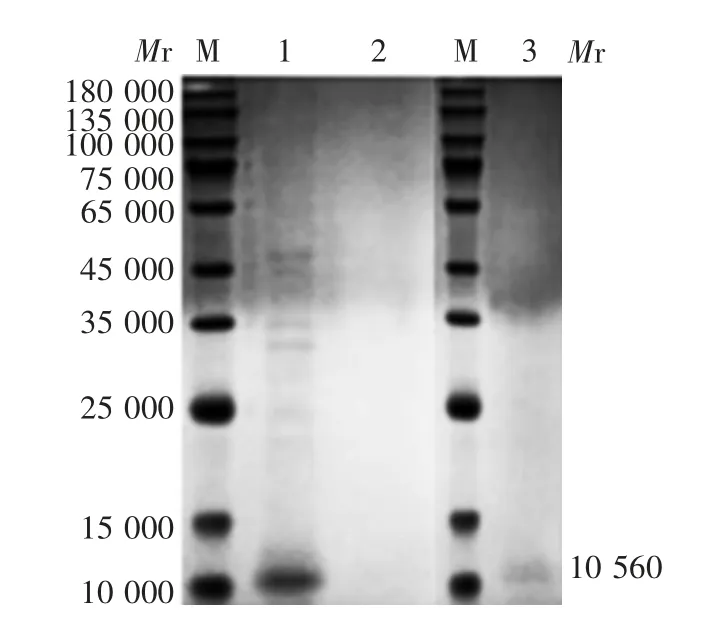
图4 切胶纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of purified product by gel cutting
2.2.2 包涵体复性纯化 包涵体变性、复性及纯化产物中均可见相对分子质量约为10 560的目的蛋白条带,大小与预期相符,见图5。表明洗涤过程中未过多消耗目的蛋白,且能去除90%以上的杂带。目的蛋白于变性缓冲液中溶解率可达85%以上,纯化后蛋白纯化回收量约为46 mg。
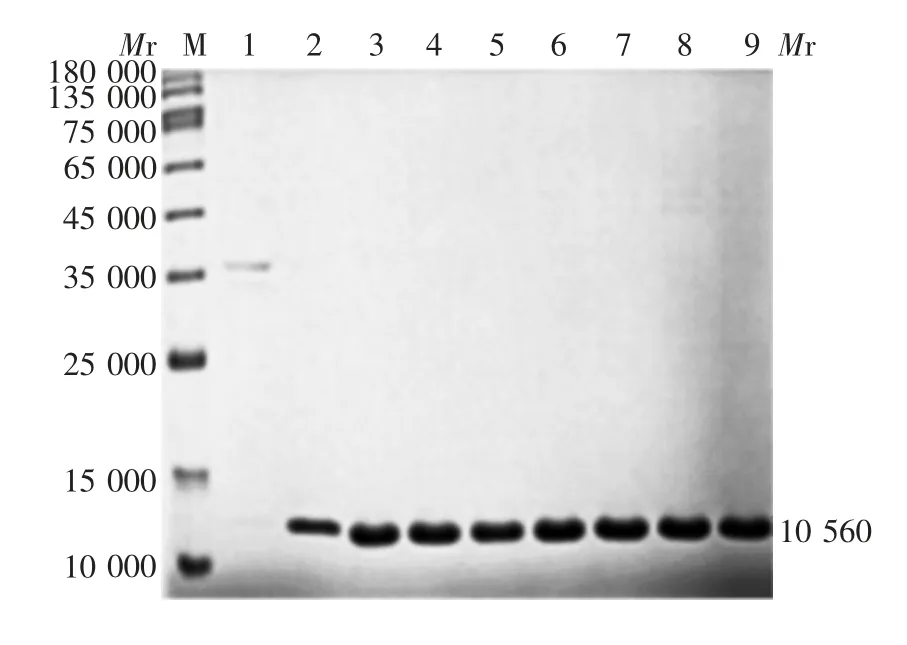
图5 包涵体复性纯化产物的SDS-PAGE分析Fig.5 SDS-PAGE profile of renaturalized and purified products
2.2.3 Ni-NTA亲和层析纯化 包涵体溶解后可见相对分子质量约为10 560的目的蛋白条带,大小与预期相符;流穿后洗脱,目的蛋白回收量较低,约为1.2 mg。见图6。

图6 Ni-NTA亲和层析纯化产物的SDS-PAGE分析Fig.6 SDS-PAGE profile of purified product by Ni-NTA affinity chromatography
综上所述,包涵体复性纯化蛋白回收量最高,因此选择包涵体复性纯化作为最佳纯化方法。
2.3 纯化方法的验证 IL-1β-1Ra-2重组蛋白及全长IL-1Ra重组蛋白包涵体复性纯化产物于相对分质量约10 560和19 770可见目的蛋白条带,且几乎无杂带,纯度可达90%以上,可溶性蛋白回收量分别约为46及63 mg,见图7;且均可与鼠抗His标签单克隆抗体发生特异性结合,且于相对分子质量约10 560和19 770处可见特异性结合条带,见图8。图中未诱导组出现较弱条带,是目的蛋白在未诱导条件下的本底表达。

图7 最佳方法纯化产物的SDS-PSGE分析Fig.7 SDS-PAGE profile of purified product by optimal method
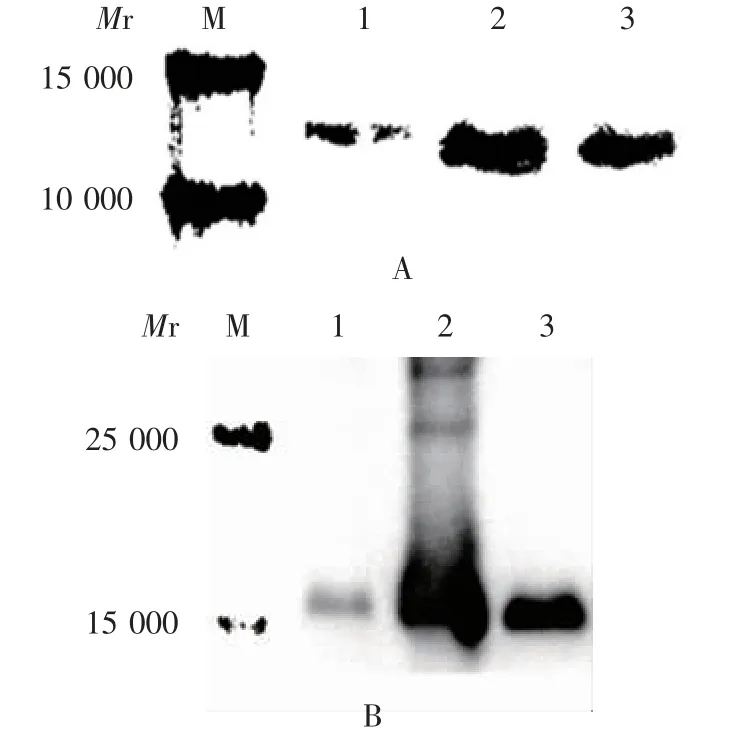
图8 最佳方法纯化产物的Western blot检测Fig.8 Western blotting of purified product by optimal method
3 讨论
感受态E.coli BL21(DE3)pLysS相较于E.coli BL21(DE3)具有降低目的基因背景表达水平的特点,但对IPTG诱导表达无明显影响。感受态E.coliBL21-Codon Plus(DE3)-RIPL与E.coli BL21(DE3)pLysS及E.coli BL21(DE3)比较,具有减少重组蛋白的降解、提高外源基因在原核系统中表达水平等特点,更利于非高表达重组蛋白的诱导表达。本实验结果表明,感受态E.coli BL21-Codon Plus(DE3)-RIPL可改善相对分子质量约10 000的重组蛋白难以在E.coli中稳定表达,需融合表达至大型蛋白(如MBP和GST)后才可稳定表达[10]的问题,并可获得更高产量[11]。
本研究对3种常用包涵体纯化方法进行了比较。在切胶纯化方法中,根据目的蛋白大小及其表达量,选择可游离出目的蛋白的最适电压和反应时间,但蛋白可溶性回收量较低,若以变、复性增加回收目的蛋白的可溶性,则失去其高效、成本低等特点。有文献表明,KCl染色切胶纯化法不适用于纯化低表达量蛋白[12],与本实验结果一致。本实验Ni-NTA亲和层析纯化中,蛋白纯化采用变性后过镍柱再复性的方法,但洗脱后回收量较低,与王晓娟[13]的实验结果一致。这可能与溶解缓冲液pH及溶解效果欠佳等有关,也可能与蛋白表达量较低、相对分子质量较小有关。Ni-NTA亲和层析纯化法中的Buffer B与包涵体复性纯化法中的变性缓冲液同用于包涵体的溶解,通过两者对比发现,不易与重金属离子发生沉淀的TE缓冲液溶解效果明显优于磷酸盐缓冲液。在包涵体纯化过程中,有些蛋白的活性状态需要有金属离子,而有些蛋白含有半胱氨酸(如IL-1β-1Ra-2重组蛋白),应添加EDTA,减少金属离子,以保证游离巯基活性[14],从而减少沉淀的发生。包涵体复性纯化中,通过前期多次大量纯化,发现蛋白纯度的高低主要取决于洗涤缓冲液Ⅰ和洗涤缓冲液Ⅱ各自洗涤的时间和次数,对于高表达量的蛋白应适当增加洗涤次数。不稳定的蛋白质可加入适量甘油,增加复性时的重折叠率[15]。另外,正确的半胱氨酸残基自发结合需要弱氧化条件,但非正确状态下则需要更强的氧化条件(如比率为10∶1的GSH∶GSSG)来达到最佳的天然构象[16]。本实验通过包涵体复性纯化法复性后,蛋白重折叠效果良好,无过多沉淀析出。
综上所述,在相同表达条件下,包涵体复性纯化法优于Ni-NTA亲和层析和切胶纯化法,更易获得高纯度和高回收量的可溶性蛋白,适用于相对分子质量约10 000的非高表达包涵体蛋白的纯化。

