海拔对2型糖尿病患者外周血单个核细胞迁移及黏附功能的影响
哈小琴,高彩艳,李萍,陆润兰,李兵,宋月娟,邢媛,朱晓红,宋薇,买志福
1.联勤保障部队第九四〇医院检验科甘肃省干细胞与基因药物重点实验室,甘肃兰州730050;2.兰州市中医医院,甘肃 兰州730050
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以血糖升高为主要表现的慢性代谢性疾病,易发生多种血管并发症,其病理机制多涉及持续炎症和免疫系统失活[1]。而外周血中淋巴细胞和单核细胞一并统称的外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),在炎症反应、免疫系统监测等事件中起重要作用。PBMCs提取技术成熟,使得以PBMCs为载体进行糖尿病相关机制的研究成为热点。有研究显示,T2DM患者PBMCs与健康者在数量[2]、代谢[3]、基因表达[4]以及炎症介质[5]等方面均存在差异。此外,血管内其他趋化因子、细胞因子、生长因子的分泌失衡,也影响PBMCs的增殖、分化、迁移和黏附等,其功能的改变已成为T2DM血管并发症的有效生物标志物[6]。且PBMCs的移植治疗对于T2DM的控制具有明显优势[7]。但目前关于高海拔缺氧环境下T2DM患者体内PBMCs功能变化的相关报道较少,因此,本文就海拔对T2DM患者PBMCs迁移及黏附功能的影响进行研究,以期为高海拔缺氧环境下T2DM患者的管理提供参考。
1 材料与方法
1.1 样本 选取咸阳市(海拔386 m)某三甲医院内分泌科T2DM患者25人,体检中心健康者20人,作为研究的低海拔组;选取兰州市中医医院(海拔1 520 m)内分泌科T2DM患者29人,体检中心健康者20人,作为研究的高海拔组。收集所有研究对象一般资料,并采集静脉血5 mL进行相应实验指标检测。
1.2 主要试剂及仪器 ELISA试剂盒由美国R&D公司提供;兔抗人CXCR2和CXCR4单克隆抗体、兔抗人β-actin单克隆抗体及HRP标记的山羊抗兔IgG购自美国Abcam公司;RNAiso Plus试剂盒、PrimescriptTMRTMaster Mix和SYBRPermix EX TaqTMⅡreal-time PCR试剂盒购自日本TaKaRa公司;紫外分光光度计购自上海天美科学仪器股份有限公司。
1.3 PBM C s提取 采用密度梯度离心法。取5 mL肝素抗凝全血,按照1∶1比例加入磷酸缓冲盐酸溶液(phosphate buffer saline,PBS)稀释;在新的离心管中吸取与稀释全血等体积的淋巴细胞分离液,用毛细吸管将稀释全血沿管壁缓慢加至新离心管中,保持与分离液形成一界面(两者不混合);室温,2 616×g离心30 min,上层为血浆、血小板及PBS,中层为透明的淋巴细胞分离液,底层为红细胞,PBMCs即为淋巴细胞分离液与上层交界处呈云雾状的灰白色层;吸出PBMCs,加入5倍体积的PBS溶液,洗涤2次,离心后弃上清,备用。
1.4 PBM C s迁移、黏附及成血管相关因子浓度检测采用ELISA试剂盒检测血清中基质细胞衍生因子(stromal cell derived factor-1,SDF-l)、白细胞介素-8(interleukin-8,IL-8)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和缺氧诱导因子(hypoxia-inducible factor-1α,HIF-1α)的浓度,具体操作按试剂盒说明书进行。
1.5 PBM C s迁移、黏附及成血管相关基因相对表达量的检测 采用实时荧光定量PCR法。将PBMCs用PBS溶液洗涤2次,用RNAiso Plus试剂盒提取总RNA,紫外分光光度计测定260、280、320 nm波长处A值,计算RNA含量。用PrimescriptTMRT Master Mix反转录cDNA,以其为模板,利用SYBR Permix EX TaqTMⅡreal-time PCR试剂盒扩增SDF-1的受体趋化因子受体2[chemokine(C-X-C motif)receptor 2,CXCR2]、IL-8的受体趋化因子受体4(CXCR4)、白细胞功能相关抗原1(leukoctes function associatedantigent-1,LFA-1)、β-actin基因。引物序列见表1,引物由宝生物工程(大连)有限公司合成。反应条件:90℃预变性30 s,1个循环;95℃5 s,60℃31 s,PCR反应,40个循环;95℃15 s,60℃60 s,产物溶解,1个循环。以健康组数据为对照,计算各组2-ΔΔCt值(-ΔΔCt=ΔCt试验组-ΔCt对照组)。
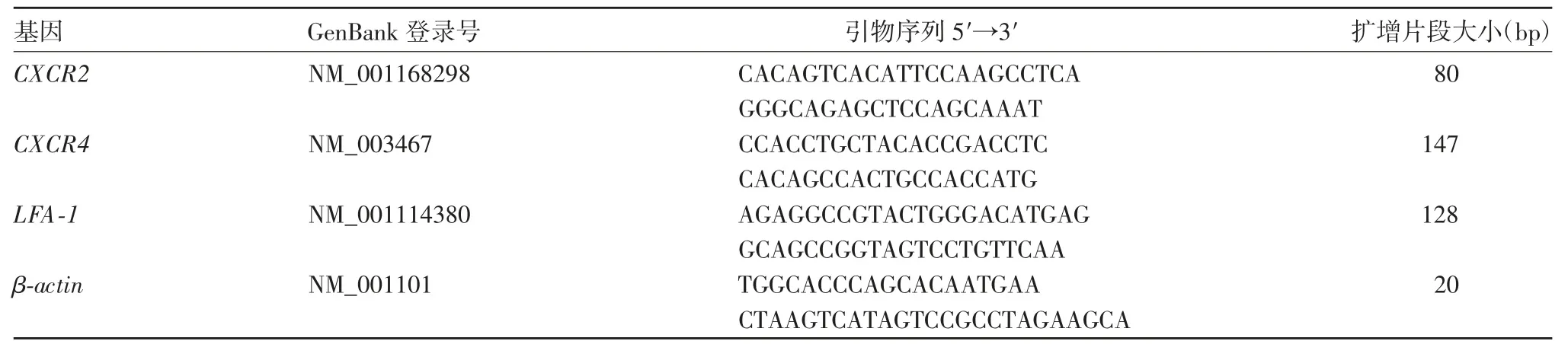
表1 各基因引物序列Tab.1 Sequences of primers for various genes
1.6 PBM C s迁移、黏附及成血管相关蛋白表达水平检测 采用Western blot法。取PBMCs加入RIPA裂解液,4℃冰上裂解30 min;将细胞碎片和裂解液吹打混匀,4℃,17 105.6×g离心15 min;取上清液,经10%SDS-PAGE分离后,电转移至PVDF膜,5%脱脂奶粉封闭;加入兔抗人单克隆抗体CXCR2和CXCR4及抗β-actin单克隆抗体(均1∶400稀释),4℃孵育过夜;TBST洗涤,移至1 mL HRP标记的山羊抗兔IgG(1∶10 000稀释)孵育袋内,37℃孵育2 h;TBST洗涤,滴加ECL超敏化学发光液(A、B液等体积配比),放置1~3 min;ChemiDoc化学发光成像系统进行处理分析。
1.7 统计学分析 采用SPSS 19.0软件进行数据的录入和分析,计数资料用绝对数或百分比表示,计量资料用均值±标准差(±s)表示,两组间比较采用t检验,多组间比较采用ANOVA方差分析。以P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 研究对象基本情况 两地共纳入94例研究对象,其中T2DM患者共计54例,健康者共计40例。男女比例1∶1(47/47),均为汉族人群,平均年龄(53.36±8.94)岁。
2.2 不同海拔下T2DM患者与健康者血清SD F-1、I L-8、H I F-1α、V EGF浓度 ELISA结果显示,低海拔组中,健康者血清中各因子的表达高于T2DM患者,但差异无统计学意义(P>0.05);高海拔组中,除IL-8浓度差异无统计学意义外(t=-1.98,P>0.05),健康者血清中其他各因子的表达高于T2DM患者,浓度差异均有统计学意义(P<0.05)。见表2。
表2 不同海拔组内T2DM患者与健康者血清中各因子浓度的比较(±s)Tab.2 Cytokine concentrations in sera of patients with T2DM and healthy peoples in high and low altitude groups(±s)

表2 不同海拔组内T2DM患者与健康者血清中各因子浓度的比较(±s)Tab.2 Cytokine concentrations in sera of patients with T2DM and healthy peoples in high and low altitude groups(±s)
组别 例数 SDF-1(ng/mL) IL-8(ng/L) HIF-1α(ng/mL) VEGF(ng/L)低海拔组T2DM患者 25 1.24±0.68 5.57±0.51 1.28±0.54 7.16±0.63健康者 20 1.36±0.69 5.66±0.65 1.28±0.65 7.24±0.79 t-0.560 -0.430 -0.001 -0.330 P 0.579 0.669 0.999 0.747高海拔组T2DM患者 29 2.62±0.82 1.38±0.85 7.09±0.82 5.47±0.83健康者 20 3.20±0.63 1.84±0.68 7.60±0.60 5.96±0.58 t-2.620 -1.980 -2.330 -2.270 P 0.014 0.058 0.028 0.032
2.3 PBM C s中LFA-1、CXCR2和CXCR4基因的相对表达量 实时荧光定量PCR结果显示,低海拔组和高海拔组LFA-1、CXCR2和CXCR4基因相对表达量差异均无统计学意义(P>0.05)。低海拔组T2DM患者较健康者CXCR2基因相对表达量降低,差异有统计学意义(t=-4.036,P<0.001),LFA-1和CXCR4基因相对表达量也降低,但差异无统计学意义(P>0.05);高海拔组T2DM患者较健康者各基因相对表达量均降低,但除LFA-1基因相对表达量差异无统计学意义(P>0.05)外,其他两个基因相对表达量差异均有统计学意义(P<0.001)。见表3。
表3 不同海拔组T2DM患者与健康者PBMCs各基因转录水平的比较(±s)Tab.3 Transcription levels of various genes in PBMCsof patients with T2DMand healthy peoples in high and low altitude groups(±s)

表3 不同海拔组T2DM患者与健康者PBMCs各基因转录水平的比较(±s)Tab.3 Transcription levels of various genes in PBMCsof patients with T2DMand healthy peoples in high and low altitude groups(±s)
组别 例数 LFA-1 CXCR2 CXCR4低海拔组T2DM患者 25 1.06±0.75 0.48±0.05 0.92±0.10健康者 20 1.13±0.60 1.40±0.85 1.10±0.11 t-0.186 -4.036 -0.071 P>0.050 <0.001 >0.050高海拔组T2DM患者 29 0.94±0.06 0.71±0.05 0.41±0.04健康者 20 1.04±0.07 1.12±0.02 1.43±0.40 t-0.083 -2.315 -7.468 P>0.050 <0.001 <0.001
2.4 PBM C s中C X C R2和C X C R4蛋白表达水平Western blot分析显示,低海拔组健康者CXCR2和CXCR4蛋白表达水平最高,而高海拔组T2DM患者CXCR2和CXCR4蛋白表达水平最低,低海拔组较高海拔组CXCR2和CXCR4蛋白表达水平升高(tCXCR2=-4.769,tCXCR4=-6.093,P<0.05)。高海拔组和低海拔组健康者CXCR2和CXCR4蛋白表达水平均高于T2DM患者,差异有统计学意义(tCXCR2=-3.045,tCXCR4=-1.087,P<0.05)。见图1和图2。
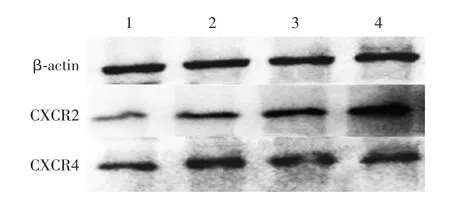
图1 PBMCs表面各相关蛋白表达的Western blot分析Fig.1 Western blotting of expression of relevant proteins on surface of PBMCs
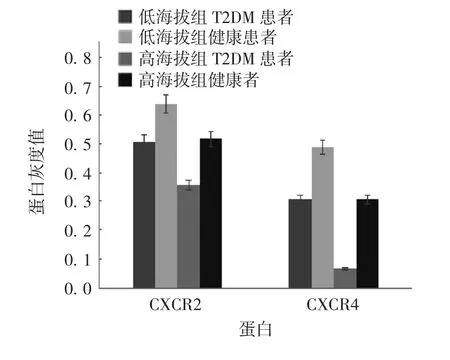
图2 不同海拔组间PBMCs表面各相关蛋白表达量的比较Fig.2 Expression levels of relevant proteins on surface of PBMCs in high and low altitude groups
3 讨论
T2DM前状态以及糖尿病整个发展过程中均伴有慢性炎症反应,多种炎性细胞、因子参与其中[8],影响着糖尿病血管并发症的发生和发展[9]。且随着海拔升高,机体PBMCs中HIF-1α的表达增强,以此适应缺氧环境,维持机体代谢[10]。
本研究显示,高海拔地区研究对象相比低海拔地区血清HIF-1α表达升高,且高海拔T2DM患者的表达更为显著,这与EBROWSKA等[11]的研究结果一致,提示高海拔地区T2DM患者相比低海拔地区T2DM患者机体缺氧更为严重。此外VEGF作为HIF-1α的下游靶因子,受其正向调节,对于高糖和缺氧引起的血管内皮损伤具有保护作用[12]。而本研究结果显示,血清VEGF和HIF-1α的表达呈负相关,高海拔地区VEGF水平低于低海拔地区,且在高海拔地区T2DM患者中差异更明显。可能是长期高海拔缺氧和高糖环境使得HIF-1α对VEGF的调节受损,使之不能发挥促血管生成的作用[13]。或者由于本次高海拔地区海拔仅为1 520米,相比于3 000米以上地区缺氧程度较低,VEGF表达处于过渡性的暂时下调状态,调节机制为由代偿向失代偿的转变中[14]。
SDF-1(CXCL12)是由单核细胞、淋巴细胞、内皮细胞等分泌的趋化因子,可通过与其特异性受体CXCR4结合,调节造血干细胞的归巢,参与多种炎症细胞及内皮细胞的分化、迁移、浸润和募集,与血管形成、血管壁炎性反应相关[15-16]。因此,SDF-1/CXCR4轴对于糖尿病大小血管炎症和血管再生起重要作用。本研究显示,SDF-1的表达与HIF-1α成正相关。这是由于在缺氧情况下,HIF-1α会正向诱导SDF-1表达,调节细胞迁移、归巢以促进血管生成[17]。然而SDF-1与其调控的受体CXCR4基因及蛋白的表达呈负相关,结果显示高海拔组低于低海拔组,高海拔组T2DM患者与低海拔组T2DM患者也相同,与相关研究结果[18]相反。提示海拔的升高导致对CXCR4基因及蛋白的调控出现异常。此外结果还显示,SDF-1调节的LFA-1基因在高海拔组表达降低,显示出与SDF-1表达相反的关系。这与SDF-1下调LFA-1的活性,抑制PBMCs的黏附级联的作用有关[19-20]。LFA-1作为白细胞表面分泌的一种整合素,通常与ICAM-1结合,参与包括PBMCs在内的多种白细胞与内皮细胞之间的黏附,在动脉粥样硬化中发挥着重要作用[21]。由此可知,在高海拔下,尤其是高海拔的糖尿病患者中SDF-1虽然对其配体基因的调节出现紊乱,无法实行血管内皮的修复作用,但可以正常抑制炎症细胞之间的黏附聚集,防止血管动脉粥样硬化的形成。
IL-8(CXCL8)是一种重要的炎性因子,也是白细胞分泌的趋化因子和化学调节剂。通常与其配体CXCR2结合响应机体免疫调节,募集炎症细胞向内皮迁移,影响内皮因子的释放及血管张力,引起内皮功能障碍,促进糖尿病动脉粥样硬化的形成[22]。本研究结果显示,与低海拔组T2DM患者相比,高海拔组T2DM患者IL-8水平、CXCR2基因及蛋白水平均较低。与DERAKHSHAN等[23]对T2DM患者外周血PBMCs中检测的IL-8结果相反。这可能是受海拔影响,使得HIF-1α在单核细胞或内皮细胞中抑制Nrf2转录因子,从而降低了IL-8的表达[24-25]。也可能高浓度的SDF-1抑制IL-8的表达,起到抑制血管斑块形成的作用[26],但两者之间的具体机制尚不清楚。
综上所述,本研究结果提示高海拔组T2DM患者PBMCs的迁移能力增强,与血管内皮之间的黏附作用减低,成血管能力减弱,处于动脉粥样硬化形成的初期阶段。这与一些学者的研究结果相反,可能与调查点海拔不高,以及在该地长期居住的T2DM患者以及健康者本身受缺氧影响,机体发生了适应性代偿,在代谢水平上与其他较低海拔地区的糖尿病患者和健康者之间本身存在差异有关。当然,因受本研究基金及实验条件的限制,所选样本量较少,未按糖尿病血管并发症分类进行进一步的分层分析,可能使结果出现一定偏倚。此外,本研究是基于海拔因素对T2DM患者PBMCs功能变化情况进行了体外试验的分析,目前相似研究较少,值得相关学者借鉴。同时也使得通过PBMCs的移植治疗高海拔T2DM成为可能。但需要日后大样本的调查及体内试验的进一步论证。

