柯萨奇病毒A2病毒样颗粒的制备、纯化及鉴定
禹玉婷,胡岗,罗志宇,卢佳,王泽鋆,孟胜利,申硕
武汉生物制品研究所有限责任公司,湖北武汉430070
手足口病(hand,foot and mouth disease,HFMD)是由多种肠道病毒感染引起的一种病毒性疾病。HFMD在世界范围内出现多次暴发流行,以夏秋季常见。患者主要为学龄前儿童,尤以3岁以下年龄组发病率最高,临床表现为口腔黏膜、手足等多处疱疹,少数可引起脑炎、肺水肿、弛缓性麻痹、心肌炎和心脏衰竭等严重并发症,甚至导致死亡[1]。
引起HFMD的肠道病毒至少有20多个型,包括柯萨奇病毒A组(Coxsackievirus A,CV-A)的2、4、5、6、10、12和16型,柯萨奇病毒B组(Coxsackievirus B,CVB)的5个型,埃可病毒(Echovirus,Echo),肠道病毒71型(enterovirus 71,EV-A71)。CV-A2于1947年在美国特拉华首次分离得到原型株Fleetwood[2],基因结构分为5′非编码区、3′非编码区及位于非编码区之间的开放阅读框架。其编码区包含编码结构蛋白的P1区和编码非结构蛋白的P2、P3区。P1区编码4种衣壳蛋白VP1、VP2、VP3、VP4,除VP4包埋在病毒粒子外壳的内侧与病毒核心紧密连接外,其他3种结构蛋白均暴露在病毒颗粒的表面;P2和P3区编码7种非结构蛋白2APro、2BPro、2CPro、3APro、3BPro、3CPro和3DPro,与病毒RNA的复制和转录、病毒多聚蛋白的剪切、病毒颗粒的装配等功能相关。细胞表达的重组多聚蛋白P1被同时表达的3CDproC酶剪切为VP0、VP1和V-A4,装配为成分与病毒感染后的前颗粒(procapsid)相似的病毒样颗粒(viruslike particles,VLPs)。CV-A2主要引起疱疹性咽峡炎、脑炎、脊髓炎、心肌炎、心包炎、流行性胸痛、呼吸道感染、HFMD、婴儿腹泻等,引起暴发流行[3-7]。2008年中国台湾肠道病毒流行时,在221份采集样品中,73%(161/221例)为疱疹性咽峡炎,27%(60/221例)为HFMD[8]。2012年瑞典肠道病毒早期感染的随访中,CV-A2感染比例占9.6%,仅次于CV-A9(13.5%)和CV-A16(11.5%)[9]。CV-A2感染引起的疾病多数症状较轻、病程较短,且较少出现并发症或留下后遗症[10-12]。但也出现因感染CV-A2引起手足口重症并导致死亡的报道[13]:2012年6月10日,中国香港1位健康的4岁男童出现发烧、咳嗽和鼻漏,入院后4 h死亡。同年6月19日,中国香港1名2个月大女童,上呼吸道感染持续3 d,入院后1 h死亡。两名患儿的尸检结果均显示CV-A2感染呈阳性,且分离株为CV-A2与EV-71和CV-A4的重组株。本实验室于2016年10月至2017年12月在湖北省襄阳市进行的HFMD病原学研究表明,CV-A2可引起HFMD暴发流行,且与CV-A5、CV-A6、CV-A10、CV-A16和EV-A71共同流行,成为HFMD的主要病原体之一;同时发现,CV-A2也可引起重症病例[14]。因此,对这种血清型肠道病毒的监测和基础研究具有非常重要的意义和实用价值。
目前,预防HFMD的主要候选疫苗为细胞基质全病毒灭活疫苗和VLPs疫苗。然而,灭活疫苗中除EV-A71和CV-A16外,其他主要血清型病毒较难在人用疫苗基质细胞中生长。VLPs具有产量大、易富集和易纯化的特点,也使得其逐渐广泛应用于疫苗领域。因此,探索杆状病毒Bac-to-Bac表达系统,纯化CV-A2 VLPs,具有重要的应用意义,可为CV-A2及多价HFMD疫苗的研制提供参考。本研究构建了CV-A2 P1-3CD重组Bacmid质粒,并表达了rCV-A2 VLPs,为今后rCV-A2 VLPs疫苗的研发奠定了基础。
1 材料与方法
1.1 质粒及细胞 pFastBacDual穿梭质粒、Sf9细胞、人横纹肌肉瘤细胞(RD)由武汉生物制品研究所有限责任公司保存,E.coli DH10 BacTM感受态细胞由该公司病毒疫苗研究一室制备并保存。
1.2 主要试剂及仪器 RNA抽提纯化试剂购自生工生物工程(上海)股份有限公司;PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit、DNA marker购 自 日 本TaKaRa公司;Sf900Ⅲ培养基购自美国Gibco公司;CellfectionⅡReagent和羊抗兔Alexa-488多抗购自美国Invitrogen公司;AxyPrep plasmid miniprep kit购自美国Axygen公司;蛋白质marker及BamHⅠ、SpeⅠ、XhoⅠ和SphⅠ限制性内切酶购自美国Thermo Fisher公司;抗CV-A5 VLP兔多抗由北京生物制品研究所有限责任公司提供;抗CV-A5 VP1兔多抗、抗CV-A5 VP2兔多抗、抗CV-A5 VP3兔多抗和抗CV-A5 FP兔多抗由武汉生物制品研究所有限责任公司病毒疫苗研究一室制备;HRP标记的羊抗兔IgG(H+L)购自美国Boster公司;凝胶成像系统仪购自芬兰BioTop公司;30 kD超滤浓缩膜包购自美国Millipore公司。
1.3 CV-A2 P1-3CD重组Bac m i d的构建
1.3.1 P1和3CD基因序列的确定 武汉生物制品研究所有限责任公司病毒性疫苗研究一室于2016年10月至2017年12月从湖北省襄阳市HFMD患者中收集临床样本,并在人横纹肌肉瘤细胞(RD)中分离得到CV-A2-1580R4/CHN XY/2017株。提取病毒RNA,利用Oligo dT/Random引物(Prime ScriptTMⅡ1st Strand cDNA Synthesis Kit)逆转录成cDNA,以其为模板,加入设计的全基因组测序引物,进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳鉴定。PCR反应体系:PremixLA Taq 10μL,Forward Prime(r20μmol/L)1μL,Reverse Prime(r20μmol/L)1μL,cDNA product(≥50 ng/μL)0.5μL,H2O 7.5μL,总体积20μL。反应条件:94℃5 min;94℃30 s,52℃30 s,72℃1 min,共30~35个循环;72℃10 min。扩增产物送生工生物工程(上海)股份有限公司测序。与CV-A2原型株Fleetwood株(GenBank:AY421760.1)进行比对,确定P1和3CD序列。
1.3.2 重组质粒pFastBacDualCV-A2 P1-3CD的构建 依据昆虫细胞偏好特性优化密码子并合成P1和3CD cDNA基因,通过T-A克隆,将P1和3CD片段连接至pFastBacDual载体上,将2个基因片段,分别置于多角体蛋白启动子pPh和pP10启动子后,以上操作由生工生物工程(上海)股份有限公司完成。将得到的重组质粒pFastBacDualCV-A2 P1-3CD分别进行BamHⅠ/SpeⅠ和XhoⅠ/SphⅠ双酶切鉴定。
1.3.3 CV-A2P1-3CD Bacmid重组 将pFastBac Dual CV-A2 P1-3CD质粒转化DH10 BacTM感受态细胞,37℃培养72 h,获得CV-A2 P1-3CD重组Bacmid。利用引物对CV-A2 P1-3CD重组Bacmid进行鉴定,引物序列见表1,其中,扩增M13F/M13R片段(7016bp)的正反向引物分别为M13F和M13R,扩增P1片段(3 112 bp)的正反向引物分别为M13F和CV-A2-P1,扩增3CD(3 586 bp)片段的正反向引物分别为CVA2-3CD和M13R。引物由生工生物工程(上海)股份有限公司合成。PCR反应体系:反应缓冲液15.2μL,DNA模板0.4μL,Taq酶混合物3.6μL,正反向引物各0.8μL(1.0 ng/μL),补加ddH2O至20μL。反应条件:94℃5 min;94℃30 s,55℃30 s,72℃30 s,共35个循环。将CV-A2 P1-3CD重组Bacmid感染Sf9细胞96 h后,镜下观察细胞形态。

表1 引物序列Tab.1 Sequences of primers
1.4 重组杆状病毒rBac-CV-A2 P1-3CD的构建及鉴定
1.4.1 重组杆状病毒rBac-CV-A2 P1-3CD的构建及DNA鉴定 按照Cellfection®Reagent说明书进行操作。将CV-A2 P1-3CD重组Bacmid转染Sf9细胞,于生化培养箱27℃培养至出现细胞病变,获得重组杆状病毒rBac-CV-A2 P1-3CD。提取病毒DNA,利用M13F/M13R和M13R/CV-A2-3CD引物进行PCR扩增,对插入的DNA序列进行鉴定。PCR反应体系及反应条件同1.3.3项。
1.4.2 IFA试验 对重组杆状病毒rBac-CV-A2 P1-3CD进行鉴定。将病毒转染昆虫细胞Sf9 72 h后,用4%多聚甲醛固定,5%BSA+0.5%TritonX-100+PBS室温封闭;加入兔抗CV-A2 VLP多抗(1∶1 000稀释),4℃孵育过夜;加入羊抗鼠Alexa-488(1∶2 000稀释),37℃孵育1 h;荧光显微镜下观察。
1.5 r CV-A2 V L Ps的纯化及鉴定
1.5.1 蔗糖垫底及氯化铯密度梯度离心 收集rCVA2 VLPs感染的Sf9细胞,反复冻融后离心去细胞碎片,上清经孔径为30 kD的膜包超滤浓缩,浓缩产物经20%蔗糖,15 000×g垫底离心4 h,1.31 g/mL CsCl密度25 000×g离心20 h,抽取目标条带。
1.5.2 SDS-PAGE及Westernblot鉴定 将纯化后的rCV-A2 VLPs分别经0.1%SDS-12.5%PAGE和Western blot鉴定。Western blot:以抗CV-A2 VLP多抗(1∶2 000稀释)为一抗,4℃孵育过夜;以羊抗鼠多抗(1∶5 000稀释)为二抗,37℃孵育1 h;最后用DAB显色系统显色。
1.5.3 透射电镜观察 取样品100μL,与铜网有支持膜的表面接触,静置3 min,用3%磷钨酸负染5 min,常温过夜晾干,送中国科学院武汉病毒所进行电镜观察。
2 结果
2.1 P1和3CD基因序列 扩增产物经1%琼脂糖电泳鉴定,可见清晰的目的条带,见图1。利用SeqMan(7.1.0)软件拼接测序结果,获得CV-A2-1580R4/CHNXY/2017株基因组全序列。序列全长7 401 bp,非编码区5′-UTR、3′-UTR在基因组的核苷酸位置分别为1~747 bp和7 321~7 401 bp,3′-UTR后带长度未确定的多聚A尾,编码的多聚蛋白(Poly-protein)长度为2 191个氨基酸残基。P1序列位置为748~3 324 bp,3CD序列位置为5 383~7 317 bp。
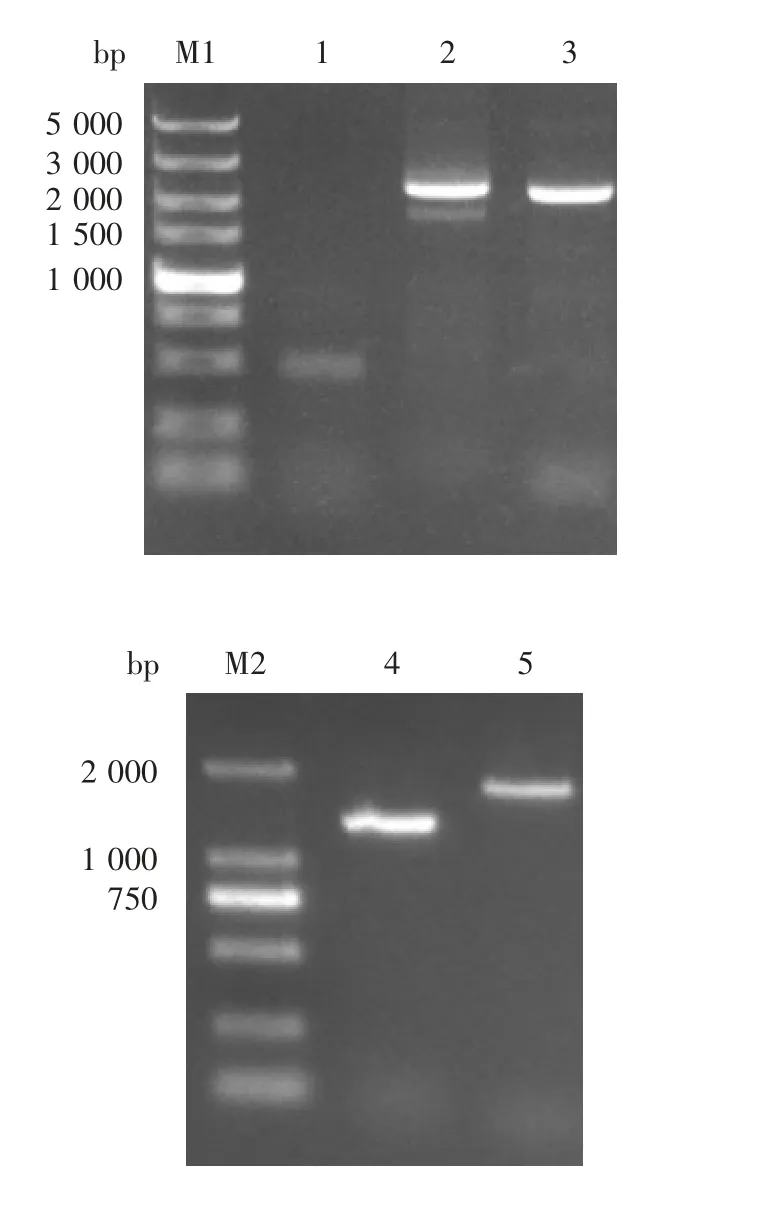
图1 CV-A2部分序列PCR扩增产物电泳图Fig.1 Electrophoretic profile of PCR products of partial CV-A2 gene sequences
2.2 重组质粒pF astBacD u a l CV-A2 P1-3CD的鉴定质粒的双酶切产物经1%琼脂糖凝胶电泳分析,分别在2 587和1 948 bp处可见特异性条带,大小与合成的CV-A2 P1和CV-A2 3CD片段一致,见图2。
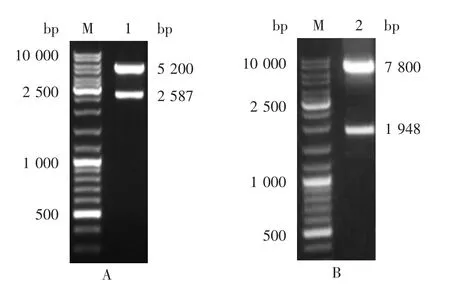
图2 CV-A2 P1(A)和CV-A2 3CD(B)基因扩增产物电泳图Fig.2 Electrophoretic profile of PCR products of CV-A2 P1(A)and CV-A2 3CD(B)genes
2.3 CV-A2P1-3CD重组Bac m i d的鉴定1%琼脂糖凝胶电泳分析显示,在7 016、3 112和3 586 bp处可见特异性条带,大小分别与M13F/M13R、P1和3CD相符,见图3,表明CV-A2 P1-3CD基因成功转座至Bacmid。CV-A2 P1-3CD重组Bacmid感染Sf9细胞96 h后,细胞裂解破碎、脱落,见图4。
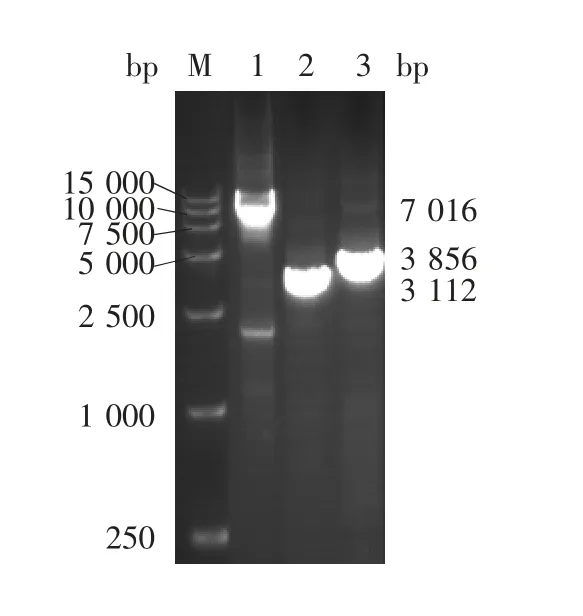
图3 CV-A2 P1-3CD重组Bacmid的PCR鉴定Fig.3 Identification of recombinant Bacmid with pFastBac-Dual-CV-A2 P1-3CD by PCR

图4 CV-A2 P1-3CD重组Bacmid感染Sf9细胞的显微镜观察(×200)Fig.4 Microscopy of Sf9 cells infected by recombinant Bacmid with CV-A2 P1-3CD(×200)
2.4 重组杆状病毒rBac-CV-A2 P1-3CD的鉴定 1%琼脂糖凝胶电泳分析显示,在7 016和3 586 bp处可见特异性条带,大小分别与M13F/M13R和M13R/CV-A2-3CD引物扩增条带相符,见图5,重组杆状病毒rBac-CV-A2 P1-3CD感染成功,获得目的rCV-A2 VLPs。

图5 重组杆状病毒rBac-CV-A2 P1-3CD的PCR鉴定Fig.5 Identification of rBac-CV-A2 P1-3CD by PCR
2.5 r CV-A2 P1-3C D蛋白的I FA鉴定 rCV-A2 P1-3CD蛋白可与多克隆抗体发生反应,其感染细胞可检测到绿色荧光,而未感染细胞无荧光信号,见图6,表明rCV-A2 VLPs蛋白成功表达。

图6 Sf9细胞表达rCV-A2 VLPs的IFA检测(×200)Fig.6 IFA of rCV-A2 VLPs expressed in Sf9 cells(×200)
2.6 纯化的r CV-A2 V L Ps的鉴定
2.6.1 CsCl密度梯度离心 感染rCV-A2 VLPs的Sf9细胞上清经蔗糖垫底离心和CsCl密度梯度离心后,可见明显条带,中间条带为目的产物。见图7。

图7 CsCl密度梯度离心纯化rCV-A2 VLPsFig.7 Purification of rCV-A2 VLPs by cesium chloride density gradient centrifugation
2.6.2 SDS-PAGE及Westernblot rCV-A2VLPs经SDSPAGE和Western blot分析,均可见清晰的VP0(相对分子质量约39 000)、VP1(相对分子质量约34 000)和VP3(相对分子质量约27 000)条带,见图8。

图8 rCV-A2 VLPs蛋白的SDS-PAGE(A)及Western blot(B)鉴定Fig.8 SDS-PAGE(A)and Western blot(B)profilesof rCVA2 VLPs
2.6.3 透射电镜观察 病毒颗粒分布均匀,形状规则,直径23~33 nm,形态和大小与肠道病毒CV-A2一致,见图9。

图9 纯化rCV-A2 VLPs的电镜观察(×200)Fig.9 Electron microscopy of purified rCV-A2 VLPs(×200)
3 讨论
本研究成功构建了重组质粒pFastBacDualCVA2 P1-3CD,转化DH10 BacTM感受态细胞,获得CVA2 P1-3CD重组Bacmid,转染Sf9细胞后能够表达VLPs,表达的蛋白能与rCV-A2 VLPs多抗结合,且相对分子质量大小与CV-A2 VP0、VP1和VP3相符。透射电镜观察显示,表达的VLPs与CV-A2的形态结构一致,表明rCV-A2 VLPs制备成功。
VLPs是含有病毒的一个或多个结构蛋白的空心颗粒,无病毒核酸,不能自主复制,其在病毒结构上与天然病毒粒子相同或者相似,可通过与病毒感染相似的途径呈递给免疫细胞,有效地诱导机体免疫系统产生免疫反应,因此是理想的诊断试剂或者疫苗抗原。杆状病毒的多角体蛋白在病毒复制的晚期大量合成,早在上世纪80年代就有科学家提出使用外源基因代替多角体编码序列,进而表达外源蛋白的设想[15]。1983年,SMITH等[16]首次报道了使用昆虫细胞杆状病毒表达系统获得人β干扰素,使得这种设想成为现实。杆状病毒具有基因容量大、启动子强、目的基因真核表达、不感染人等特点[17],这些特性使得利用杆状病毒表达的基因遍及病毒、细菌、真菌、动物及植物等各种生物群,该表达系统也成为当前应用最广、功能最全的真核表达系统。另外现在有很多杆状病毒表达系统的优化策略相继提出,有的已经成功的商品化。如在杆状病毒基因组的改造方面,出现了第2代杆状病毒表达系统FlashBAC系列,该系列系统缺失了杆状病毒基因组DNA必需基因的一部分,用一段人工合成的基因(bacterial artificial chromosome,BAC)替代多角体编码区,该系统中删除chiA基因的flashBAC载体、chiA和V-cath基因的flashBAC-GOLD载体和chiA、V-cathp、p10、p74和p26基因的flashBAC-ULTRA载体,均能明显提高蛋白表达量。另外,在昆虫细胞系的改造方面,在Sf9细胞基础上改良的Supper Sf9-1、Supper Sf9-2和Supper Sf9-3细胞均能大幅度提高重组蛋白的稳定性。
随着分子生物学技术的日益成熟,人们对杆状病毒和昆虫细胞系的研究将会更加深入,改造也会更多,昆虫杆状病毒表达系统的应用也会更加广泛,必将发挥越来越重要的作用。

