胰高血糖素样肽-1衍生物的聚乙二醇定点修饰及其产物性质分析
秦荣浦,田石华,江筠,刘敏,何成,杨宇峰,楼觉人
上海生物制品研究所第二研究室,上海200051
2型糖尿病为一种慢性代谢病,主要病理表现为高血糖症及微血管并发症,是影响人类生活的重大疾病之一。我国为糖尿病大国,2013年对慢性病及其危险因素监测显示,18岁及以上人群糖尿病患病率为10.4%[1]。二甲双胍是治疗2型糖尿病的常用一线药,单独使用降糖效果不佳时,可采用联合用药治疗。目前主要联合用药包括磺脲类药物、噻唑烷二酮类药物、二肽基肽酶抑制剂、基础胰岛素及胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)受体激动剂[2]。GLP-1受体激动剂为一种新型降血糖药物,在增强患者血糖调控能力的同时还可减轻患者体重,降低心脏收缩压,且低血糖风险率较低。这些独特优势使GLP-1受体激动剂降糖药物开发成为热点[3]。
GLP-1主要由回肠及结肠的L细胞分泌,以葡萄糖浓度依赖性方式促进胰岛素分泌,参与机体血糖稳态调节[4]。GLP-1由30个氨基酸组成,相对分子质量小(3 000),易被体内二肽基肽酶4降解及肾小球过滤清除,因此半衰期短,限制了其临床应用[5]。聚乙二醇(polyethylene glycol,PEG)修饰剂作为改良药物特性的修饰剂,是实现蛋白药物在体内半衰期延长的重要途径之一[6]。采用特定结构的PEG修饰剂对GLP-1进行修饰,在保留其与GLP-1受体结合并发挥生物学效应的同时使其不易被酶快速降解,从而延长半衰期,增加GLP-1活性水平以达到药理浓度。本研究前期对GLP-1分子序列进行优化,得到生物学活性较优的GLP-1衍生物(GLP-1analogue,GLP-1a),通过筛选不同结构、不同相对分子质量PEG修饰剂,最终确定马来酰亚胺活化的相对分子质量40 000的PEG(MAL-PEG40K)修饰GLP-1a的产物MAL-PEG40K-GLP-1a降血糖效果显著,半衰期长,具有良好的药物开发前景[7]。
本研究用MAL-PEG40K定点修饰GLP-1a,通过强阳离子交换层析分离纯化修饰混合物,并对修改产物部分性质进行分析,以期开发出安全、长效的新型GLP-1受体激动剂。
1 材料与方法
1.1 细胞株及质粒 HEK-293细胞株由上海生物制品研究所第二研究室保存;GLP-1受体质粒及分泌型碱性磷酸酶(secreted alkaline phosphatase,SEAP)报告基因质粒购自苏州欣赛生物科技有限公司。
1.2 主要试剂及仪器 GLP-1a氨基酸序列(HAib-EGTFTSDVSSYLEEQAAKEFIAWLVKGRGC-NH2)及GLP-1a干粉由浙江中肽生物公司化学合成和制备;MAL-PEG40K购自厦门赛诺邦格生物科技有限公司,结构式见图1;碱性磷酸酶二乙醇胺活性检测试剂盒购自德国Sigma-Aldrich公司;POROSTM50 HS强阳离子交换填料购自美国Thermofisher公司;XBridgeshield 5μm C18反相色谱柱(3 mm×150 mm,5μm,130Å)购自美国Waters公司;1200 infinity series高效液相色谱系统购自美国安捷伦公司;SpectraMax i3多功能酶标仪购自美国Molecular Devices公司;鱼跃悦准Ⅳ型血糖仪及配套血糖测试试纸条购自鱼跃医疗。

图1 聚乙二醇修饰剂分子结构式Fig.1 Molecular structure of PEG as modifier
1.3 实验动物 SPF级健康昆明小鼠80只,雌性,6~8周龄,体量18~22 g,由上海生物制品研究所实验动物中心提供,合格证号:20092009002001612。于18~25℃、相对湿度50%~60%、昼夜循环照明环境中分笼饲养,可自由摄食及饮水。
1.4 M AL-P EG40K-GL P-1a的制备 精确称取100 mg GLP-1a干粉及200 mg MAL-PEG40K干粉,溶于5 mL 200 mmol/L PBS(pH 7.4)中,4℃振荡反应1 h后,用柠檬酸缓冲液(pH 3.5)稀释10倍,POROSHS强阳离子交换层析柱经柠檬酸缓冲液平衡后,产物上样,流速1 mL/min,用含1 mol/L NaCl的柠檬酸缓冲液线性洗脱,收集洗脱峰,0.5 mol/L NaOH洗脱杂质,4℃保存。
1.5 M AL-P EG40K-GL P-1a性质分析
1.5.1 纯度
1.5.1.1 SDS-PAGE 取GLP-1a单体、修饰混合物、流穿峰、洗脱峰各20μL,进行12%SDS-PAGE,采用凝胶成像系统配套软件对凝胶图谱进行扫描分析。计算多肽PEG修饰率(PEG修饰后多肽条带的灰度值占该泳道总蛋白灰度值百分比)及修饰产物纯度。
1.5.1.2 反相高压液相色谱法(RP-HPLC) 采用XBridge shield 5μm C18色谱柱,流动相A为0.1%三氟乙酸水溶液,流动相B为0.1%三氟乙酸乙腈溶液,梯度程序:0~5 min 10%B液;5~30 min 10%~60%B液;30~35 min 95%B液。流速为0.5 mL/min,检测波长为210 nm,柱温为25℃,进样体积为20μL。
1.5.2 体外活性保留率 采用报告基因法。报告基因分析是利用药物作用后报告基因表达的变化来反映药物的活性。将GLP-1受体质粒及SEAP报告基因质粒瞬时共转染HEK-293细胞,6 h后加入GLP-1a单体及MAL-PEG40K-GLP-1a;44 h后取细胞上清,置65℃烘箱内加热30 min;取80μL细胞上清液至96孔板中,加入碱性磷酸酶预混检测工作液,120μL/孔。酶标仪波长405 nm处检测样品吸光度值,以测定的报告基因碱性磷酸酶活性表示MAL-PEG40K-GLP-1a及GLP-1a的体外活性,获得半数有效浓度EC50。按下式计算MAL-PEG40K-GLP-1a活性保留率。

1.5.3 体内生物学活性 采用急性降血糖试验。昆明小鼠试验前一晚禁食不禁水12 h,次日早测基础血糖值,记为0 h时血糖值。将80只小鼠随机分为5组:PBS对照组(免疫剂量与试验组一致)、10 nmol/kg GLP-1a组及10、15、30 nmol/kg MAL-PEG40K-GLP-1a组,每组16只,腹腔注射给药。分别于2、5、8、11、13及24 h后剪尾取血,测血糖值。每次测血糖前30 min补充37%葡萄糖200μL。
1.6 统计学分析 采用GraphPad Prism 7软件处理数据,试验数据以±s表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 M AL-P EG40K-GL P-1a纯度
2.1.1 SDS-PAGE 经12%SDS-PAGE分析,MALPEG40K对GLP-1a的修饰率为88%。修饰混合物通过强阳离子交换层析柱后,出现1个较大流穿峰及2个盐洗脱峰(修饰产物及未修饰GLP-1a),修饰产物纯度达95%。见图2和图3。
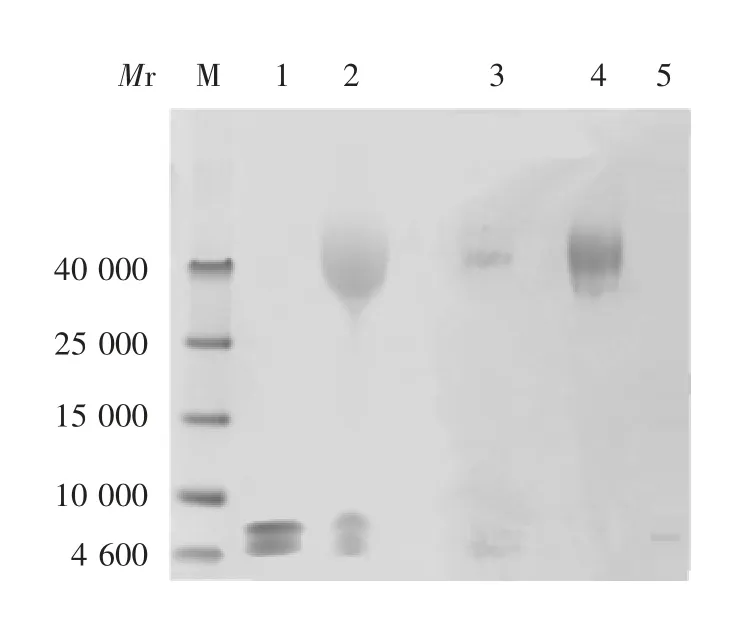
图2 修饰混合物的SDS-PAGE分析Fig.2 SDS-PAGE profile of modified mixture
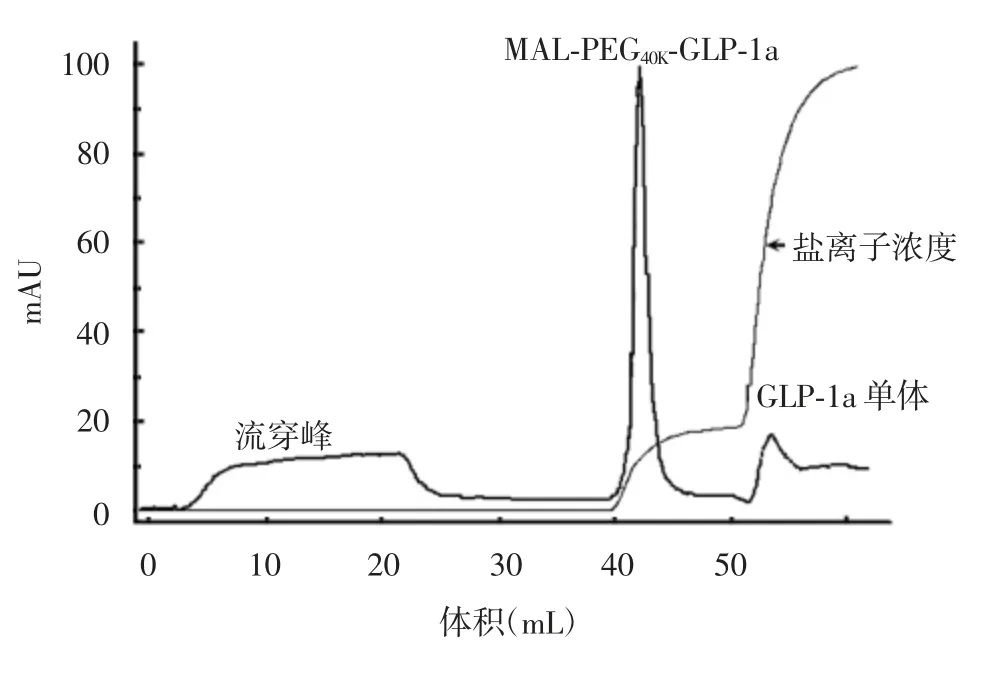
图3 修饰混合物的强阳离子交换层析图谱Fig.3 Strong cation exchange chromatographic profile of modified mixture
2.1.2 RP-HPLC 结果显示,MAL-PEG40K修饰产物的保留时间为23.92 min,纯度为98.1%,见图4。

图4 修饰产物的RP-HPLC图谱Fig.4 RP-HPLCprofile of modified product
2.2 M AL-P EG40K-GL P-1a的体外活性保留率 经报告基因法检测,GLP-1a单体的EC50为0.027 nmol/L,MAL-PEG40K-GLP-1a的EC50为0.118 nmol/L,MALPEG40K-GLP-1a活性保留率为22.9%,见图5。
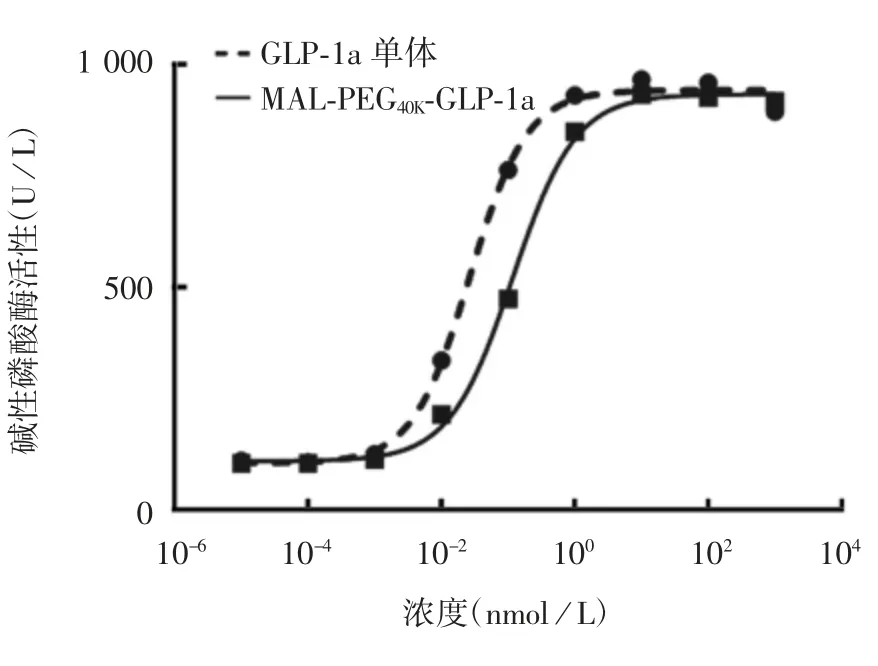
图5 不同浓度GLP-1a及MAL-PEG40k-GLP-1a对碱性磷酸酶活性的影响Fig.5 Effect of different concentrations of GLP-1a and MALPEG40K-GLP-1a on activity of alkaline phosphatase
2.3 M AL-P EG40K-GL P-1a体内生物学活性 结果显示,GLP-1a经MAL-PEG40K修饰后,仍具有较好的降血糖活性(血糖浓度明显降低,且持续一定时间)。与GLP-1a单体比较,修饰产物表现出明显的体内稳定性,降血糖持续时间延长。同时,MAL-PEG40K-GLP-1a降血糖活性具有剂量依赖性,一定范围内,随着药物剂量增高,降血糖活性增强。见表1。
表1 各组小鼠不同时间的血糖浓度(mmol/L,±s,n=16)Tab.1 Blood sugar concentrations of mice in various groups at various time points after injection(mmol/L,±s,n=16)

表1 各组小鼠不同时间的血糖浓度(mmol/L,±s,n=16)Tab.1 Blood sugar concentrations of mice in various groups at various time points after injection(mmol/L,±s,n=16)
注:aa表示与PBS对照组比较,P<0.01(F为3.925~12.770)。与10 nmol/kg GLP-1a组比较,b表示P<0.05(F=2.61);bb表示P<0.01(F为2.94~7.40)。
组别 0 h 2 h 5 h 8 h 11 h 13 h 24 h PBS对照 5.05±0.5 23.42±3.8 20.73±2.6 16.77±2.5 16.88±5.4 16.18±3.6 18.65±4.5 10 nmol/kg GLP-1a 5.76±1.1 11.00±2.1aa 14.20±4.4aa 11.47±5.7aa 14.27±6.2 14.18±6.0 15.57±7.3 10 nmol/kg MAL- 5.48±0.6 8.51±1.9aa 6.26±2.1aa,bb 8.26±2.3aa 5.05±0.5aa,bb 5.35±2.9aa,bb 11.55±6.9aa,bb PEG40K-GLP-1a 15 nmol/kg MAL- 5.28±0.9 7.43±3.5aa,b 5.05±4.2aa,bb 5.90±3.0aa,bb 4.88±4.4aa,bb 5.17±4.4aa,bb 13.15±5.1 PEG40K-GLP-1a 30 nmol/kg MAL- 5.65±0.5 6.18±2.6aa,bb 4.52±0.9aa,bb 4.15±1.2aa,bb 4.20±1.1aa,bb 4.07±2.1aa,bb 11.25±6.1aa,bb PEG40K-GLP-1a
3 讨论
PEG修饰需遵循一个基本原则是修饰蛋白的药效要显著优于其前体蛋白。一般可用药代动力学和药效学两种指标衡量[8],前者用药物在体内的半衰期表示,后者用药物与受体的亲和力表示。PEG修饰能延长蛋白质药物在体内的半衰期,但PEG引起的位阻效应会导致其与受体的亲和力下降,表现为活性下降。因此在进行PEG修饰时,应充分考虑蛋白质药物特征来选择合适的修饰策略及位点,以期得到最适的修饰效果。
RUNGE等[9]用Ala逐一替代GLP-1多肽链中的氨基酸残基,通过检测胞内腺苷酸环化酶活力得到其受体激动活力保留率,发现GLP-1的N-端序列在激活配体产生效应应答方面具有十分重要作用。2010年,UNDERWOOD等[10]通过磁共振技术发现GLP-1与GLP-1受体通过双结构域(即受体结合结构域和受体激活结构)机制发生相互作用。其中GLP-1 N-端为受体激活结构域,通过与受体的跨膜区相互作用,激活受体下游结合的激动型G蛋白,进而引发信号应答。因此,为最大程度保留GLP-1生物学活性,PEG修饰位点应尽可能远离N-端。本研究将PEG修饰位点放在C-端,通过在C-末端引入1个游离半胱氨酸残基来实现PEG的定点修饰。修饰用PEG分子的选择主要从PEG修饰活性基团、PEG相对分子质量及线型/分支型三方面考虑。相对分子质量大的分支型PEG具有更大空间位阻,因而能有效屏蔽蛋白质表面抗原位点及酶解位点,使修饰蛋白的活性保留率更高。通过大量前期筛选实验,最终确定相对分子质量40 000的分支型具有马来酰亚胺活化基团的MAL-PEG40K作为PEG修饰剂。
在pH 6.5~7.5条件下,MAL-PEG40K分子中马来酰亚胺活性基团可与蛋白质中游离巯基发生亲核加成[11],形成稳定共价键,获得MAL-PEG40K-GLP-1a复合物。MAL-PEG40K-GLP-1a与GLP-1a单体比较,部分理化性质发生了改变,如等电点、溶解度、沉降系数等,这些变化导致了其药学性质的改善,主要包括物理和热稳定性提升、体内半衰期延长及免疫原性降低等。采用离子交换层析进行目标产物的分离纯化,GLP-1a理论等电点为5.45,在pH为3.5上样缓冲液中,GLP-1a及MAL-PEG40K-GLP-1a均带有正电荷,吸附于柱上。用盐梯度线性洗脱时,由于PEG侧链的电荷屏蔽作用,MAL-PEG40K-GLP-1a先于GLP-1a被盐梯度洗脱,从而实现目的产物分离。但在样品上样过程中发现有大量目标产物未能吸附在离子柱上而直接流穿,即使继续降低上样pH值,仍收效甚微。分析原因可能是GLP-1a相对分子质量小,带电荷数少,加上PEG覆盖于多肽表面,阻碍了多肽与离子交换树脂侧链的结合,因而大量目的产物流穿,降低了目的产物的回收率。
PEG位阻效应引起的受体亲和力下降也体现在报告基因体外细胞试验中。相较GLP-1a单体,修饰产物的活性保留率仅为22.9%,这也是由于PEG侧链遮蔽了GLP-1衍生物与受体结合的特定位点。由于修饰产物MAL-PEG40K-GLP-1a相对分子质量大,降低了肾脏清除率,抗酶降解能力增强,因此,体内降血糖时间明显延长,活性明显提高。小鼠体内急性降血糖试验中,MAL-PEG40K-GLP-1a的降血糖效果及体内半衰期均明显强于GLP-1a单体,初步提示经PEG修饰的GLP-1a在体内降血糖持续时间得到延长,具体半衰期研究有待进一步试验探究。
综上所述,MAL-PEG40K定点修饰GLP-1a的方法简便可行,制备的修饰产物药学性质得到改善,下一步将对其进行更深入研究,以期开发出安全、长效的GLP-1受体激动剂。

