一种卵巢癌类器官的制备方法建立及鉴定
陈曦 冯雁 刘萤照 毛露 黄春桃 王琪
卵巢癌是常见的妇科生殖系统恶性肿瘤,发病率仅次于宫颈癌和子宫内膜癌,但死亡率居妇科恶性肿瘤之首[1]。卵巢癌发病隐匿,早期无典型症状,临床发现多为中晚期,死亡率高,预后极差,严重威胁患者生命。据世界卫生组织统计,每年约有14万例患者死于卵巢癌,卵巢癌也是全球女性第7种最常见的癌症形式和第8大癌症相关死亡原因[2⁃3]。从组织学和分子水平来看,卵巢癌是一种临床上多样化、形态和分子异质性的疾病[4]。因此亟需探索适应精准治疗的研究模型补充现有常用模型的不足。
类器官是三维培养具有干性潜能的细胞所形成的相应器官的部分组织[5]。传代后,类器官与相应的肿瘤在基因组水平上仍然高度相似,能表现出某些疾病的遗传,表观遗传表型的能力也可能使特定干预成为促进个性化医学的工具[6⁃7]。类器官能够一定程度还原特定的三维结构、细胞类型组成和真实器官的功能,同时保持简化和易于获取的细胞培养模型。因此,类器官为一系列生物和生物医学应用带来了巨大希望。在基础组织和器官生物学研究中已经揭示了利用类器官重现体内现象的可能性。其中类器官也可以来源于肿瘤组织。肿瘤类器官不仅为癌症研究和治疗提供稳定可靠的模型,也为癌症个体化治疗开辟新的方向。由于类器官保留了原发性肿瘤的许多特征,且能够进行体外生长和大规模扩增,因此缩减了传统细胞系和基于原始样本的方法之间的关键差距。本研究探索了卵巢癌类器官模型的制备方法,采用新的类器官培养体系延长卵巢癌原代细胞的培养时间,在三维条件下培养形成类器官球组织,为后续患者的个体化治疗研究提供实验模型。
1 材料和方法
1.1 组织来源
卵巢癌组织取自2019—2020年于广西医科大学附属肿瘤医院初次手术且未接受新辅助化疗的3例晚期高级别浆液性腺癌卵巢癌患者,经组织病理学检查确诊。本研究经广西医科大学附属肿瘤医院伦理委员会批准。
1.2 主要试剂和仪器
Matrigel购自美国Corning公司,24孔低吸附板和70 μm细胞筛均购自德国Merck公司。DMEM/F12(含1%HEPES)培养基购自美国Thermo Fisher公司,RSPO1 购自美国Genscript公司,Noggin、EGF、FGF⁃10、rHubFGF(FGF2)购自上海普欣生物技术有限公司,Glutamax、TrypLE、CollagenaseⅠ和B27购自美国Gibco公司,nicotinamide、N⁃acetylcysteine、prostaglandin E2、SB202190和Y⁃27632均购自美国Selleckchem公司,A83⁃01购自美国TOCRIS公司,类器官冻存液购自北京科途医学科技有限公司,抗体p53(货号250143)、PAX⁃8(货号R25283)、WT⁃1(货号:251321)和CK7购自成都正能,即用型快捷免疫组化MaxVision试剂盒购自福州迈新生物技术开发有限公司,倒置显微镜购自日本Nikon公司,全景倒置扫描仪购自江苏斯托利仪器仪表有限公司,石蜡切片机购自德国Laica公司。
1.3 实验方法
1.3.1 溶液的配制 类器官基础培养液:向DMEM/F12 培养基加入1%HEPES、1×Glutamax。类器官完全培养基:主要参考Hill所在研究组发表的文献[8]:DMEM/F12培养基加入1%HEPES、1×Glutamax、1%HEPES、50 μg/mL RSPO1、100 ng/mL Noggin、50 ng/mL EGF、10 ng/mL FGF⁃10、10 ng/mL FGF⁃2、1×B27、10 mmol/L nicotinamide、1.25 mmol/L N⁃acetylcysteine、1 μmol/L prostaglandin E2、10 μmol/LSB202190 、500 nmol/L A83⁃01 以及 10 μmol/L Y⁃27632。组织清洗液:含10%青霉素和链霉素的1×PBS溶液。
1.3.2 类器官的构建 取术中切除的卵巢癌原发灶组织,严格采取无菌操作原则,切取约1 cm3的样本放入类器官基础培养基中保存。取回的癌组织标本放入60 mm培养皿内,用组织清洗液冲洗,去除血块、坏死及纤维成分。清理干净的组织中加入4 mL浓度100 U/mL CollagenaseⅠ消化,剪碎至1 mm3的小碎块,加少量培养液保持组织湿润。将组织碎块转至24孔低吸附培养板中,每孔滴加0.2 mL的CollagenaseⅠ。继续剪碎组织,待碎块呈细末状,滴入0.3 mL的CollagenaseⅠ,放入37℃培养箱消化约30 min。然后取出孔板,于倒置显微镜下观察孔板内细胞是否分离成单个或数个成簇的状态,若未完全分离,用移液吸头轻轻吹吸组织块数次,继续于37℃环境消化,每隔10 min观察1次,整个消化过程不超过90 min。将孔板中的消化产物用70 μm细胞筛过滤,收集至50 mL离心管内,加入30 mL 4℃预冷基础培养基,1000rpm离心3 min,弃上清液。重复2次,收集细胞沉淀,用冰上预冷的类器官完全培养液调整细胞浓度至1×105/mL。然后将Matrigel与细胞悬液以1∶9体积充分混合后置于冰上,种板时滴入24孔低吸附板中心位置,每孔0.3 mL。种板后将培养板置于37℃培养箱50 min。Matrigel固化后,沿培养板壁缓慢加入0.3 mL类器官完全培养基,每3 d更换1次培养基,约每2周传代。
1.3.3 类器官的传代、冻存和复苏 镜下观察细胞球体体积达到100 μm时进行传代。将待传代的Matrigel和培养基移至15 mL离心管中,加入适量PBS,用枪头轻柔吹打混匀,300 g离心3 min,去除上清液,收集沉淀。向沉淀中加入约2 mL的TrypLE,轻柔吹打,分散团块,37℃环境消化同时保持镜下观察,直至类器官酶解至3~5个细胞的小细胞团状态。终止消化时向细胞团块加入5 mL完全培养基,枪头轻柔吹打混匀,300 g离心3 min,去除上清液,收集沉淀。传代比例为1∶2~1∶3。一部分类器官加入类器官冻存液冻存,密度约为1×106/mL,放入梯度冻存盒于-80℃环境过夜后转移至液氮长期保存。复苏时冻存管用37℃水浴,溶解后快速转移至15 mL离心管,添加5 mL完全培养基,用移液管轻轻吹打3次,300 g离心3 min,去除上清液,种板培养。
1.3.4 类器官包埋切片 将从Matrigel中吹打分离出来的类器官用擦镜纸包裹,浸入4%多聚甲醛溶液中固定24 h,然后用梯度(50%、70%、80%、95%、100%×2,每梯度30 min)乙醇脱水;放入二甲苯乙醇对半溶液30 min,再转入纯二甲苯中浸渍2次,每次1 h。类器官进行石蜡包埋,切成厚度约为5 μm薄片,黏玻片并干燥。
1.3.5 HE染色 石蜡切片用二甲苯脱蜡2次,每次20 min;在无水乙醇与二甲苯对半混合液中透明30 min,梯度(100%×2、95%、90%、85%、去离子水,每梯度5 min)乙醇复水。用苏木素染色15 min,用体积分数2%盐酸乙醇分色2 min,流水冲洗使切片返蓝约15 min,浸入95%乙醇30 s。用伊红染色液染色5 min,浸入95%乙醇2次(每次30 s),然后放入100%乙醇中脱水30 min,在无水乙醇与二甲苯对半混合液中透明30 min,浸入纯二甲苯30 s,中性树胶封片,室温阴干。
1.3.6 免疫组化 烤片、脱蜡、复水方法同上。沸腾抗原修复3 min,3%过氧化氢阻断非特异性,正常动物非免疫羊血清封闭,一抗4℃孵育过夜,孵育二抗,DAB显色,苏木素复染后脱水透明,中性树胶封片,室温阴干。
1.3.7 组织鉴定 由本院病理科医师对患者原发灶肿瘤组织和类器官的HE染色和IHC染色结果进行鉴定。IHC评判标准:以肿瘤细胞胞膜和(或)胞浆着色为基准,随机观察5个高倍视野,以阳性表达强度和阳性细胞数综合判断。A:按显色细胞数记分,阳性细胞数<1/3为1分,阳性细胞数1/3~2/3为2分,阳性细胞数>2/3为3分。B:按细胞显色深浅记分,无阳性反应细胞为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。积分数=A×B。A×B=0判断为(-),A×B=1~2判断为(+),A×B=3~4判断为(++),A×B=6~9判断为(+++)。
2 结果
2.1 卵巢癌组织分离后形成球体结构
本研究培养和鉴定卵巢癌类器官的流程见图1,结果显示,003号卵巢癌类器官培养成功,见表1。在培养过程中观察到来自003号卵巢癌患者的肿瘤组织被分离后,在Matrigel内存活下来,形成紧密的球形细胞团,初代培养至14 d时球体直径最高能达到100 μm以上,见图2;且该类器官传代后仍可存活,见图3。

图1 卵巢癌类器官构建及鉴定操作流程图Fig.1 Operation flow chart of organoid construction and identi⁃fication

图2 003号卵巢癌类器官初代培养第14天(100×)Fig.2 Primary culture organoids of patient No.003 on the 14th day(100×)

图3 003号卵巢癌类器官第2代培养第14天(100×)Fig.3 2nd generation of cultured organoids of patient No.003 on the 14th day(100×)

表1 卵巢癌类器官的病理类型和构建情况Tab.1 Pathological classification and construction of ovarian cancer organoids
2.2 卵巢癌类器官保留了原肿瘤的组织细胞特征
HE染色结果显示,003号患者原肿瘤组织和类器官均表现出细胞核异型性和染色质浓聚的腺癌特征,两者在结构上高度相似,见图4。003号患者原肿瘤组织和培养至第2代的类器官免疫组化结果显示,两者p53、PAX⁃8、WT⁃1、CK7的表达程度均高度相似,尤其是p53和PAX⁃8,见图5。

图4 003号患者原肿瘤组织与类器官第2代的HE染色结果对比(200×)Fig.4 Comparison of HE staining results of the second generation of the original tumor tissue organoids of patient No.003(200×)
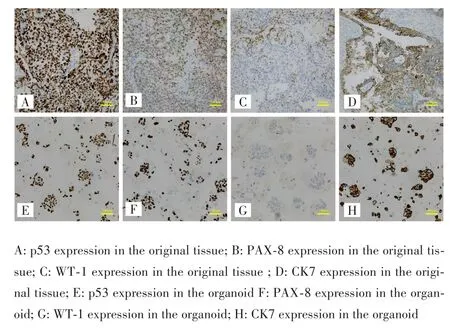
图5 003号患者原肿瘤组织和类器官p53、PAX⁃8、WT⁃1、CK7的免疫组化结果对比(200×)Fig.5 Comparison of the immunohistochemical results of p53,PAX⁃8,WT⁃1 and CK7 between the primary tissues and the organoid of patient No.003(200×)

表2 003号患者原卵巢癌组织和类器官免疫组化结果Tab.2 Immunohistochemical results of primary ovarian cancer tissue and organoid of patient No.003
3 讨论
目前已构建的卵巢肿瘤类器官涵盖多种类型,其中高级别浆液性癌(HGS)最常见[8⁃11]。其他构建成功的类型还包括低级别浆液性癌(LGS)、子宫内膜样癌(EMC)、黏液性癌(SBT)、透明细胞癌(CCC),也有黏液性囊腺瘤(MBT)、交界性Brenner瘤(BBT)、浆液性交界性肿瘤(MC)[9⁃10]。组织的取材部位多为原发灶和转移灶的肿瘤组织[9⁃12],也有取用腹水中的卵巢癌细胞[13]。早期发表的文献中有先将组织培养成卵巢癌原代细胞系再种至Matrigel里培养成类器官,但这种方法近年未见采用[14⁃15]。类器官的鉴定方法主要依靠与原组织进行HE染色和免疫组化染色对比,有条件还会进行全外显子组测序(WES)[8]。本研究构建了高级别浆液性卵巢癌类器官并使用HE染色和免疫组化染色进行鉴定。培养到第2代的类器官和原肿瘤组织均表现出了腺癌特征,p53、WT⁃1、PAX⁃8和CK7的表达情况也相似,因此初步认为本次构建的卵巢癌类器官在组织和细胞层面可以代表原肿瘤组织。
培养液成分是成功构建类器官至关重要的条件。KESSLER团队针对输卵管上皮细胞(FTE)类器官研发的培养液成分是目前大多数卵巢肿瘤类器官培养的参考基础,包括将输卵管类器官补充有丝分裂原EGF、抑制BMP活性的Noggin、调节旁分泌Wnt信号的Wnt3a和RSPO1、抑制失巢凋亡的ROCK抑制剂、抑制TGF⁃β受体激酶的ALK4/5和FGF⁃10[16]。其他添加在卵巢癌类器官培养液的因子还有A83⁃01(可以抑制TGF⁃β途径)、SB202190(可以抑制MAPK途径、阻止分泌谱系分化)[17]。本课题组成功培养的类器官也添加了上述因子。KESSLER等[16]认为,添加EGF增加了类器官的增殖数量,而添加RSPO1激活增大了类器官的体积,维持了类器官的稳定生长。然而,卵巢癌类器官与正常组织类器官关于Wnt信号通路的作用反应不同。活跃的Wnt信号传导保留了正常输卵管上皮类器官的干性,且在类器官培养中被认为是传代培养的重要成分[16]。而与之相反,HOFFMANN等[11]在构建卵巢高级别浆液性癌类器官时发现其干性的维持受益于低Wnt信号和活跃的BMP信号,激活Wnt通路会抑制其生长。由此可见,Wnt信号通路在卵巢癌类器官生长中的作用还存在争议。
在国内鲜见培养卵巢肿瘤类器官的情况下,本研究参考国外已发表的研究成果,成功构建出与原肿瘤在组织和形态上相似的卵巢癌类器官,初步证实了这些方法的可行性,但是也还有许多问题有待改进,其中传代就是一大挑战。经分析,001号与002号的类器官均因传代后无法存活而构建失败,可能由于操作时酶解消化过度导致。此外,类器官培养成适用于实验模型也还有许多问题需要解决,如类器官在培养过程易受不同程度的正常细胞污染,低肿瘤纯度可以影响类器官衍生效率,以及类器官与组织之间的基因组相关性[9]。由于类器官在三维培养下生长存在一定的边缘效应,即处于基质胶外围的类器官一般尺寸较大,而处于基质胶中间的尺寸偏小,这些异质性给高通量类器官细胞数定量及尺寸统计分析带来了一定困难[18]。还值得注意的是,本研究中由于用于包埋的类器官已经是从基质胶中解离出的细胞团块,包埋制片难度大,成片体现出的组织结构较扁平松散且有基质胶残留,这为组织鉴定带来了一定难度。为了促进类器官更加稳定的培养,本团队今后将从取材部位、细胞分离、培养液成分、基质胶成分、包埋切片等方面进一步完善卵巢癌类器官的培养和标本制备方法,使卵巢癌类器官能大规模培养和广泛鉴定,为类器官应用于卵巢肿瘤研究打下更坚实的基础。

