LncRNA SNHG1靶向miR⁃101⁃3p调控胃癌细胞奥沙利铂耐药性
卞伟钢 陈平 周小宁 陈海婷 宋曙
胃癌是常见的消化系统恶性肿瘤,化疗是晚期胃癌患者的主要治疗方式,但有效率仅为40%,其中化疗药物耐药是影响疗效的主要原因之一[1⁃2]。因此,深入研究胃癌的耐药机制,有助于提高癌细胞对药物的敏感性,从而提高疗效。长链非编码RNA(lncRNA)是长度超过200 nt的非编码核苷酸片段。既往研究显示lncRNA异常表达与肿瘤发生及耐药性有关[3]。其中有研究报道长链非编码(lncRNA)核仁小RNA宿主基因 l(small nucleolar RNA host gene l,SNHGl)通过调控DNA甲基转移酶1(DNMT1)促进胃癌细胞增殖[4]。也有研究发现 miR⁃101⁃3p 在调控肿瘤细胞增殖、凋亡、迁移和分化中发挥重要作用,其异常表达与肿瘤耐药性有关[5]。FAN等[6]在胰管腺癌中过表达miR⁃101⁃3p发现能抑制核糖核酸还原酶M1(RRM1)表达,提高细胞对吉西他滨的敏感性。在非小细胞肺癌中上调lncRNA SNHG1表达可抑制miR⁃101⁃3p表达,激活Wnt/β⁃catenin信号通路从而参与非小细胞肺癌进展[7⁃8]。奥沙利铂(OXA)是胃癌化疗的主要组成药物之一,但目前胃癌奥沙利铂耐药的机制尚未清楚。本研究探讨lncRNA SNHG1对人胃癌细胞BGC⁃823奥沙利铂耐药性的影响及其是否通过靶向调控miR⁃101⁃3p发挥作用,以期为胃癌奥沙利铂耐药性提供新的研究方向。
1 材料与方法
1.1 主要材料与试剂
人胃癌细胞BGC⁃823购于中国科学院细胞库;奥沙利铂购自江苏恒瑞制药有限公司;si⁃SNHG1和si⁃NC由Thermo公司设计并合成;Trizol试剂、LipofectamineTM2000、双荧光素酶检测试剂盒购自美国Invitrogen公司;SNHG1、miR⁃101⁃3p、人类多药耐药基因(multi⁃drug resistance gene 1,MDR1)、U6、β⁃actin引物序列由上海生工生物工程有限公司设计并合成;RIPA裂解液、BCA试剂盒、ECL试剂盒、HRP标记羊抗兔IgG抗体等均购自上海碧云天生物技术有限公司;噻唑蓝(MTT)试剂盒、Annexin V/PI细胞凋亡试剂盒购自美国Invitrogen 公司;兔抗人P⁃gp、MRP、β⁃actin单克隆抗体购自美国Abcam公司。
1.2 细胞培养与转染
人胃癌耐药细胞株BGC⁃823/OXA由本实验前期建立。BGC⁃823/OXA细胞接种于10%胎牛血清的DMEM培养基中,在37℃、5% CO2培养箱中培养,待细胞生长至对数期时,按照LipofectamineTM2000试剂盒说明书进行转染。耐药细胞BGC⁃823/OXA分别转染SNHG1干扰RNA(si⁃SNHG1组)和阴性对照si⁃NC(si⁃NC组),空白对照组(Control组)不做转染处理。转染4 h后,更换新鲜培养基继续培养48 h,加入2 mg/mL Puromycin进行阳性克隆筛选。
1.3 BGC⁃823/OXA细胞对奥沙利铂的半数抑制浓度
收集si⁃SNHG1组和si⁃NC组对数生长期细胞,调整细胞浓度接种至96孔板中,每孔加入终浓度为1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L的奥沙利铂,同时设置DMSO对照孔。培养48 h,每孔加入10 μL的MTT液,孵育4 h后再加入150 μL的DMSO溶液终止培养。用酶标仪检测490 nm处的光密度(OD)值,绘制生长曲线,计算奥沙利铂的半数抑制浓度(IC50)。
1.4 RT⁃qPCR实验检测lncRNA SNHG1、miR⁃101⁃3p及MDR1 mRNA表达水平
根据RNA提取试剂盒,提取各组细胞中的总RNA,合成cDNA后进行PCR扩增。反应体系共15 μL:上下游引物各 1.5 μL,cDNA 模板 0.5 μL,SYBR Primix Ex TaqTM 8 μL,ddH2O补充至15 μL;PCR反应条件:95℃变性30 s,60℃退火45 s,72℃延伸10 s,进行38个循环。miR⁃101⁃3p以U6为内参,lncRNA SNHG1、MDR1以β⁃actin为内参,采用2-△△Ct法计算目的基因相对表达量。引物序列见表1。

表1 引物序列Tab.1 The primer sequences
1.5 MTT法检测细胞增殖能力
转染si⁃NC、si⁃SNHG1后的BGC⁃823/OXA细胞分别用 10 μmol/L奥沙利铂处理,记为si⁃NC+OXA 组、si⁃SNHG1+OXA组,以不加奥沙利铂的DMSO溶液作为空白对照组。以每孔5×104个细胞接种于96孔板中,培养24 h后,每孔加入10 μL的MTT溶液,孵育4 h,再加入150 μL的DMSO溶液终止培养。用酶标仪检测490 nm处的光密度(OD)值,并计算细胞存活率。细胞存活率(%)=(实验组OD/空白对照组OD)×%。
1.6 流式细胞术检测细胞凋亡能力
si⁃NC+OXA组和si⁃SNHG1+OXA组细胞分别接种于96孔板中培养24 h后,每孔加入5 μL的Annexin⁃V⁃FITC和10 μL的PI,室温避光孵育30 min后,流式细胞仪检测细胞凋亡情况。
1.7 Western blot检测P⁃gp、MRP蛋白的表达水平
收集各组细胞,提取总蛋白并检测蛋白浓度,取10 μg蛋白经电泳、转膜、封闭后,加入一抗P⁃gp、MRP和β⁃actin(稀释浓度均为1∶500),4 ℃孵化过夜;次日加入HRP标记二抗(稀释浓度为1∶200),室温孵育1 h,使用ECL试剂盒暗室曝光显影,分析蛋白条带灰度值。
1.8 双荧光素酶报告基因检测实验
用 starBase v2.0(http://starbase.sysu.edu.cn/star⁃base2/browseNcRNA.php)预测到 lncRNA SNHG1和miR⁃101⁃3p有靶标位点,根据GeneBank中人SNHG1 3′UTR序列设计引物,PCR扩增后,将片段整合到pMIR⁃REPORTTM Luciferase质粒中,获得 SNHG1 3′UTR⁃荧光素酶报告载体 SNHG1⁃wt和 SNHG1⁃mut质粒。BGC⁃823细胞培养24 h 后,取上述质粒0.5 μg,分别与 miR⁃101⁃3p⁃mimics、miR⁃101⁃3p⁃NC 共转染BGC⁃823 细胞 24 h,分为 SNHG1⁃wt+miR⁃101⁃3p⁃NC组、SNHG1⁃wt+miR⁃101⁃3p⁃mimics组、SNHG1⁃mut+miR⁃101⁃3p⁃mimics组和 SNHG1⁃mut+miR⁃101⁃3p⁃NC组,根据说明书制备细胞提取物,测定各组荧光素酶活性。
1.9 统计学方法
采用SPSS 22.0软件进行数据分析,计量资料以均数±标准差(x±s)描述,多组间比较使用单因素方差分析,进一步两组间比较采用SNK⁃q检验,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 BGC⁃823/OXA细胞中lncRNA SNHG1和miR⁃101⁃3p的表达
RT⁃qPCR 实验结果显示,与BGC⁃823细胞相比,耐药细胞BGC⁃823/OXA中lncRNA SNHG1表达水平升高(1.97±0.21vs1.03±0.18,P<0.001),miR⁃101⁃3p表达水平降低(0.54±0.07vs0.96±0.10,P<0.001),见图1。

图1 RT⁃qPCR实验检测BGC⁃823/OXA细胞中lncRNA SNHG1、miR⁃101⁃3p的表达水平Fig.1 Expression of lncRNA SNHG1,miR⁃101⁃3p in BGC⁃823/OXA cells detected by RT⁃qPCR
2.2 转染si⁃SNHG1后BGC⁃823/OXA细胞中奥沙利铂的IC50
si⁃SNHG1转染BGC⁃823/OXA 细胞24 h后,奥沙利铂的IC50为10 μmol/L,低于si⁃NC组的IC50(22 μmol/L),见图2。故采用10 μmol/L奥沙利铂进行后续实验。

图2 不同浓度奥沙利铂对BGC⁃823/OXA细胞活性的影响Fig.2 Effect of different concentrations of oxaliplatin on the viability of BGC⁃823/OXA cells
2.3 RT⁃qPCR实验鉴定BGC⁃823/OXA细胞转染效果
与Control组和si⁃NC组相比,si⁃SNHG1组lncRNA SNHG1(0.47±0.09vs1.13±0.19,P<0.001;0.47±0.09vs1.01±0.16,P<0.001)、MDR1(0.52±0.08vs1.05±0.13,P<0.001;0.52±0.08vs0.98±0.11,P<0.001)表达水平降低,miR⁃101⁃3p表达水平升高(2.15±0.22vs1.01±0.19,P<0.001;2.15±0.22vs1.04±0.21,P<0.001),见图3。

图3 RT⁃qPCR实验检测BGC⁃823/OXA细胞的转染效果Fig.3 The transfection effect of BGC⁃823/OXA cells detected by RT⁃qPCR
2.4 lncRNA SNHG1与miR⁃101⁃3p的靶向关系验证
starBase数据库预测显示,lncRNA SNHG1与miR⁃101⁃3p 3′UTR区有结合位点,见图4A。双荧光素酶报告基因检测结果显示,SNHG1⁃wt+miR⁃101⁃3p⁃mimics组荧光素酶活性低于SNHG1⁃wt+miR⁃101⁃3p⁃NC组(0.21±0.06vs0.88±0.09,P<0.001),见图4B。表明lncRNA SNHG1与miR⁃101⁃3p存在靶向关系。

图4 LncRNA SNHG1与miR⁃101⁃3p的靶向关系Fig.4 Targeting relationship between lncRNA SNHG1 and miR⁃101⁃3p
2.5 敲减SNHG1对BGC⁃823/OXA细胞增殖能力的影响
MTT 实验结果显示,与 si⁃NC组相比,si⁃SNHG1组BGC⁃823/OXA细胞存活率降低[(85.42±1.78)%vs(97.35±1.26)%,P<0.001];与 si⁃NC+OXA 组相比,si⁃SNHG1+OXA 组BGC⁃823/OXA细胞存活率降低[(47.25±1.24)%vs(72.36±1.43)%,P<0.001],见图5。
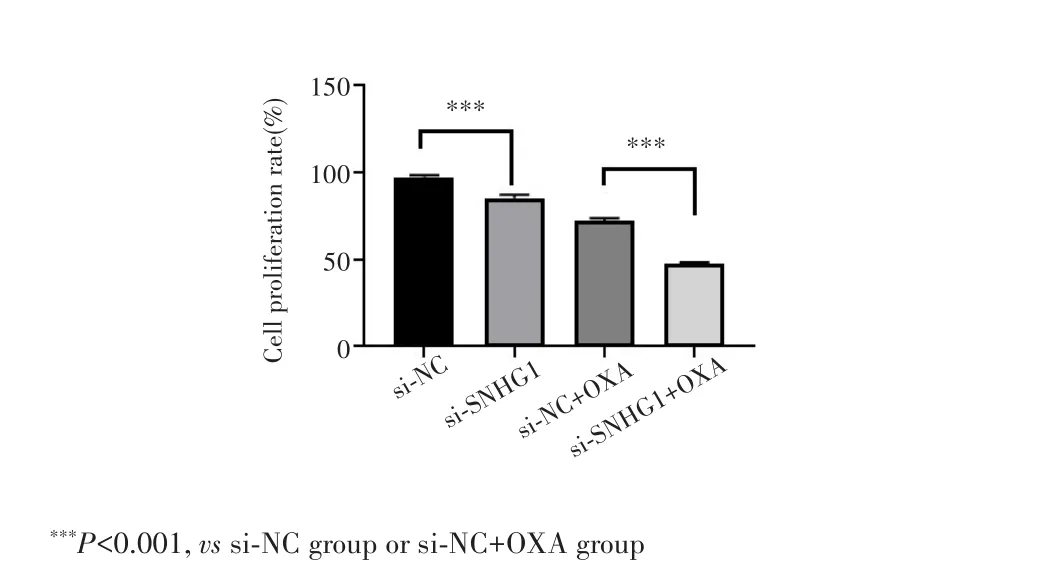
图5 MTT实验检测敲减SNHG1后BGC⁃823/OXA细胞的增殖能力Fig.5 Proliferation ability of BGC⁃823/OXA cells after knocking down SNHG1 detected by MTT assay
2.6 敲减SNHG1对BGC⁃823/OXA细胞凋亡的影响
流式细胞术检测结果显示,si⁃SNHG1组BGC⁃823/OXA细胞凋亡率高于si⁃NC组[(18.41±2.59)%vs(3.56±0.87)%,P<0.001];si⁃SNHG1+OXA 组 BGC⁃823/OXA细胞凋亡率高于si⁃NC+OXA组[(46.72±3.95)%vs(26.58±3.12)%,P<0.001],见图6。

图6 流式细胞术检测敲减SNHG1后BGC⁃823/OXA细胞的凋亡情况Fig.6 Apoptosis of BGC⁃823/OXA cells after knocking down SNHG1 detected by flow cytometry
2.7 敲减SNHG1后BGC⁃823/OXA细胞中P⁃gp、MRP蛋白的表达水平
Western blot检测结果显示,与si⁃NC组比较,si⁃SNHG1组BGC⁃823/OXA细胞中P⁃gp、MRP蛋白表达降低(1.01±0.12vs0.85±0.09,P=0.026;1.12±0.13vs0.95±0.11,P=0.035);与 si⁃NC+OXA 组相比,si⁃SN⁃HG1+OXA组BGC⁃823/OXA细胞中P⁃gp、MRP蛋白表达水平降低(0.98±0.10vs0.62±0.05,P<0.001;1.09±0.12vs0.57±0.08,P<0.001),见图7。

图7 Western blot检测敲减SNHG1后BGC⁃823/OXA细胞中P⁃gp、MRP蛋白的表达Fig.7 Expression of P⁃gp and MRP protein in BGC⁃823/OXA cells after knocking down SNHG1 detected by Western blot
3 讨论
奥沙利铂具有抗癌谱广、溶解性和稳定性良好等优点,常用于晚期胃癌治疗[9]。肿瘤多药耐药是影响胃癌治疗疗效的主要原因之一。既往研究表明lncRNA 参与胃癌耐药[10⁃11]。其中,有研究显示lncRNA SNHG1在结直肠癌、肝癌、胃癌、骨肉瘤等多种肿瘤中异常表达,且SNHG1上调与肿瘤大小、TNM分期和总生存率降低相关[12]。LIU等[13]研究表明,lncRNA SNHG1在胃癌细胞中高表达,且通过调节miR⁃15b/DCLK1/Notch1轴促进胃癌细胞的上皮间质转化。近年研究还发现lncRNA SNHG1与癌细胞耐药有关,如 LI等[14]报道 lncRNA SNHG1通过上调miR⁃21表达激活Akt通路,从而促进肝癌细胞索拉非尼耐药。SHI等[15]发现lncRNA SNHG1在耐顺铂的非小细胞肺癌组织和细胞系中表达上调,SNHG1敲低可抑制非小细胞肺癌细胞增殖、迁移、侵袭及对顺铂的抗性,且可能通过miR⁃140⁃5p/Wnt/β⁃catenin途径促进非小细胞肺癌的顺铂耐药性。本研究发现在胃癌耐药细胞BGC⁃823/OXA中lncRNA SNHG1的表达水平升高,提示SNHG1可能与BGC⁃823细胞耐药有关。si⁃SNHG1转染BGC⁃823/OXA 细胞24 h后,奥沙利铂的IC50约为 10 μmol/L,低于 si⁃NC 组的 IC50,且细胞增殖活性降低,而细胞凋亡率增加,表明敲减SNHG1后BGC⁃823细胞对OXA的敏感性增强。
MDR1定位于第7号染色体的长臂上,而P⁃gp是MDR1编码的转运蛋白,能将药物泵出细胞外,也是肿瘤耐药性标志物[16]。MRP是多药耐药形成的机制之一,也是肿瘤化疗失败的主要原因,而MRP主要通过介导抗癌药物转运形成耐药[17]。本研究发现敲减SNHG1 后 BGC⁃823/OXA 细胞中 MDR1、P⁃gp、MRP表达水平降低,表明敲减SNHG1表达可以降低细胞耐药性。同时敲减SNHG1后的BGC⁃823/OXA细胞使用10 μmol/L奥沙利铂处理,结果细胞存活率及P⁃gp、MRP蛋白表达水平均降低,而细胞凋亡率增加,进一步证实干扰SNHG1表达可降低细胞耐药性。
研究表明miR⁃101⁃3p在大部分肿瘤中低表达,与肿瘤耐药有一定相关性,而在肺癌中过表达miR⁃101⁃3p有助于提高细胞对顺铂的敏感性[18]。SUN等[19]报道在肝癌耐药组织与细胞中miR⁃101⁃3p低表达,且miR⁃101⁃3p可以通过抑制Beclin⁃1介导的自噬增强肝细胞癌细胞对奥沙利铂的敏感性。LI等[20]研究表明,在顺铂耐药膀胱尿路上皮癌(BUC)细胞系(T24/CDDP)和组织中miR⁃101⁃3p表达下调,且与BUC对顺铂的敏感性呈正相关,而miR⁃101⁃3p可能通过靶向沉默EZH2提高BUC对顺铂的敏感性。本研究发现miR⁃101⁃3p在BGC⁃823/OXA细胞中低表达,转染si⁃SNHG1后,BGC⁃823/OXA 细胞中 miR⁃101⁃3p 表达升高,提示 miR⁃101⁃3p与BGC⁃823细胞奥沙利铂耐药性可能有关。经starBase数据库预测,lncRNASNHG1与miR⁃101⁃3p 3′UTR区存在结合位点,且双荧光素酶基因检测报告证实lncRNA SNHG1与miR⁃101⁃3p存在靶向关系,表明lncRNA SNHG1可能通过靶向调控miR⁃101⁃3p表达而参与BGC⁃823/OXA的耐药性。
综上,lncRNA SNHG1在胃癌奥沙利铂耐药细胞中高表达,且可能通过靶向调控miR⁃101⁃3p促进奥沙利铂耐药性。本研究结果为进一步研究胃癌奥沙利铂耐药机制提供了新的思路,lncRNA SNHG1可能是胃癌潜在的分子靶点。

