新型修饰β-淀粉酶酶解淀粉制备高麦芽糖浆工艺
李军瑞,邝宇,黄田,马忠明,梁新红
(河南科技学院食品学院,河南新乡453003)
麦芽糖浆是以优质淀粉为原料,经过液化、糖化、脱色过滤、精制、浓缩而成的一种淀粉糖产品,其主要成分是麦芽糖[1-2].麦芽糖不参与胰岛素代谢,具有较低的吸潮性和较高的保湿型,并且抗结晶性良好,能抑制食品脱水和淀粉老化,延长食品的贮藏期;另外,麦芽糖浆具有甜度适中和营养性高的特点,能较好代替热能食品[3-4],因此,麦芽糖浆被广泛应用在食品和医药行业.
目前,酶法工艺是国内外麦芽糖浆主要采用的生产方式[5-6],酶法制备麦芽糖浆主要有液化酶和糖化酶,其中常见液化酶为α-淀粉酶[7-9],而β-淀粉酶为麦芽糖生产中最重要的糖化酶.目前,工业用β-淀粉酶(1,4-α-D-glucan maltohydrolase,E.C.3.2.1.2)大多都来源于甘薯、大麦等高等植物,甘薯β-淀粉酶和大麦β-淀粉酶在食品行业得到了广泛的应用[10].β-淀粉酶作为外切酶作用于淀粉,产物主要是麦芽糖和β-界限糊精,在食品工业中,玉米、甘薯、马铃薯和木薯淀粉等是很好生产麦芽糖的原料[11].甘薯β-淀粉酶转化淀粉时,产物中的麦芽糖含量多,副产物少,在生产高纯度麦芽糖或结晶麦芽糖方面具有很大优势[12].
作为一种活性蛋白,β-淀粉酶的催化效率极易受到生产环境的影响[13],导致麦芽糖含量下降,并且不利于高麦芽糖浆的生产.目前酶分子化学修饰是提高酶的稳定性、生物活性或者延长酶的半衰期的一种非常有效的手段,Tardioli等[14]将糖化酶中的羧基与乙二胺中的氨基经过化学修饰进行胺化,胺化后的酶保留了良好的活性,而且胺化之后的酶性质非常稳定,其稳定性比水溶性酶提高500倍以上.Xue等[15]利用酸酐基团对菠萝蛋白酶进行修饰,增强了菠萝蛋白酶的热稳定性和耐碱性.酶修饰技术在β-淀粉酶的研究上也有进一步的应用,Daba等[16]用三硝基苯磺酸(TNBS)、mPEG、戊二醛(GA)对小麦β-淀粉酶进行修饰,结果表明,经mPEG修饰后够明显提高酶的活力和热稳定性,但GA只能提高酶的热稳定性;TNBS可以提高酶的活力,但酶稳定性明显降低.本课题组已经研究了甘薯β-淀粉酶经甲氧基聚乙二醇马来酰亚胺(Methoxy polyethylene glycol maleic amide,MPEG-Mal,MW:5000)修饰可以提高酶的催化效率和改善酶的特性,与未修饰甘薯β-淀粉酶比较,获得的新型修饰甘薯β-淀粉酶酶活性由1.733×104U/mg提高至2.150×104U/mg,提高了(24.06±3.17)%,其热稳定性和pH稳定性也明显提高[17],但还未应用到高麦芽糖浆的生产中.因此将新型修饰β-淀粉酶应用于高麦芽糖浆的生产,以期为新型修饰酶工业化应用提供理论支持.
本文采用高效液相色谱对新型修饰β-淀粉酶酶解产物进行分析,研究添加量、酶解时间、酶解温度及酶解pH对甘薯淀粉制备高麦芽糖浆时麦芽糖产量的影响,并应用新型修饰β-淀粉酶对甘薯淀粉、玉米淀粉、小麦淀粉和马铃薯淀粉进行酶解试验.
1 材料与方法
1.1 试验材料与仪器
1.1.1原料与试剂 甘薯,河南科技学院甘薯试验田;甘薯淀粉、玉米淀粉、小麦淀粉和马铃薯淀粉,新乡市华联超市;耐高温α-淀粉酶,郑州市福源生物科技有限公司;甲氧基聚乙二醇马来酰亚胺,Sigma-Aldrich公司;葡萄糖、麦芽糖、麦芽三糖、麦芽四糖,Sigma-Aldrich公司;乙腈,Sigma-Aldrich公司.
1.1.2主要仪器设备Waters 1525-2414高效液相色谱仪,高效液相色谱系统由Waters 1525 Binary HPLC Pump,Waters 2707自动进样器,Waters 2414示差检测器等组成,美国Water公司;Shodex Asahipak NH2P-50 4E色谱柱,日本Shodex公司.
1.2 试验方法
1.2.1 β-淀粉酶酶活测定方法β-淀粉酶酶活测定参考文献[17].
1.2.2 甘薯β-淀粉酶分离纯化 粗酶液的制备:参考文献[18]的方法制备;β-淀粉酶分离纯化:应用AKTA purifierTM10蛋白质纯化仪,Mono Q阴离子交换层析柱和SuperdexTM75凝胶层析柱,检测波长280 nm条件下进行分离纯化,具体方法及步骤参考文献[19].将出峰位置所对应的收集管中的酶液分别收集,浓缩后冷冻干燥,4℃保存备用.
1.2.3 新型β-淀粉酶制备 新型修饰β-淀粉酶储备液制备参考文献[17]:准确称量50 mg新型修饰β-淀粉酶溶到2.5 mL pH 6.0磷酸氢二钠-柠檬酸缓冲液中4℃储藏备用;新型修饰β-淀粉酶的制备:参考Liang等参考文献[17]的方法.
1.2.4 高麦芽糖浆制备 以淀粉为原料,新型修饰β-淀粉酶酶解淀粉的工艺流程[1]为

按照淀粉与水的比例为1∶3.5~4.0调浆,调整淀粉浆温度90~95℃,加入α-淀粉酶,酶添加量为5 U/g,淀粉浆迅速液化,将淀粉浆降温至60℃,加入一定量的新型修饰β-淀粉酶,按照试验设计保温一定时间,结束糖化,即可获得高麦芽糖浆.
1.2.5 新型修饰β-淀粉酶酶解温度对麦芽糖产率的影响 参考梁新红等[20]的方法,并稍作修改.加入高温α-淀粉酶5 U/g,加入新型修饰β-淀粉酶120 U/g干淀粉,时间16 h,pH为6.0,研究新型修饰β-淀粉酶酶解温度在35、40、45、50、55、60、65和70℃下对麦芽糖含量的影响.
1.2.6 新型修饰β-淀粉酶酶解pH对麦芽糖产率的影响 参考Liang等[17]的方法,并稍作修改.加入高温α-淀粉酶5 U/g,酶解温度为55℃,加入新型修饰β-淀粉酶120 U/g干淀粉,酶解16 h,研究酶解pH在4.5、5.0、5.5、6.0、6.5、7.0、7.5和8.0下麦芽糖含量的影响.
1.2.7 新型修饰β-淀粉酶添加量对麦芽糖产率的影响 依据方法1.2.3,加入5 U/g高温α-淀粉酶,温度55℃,酶解16 h,酶解pH 6.0,研究新型修饰β-淀粉酶添加量为0、30、60、90、120、150、180、210 U/g干淀粉时对麦芽糖含量的影响.
1.2.8 新型修饰β-淀粉酶酶解时间对麦芽糖产率的影响 依据方法1.2.4,加入高温α-淀粉酶5 U/g,酶解温度55℃,加入新型修饰β-淀粉酶120 U/g干淀粉,pH 6.0,研究新型修饰β-淀粉酶酶解时间为0、4、8、12、16、20、24 h时对麦芽糖含量的影响.
1.2.9 正交试验设计 根据单因素试验结果进行正交试验,对新型修饰β-淀粉酶酶解条件进行优化,设计酶解温度、酶解pH、酶添加量及酶解时间对酶解甘薯淀粉的麦芽糖含量影响的正交试验优化.
1.3 分析方法
HPLC法测定酶解产物中糖含量[21]:分别称取0.1 g的葡萄糖、麦芽糖、麦芽三糖、麦芽四糖,用流动相(70%的乙腈)定容,得到4种糖质量浓度均为5.0 mg/mL的混合糖标准溶液,在4℃下保存.使用流动相将100μL高麦芽糖浆进行稀释,柱温箱内外部温度分别为35℃、30℃.流动相为70%乙腈,经0.45μm滤膜过滤,超声脱气15 min,流速为1 mL/min,进样体积为20μL,用外标法定量检测4种标准溶液的糖含量.
2 结果与分析
2.1 新型修饰β-淀粉酶酶解可溶性淀粉产物的HPLC分析
依据方法1.3,在色谱分析条件下,采用HPLC对糖标准样品和新型修饰β-淀粉酶酶解产物进行分析,结果如图1和图2所示.

图1 糖标准样品的HPLC图谱Fig.1 HPLCspectrum of standard saccharides
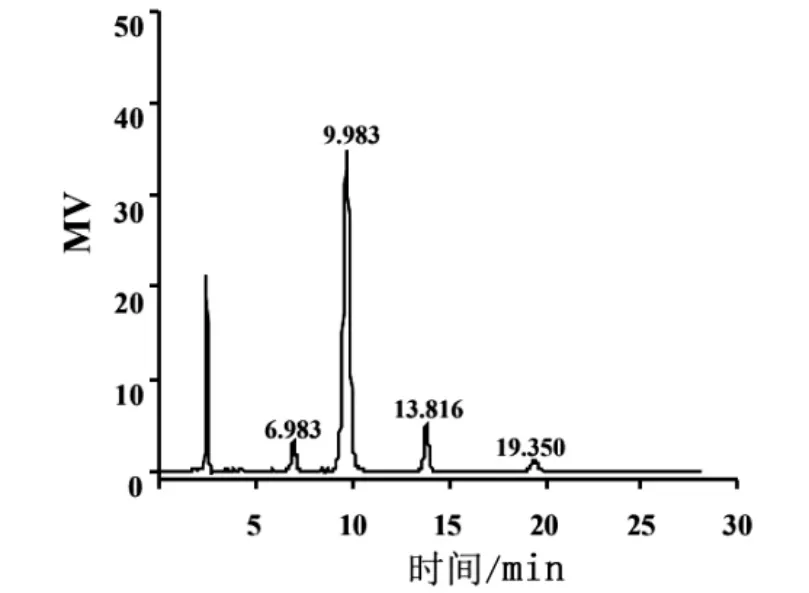
图2 新型修饰β-淀粉酶酶解可溶性淀粉产物的HPLC图谱Fig.2 HPLC spectrum of soluble starch hydrolysates by novel modifiedβ-amylase
由图2可知,新型修饰β-淀粉酶酶解可溶性淀粉酶解产物色谱图中出现4个吸收峰,与图1标准样品色谱图对比分析,得到新型修饰β-淀粉酶酶解淀粉产物的峰保留时间与糖标准品峰保留时间基本一致.采用HPLC外标法计算酶解产物中糖的含量,结果见表1.

表1 新型修饰β-淀粉酶酶解可溶性淀粉产物分析Tab.2 Analysis of hydrolysates of soluble starch by novel modifiedβ-amylase %
由表1可知,新型修饰β-淀粉酶酶解可溶性淀粉产物中低聚糖主要为麦芽糖、麦芽三糖、麦芽四糖、葡萄糖及其他聚合度糊精,其中麦芽糖质量分数高达(83.51±4.38)%,聚合度5以上的糊精仅为(4.53±0.17)%.研究结果与陈松玲等[21]对β-淀粉酶酶解甘薯淀粉、小麦淀粉、玉米淀粉和马铃薯淀粉等酶解产物中糖量测定结果相近.
2.2 新型修饰β-淀粉酶酶解淀粉制备高麦芽糖浆单因素试验研究
2.2.1 新型修饰β-淀粉酶酶解温度对麦芽糖产率的影响 依据方法1.2.5,研究新型修饰β-淀粉酶酶解温度对甘薯淀粉酶解产物中麦芽糖含量的影响,结果如图3所示.
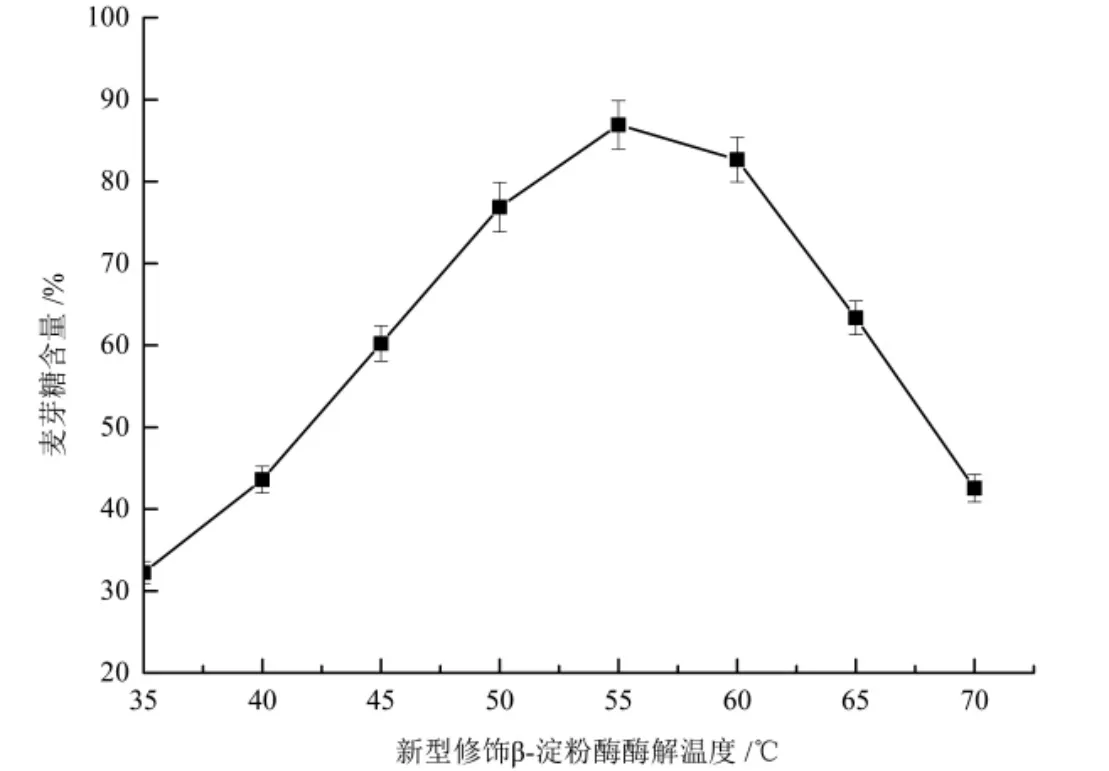
图3 新型修饰β-淀粉酶酶解温度对麦芽糖产率的影响Fig.3 Effects of enzymatic hydrolysis temperature of novel modifiedβ-amylase on maltose yield
由图3可知,随着新型修饰β-淀粉酶酶解温度的升高,麦芽糖含量不断增加,当新型修饰β-淀粉酶酶解温度在55℃时,麦芽糖质量分数达到最大值(86.92±2.93)%;当新型修饰β-淀粉酶酶解温度继续升高时,麦芽糖含量显著降低,酶解温度达70℃时,麦芽糖质量分数仅为(42.56±1.68)%.因此,新型修饰β-淀粉酶的最佳温度为55℃.
2.2.2 新型修饰β-淀粉酶酶解pH对麦芽糖产率的影响 依据方法1.2.6,研究新型修饰β-淀粉酶酶解pH对甘薯淀粉酶解产物中麦芽糖含量的影响,结果如图4所示.

图4 新型修饰β-淀粉酶酶解pH对麦芽糖产率的影响Fig.4 Effects of enzymatic hydrolysis pH of novel modifiedβ-amylase on maltose yield
由图4可知,随着新型修饰β-淀粉酶酶解pH的升高,麦芽糖含量逐渐增加,当新型修饰β-淀粉酶酶解pH在6.0时,麦芽糖质量分数达到最大值(88.36±3.15)%;随着新型修饰β-淀粉酶酶解pH继续升高,麦芽糖含量逐渐降低,当酶解pH升至8.0时,麦芽糖质量分数仅为(27.62±1.14)%.因此,新型修饰β-淀粉酶的最佳pH为6.0.
2.2.3 新型修饰β-淀粉酶添加量对麦芽糖产率的影响 依据方法1.2.7,研究新型修饰β-淀粉酶添加量对甘薯淀粉酶解产物中麦芽糖含量的影响,结果如图5所示.

图5 新型修饰β-淀粉酶添加量对麦芽糖产率的影响Fig.5 Effects of amylase addition of novel modifiedβ-amylase on maltose yield
由图5可知,新型修饰β-淀粉酶酶解甘薯淀粉,添加量在0~120 U/g时,随着新型修饰β-淀粉酶添加量的增加,酶解产物中麦芽糖的质量分数从(14.33±0.85)%增加到(85.73±3.03)%,新型修饰β-淀粉酶添加量大于120 U/g时,酶解产物麦芽糖含量没有显著性差异(P<0.05).因此,新型修饰β-淀粉酶的最佳加酶量为120 U/g.
2.2.4 新型修饰β-淀粉酶酶解时间对麦芽糖产率的影响 依据方法1.2.8,考察新型修饰β-淀粉酶酶解时间对甘薯淀粉酶解产物中麦芽糖含量的影响,结果如图6.

图6 新型修饰β-淀粉酶酶解时间对麦芽糖产率的影响Fig.6 Effects of enzymatic hydrolysis time of novel modifiedβ-amylase on maltose yield
由图6可知,新型修饰β-淀粉酶酶解甘薯淀粉,酶解时间在0~16 h时,麦芽糖质量分数从(14.33±0.85)%增至(86.17±2.56)%,继续增加新型修饰β-淀粉酶酶解时间,麦芽糖质量分数没有明显变化.根据方差显著性分析,新型修饰β-淀粉酶酶解时间在16~28 h时麦芽糖质量分数没有显著性差异(P<0.05).因此,新型修饰β-淀粉酶酶解甘薯淀粉的最佳时间为16 h.
2.3 正交试验结果分析
根据单因素试验结果进行正交试验,采用正交试验设计考察新型修饰β-淀粉酶酶解温度、酶解pH、酶添加量及酶解时间四种因素对甘薯淀粉水解效果的影响,以麦芽糖含量为指标,新型修饰β-淀粉酶酶解甘薯淀粉试验设计见表2.

表2 新型修饰β-淀粉酶酶解甘薯淀粉因素水平表Tab.1 The level table of starch factors in enzymatic hydrolysis of sweet potato by novel modifiedβ-amylase
正交试验结果及分析见表3.

表3 新型修饰β-淀粉酶酶解甘薯淀粉正交试验结果分析Tab.3 Analysis of orthogonal experiment results of enzymatic hydrolysis of sweet potato starch with novel modifiedβ-amylase
由表3分析可知,影响麦芽糖含量因素的主次顺序为:B>A>C>D,即新型修饰β-淀粉酶的酶解pH>酶解温度>酶添加量>酶解时间.根据正交试验结果,酶解pH对麦芽糖含量的影响最大,酶解时间对麦芽糖含量的影响最小.因素最佳组合为A2B2C3D2,即新型修饰β-淀粉酶酶解pH为6.0,酶解温度为55℃,加酶量为150 U/g,酶解时间为16 h.对新型修饰β-淀粉酶酶解甘薯淀粉正交试验结果进行进一步方差分析,结果见表4.

表4 新型修饰β-淀粉酶酶解甘薯淀粉正交试验结果方差分析Tab.4 Variance analysis of orthogonal experiment results of enzymatic hydrolysis of sweet potato starch by novel modifiedβ-amylase
由表4可知,新型修饰β-淀粉酶酶解温度、酶解pH及酶添加量对麦芽糖含量有显著性差异,表明这三个因素对麦芽糖含量影响较大.
综上所述,新型修饰β-淀粉酶酶解甘薯淀粉最佳参数:酶解pH为6.0,酶解温度为55℃,加酶量为150 U/g,酶解时间为16 h.
2.4 验证试验
按照上述试验得到的最佳参数,平行进行三次试验,测得麦芽糖质量分数分别为(89.02±3.23)%,(89.11±3.34)%,(88.98±3.29)%,3次测得的平均值为(89.04±3.29)%.表明该参数可行.
2.5 新型修饰β-淀粉酶和甘薯β-淀粉酶酶解酶解淀粉效果比较
为对比新型修饰酶的酶解效果,分别应用新型修饰β-淀粉酶和未修饰的甘薯β-淀粉酶酶解甘薯淀粉、玉米淀粉、小麦淀粉制备高麦芽糖浆.酶解条件为:高温α-淀粉酶添加量5 U/g,酶解温度55℃,酶解pH 6.0,新型修饰β-淀粉酶和甘薯β-淀粉酶添加量均为150 U/g,酶解时间均为16 h.酶解产物中麦芽糖含量测定结果见表5.

表5 新型修饰β-淀粉酶和甘薯β-淀粉酶酶解淀粉产生麦芽糖含量比较Tab.5 Comparison of maltose content produced by enzymatic hydrolysis of starch by novel modifiedβ-amylase and sweet potato β-amylase
由表5可知,应用新型修饰β-淀粉酶和未修饰甘薯β-淀粉酶在相同条件下分别酶解甘薯淀粉、玉米淀粉、小麦淀粉和马铃薯淀粉,新型修饰β-淀粉酶的酶解效率均显著高于未修饰甘薯β-淀粉酶(P<0.05).梁新红等[20]研究了甘薯β-淀粉酶酶解甘薯淀粉条件,即加酶量200 U/g,酶解时间28 h时,酶解产物中麦芽糖质量分数(73.29±5.22)%,本研究中将新型修饰β-淀粉酶应用于甘薯淀粉酶解,酶添加量减少了50 U/g,酶解时间缩短了12 h,但麦芽糖含量提升了17.69%;同时,梁新红等[20]在应用甘薯β-淀粉酶和新型修饰β-淀粉酶酶解玉米淀粉时也获得了类似的结果.因此,应用新型修饰β-淀粉酶酶解甘薯淀粉,不仅减少了酶的用量,提高了酶解效率,而且提高了酶解产物中麦芽糖含量.
同时,由表5也可以看出,新型修饰β-淀粉酶对甘薯淀粉和小麦淀粉的酶解效率高于玉米淀粉和马铃薯淀粉,这可能与不同植物淀粉的聚合度和结晶度不同有关,其机理有待于进一步探究.
3 结论
新型修饰β-淀粉酶酶解甘薯淀粉时,酶解产物中的糖主要为麦芽糖,其质量分数达80%以上.通过单因素和正交试验可知,新型修饰β-淀粉酶酶解淀粉最优参数为:酶解pH 6.0,酶解温度55℃,酶添加量150 U/g,酶解时间16 h.在最佳酶解条件下,新型修饰β-淀粉酶酶解甘薯淀粉的麦芽糖质量分数为(89.04±3.29)%,与未修饰酶相比,麦芽糖含量提高了31.21%.应用新型修饰酶生产高麦芽糖浆,减少了酶的用量,降低了生产成本,提高了酶解效率,为工业化提高麦芽糖浆生产效率及降低成本提供理论及实践依据.

