天然来源的二酰甘油酰基转移酶抑制剂的研究进展
熊大玺,崔 龙
天然来源的二酰甘油酰基转移酶抑制剂的研究进展
熊大玺,崔 龙*
北华大学药学院,吉林 吉林 132000
二酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)是三酰甘油合成最后一步的催化酶,也是唯一的限速酶。该酶与脂肪代谢、脂类在组织中沉积有很大关系。天然产物因其存在许多结构新颖,活性强,毒副作用小的化合物成为抑制剂的首选。为了寻找有效的天然来源的DGAT抑制剂,对天然产物中含有较好DGAT抑制活性的化合物种类进行综述。
天然产物;二酰甘油酰基转移酶;构效关系;肥胖;糖尿病
随着当今社会经济的发展,肥胖人群的数量也不断增加[1]。肥胖能诱发多种疾病,如血压升高、血脂异常、心血管并发症、2型糖尿病、脑血管损伤等疾病[2]。虽然人们主观上已经提高了对肥胖的重视,但客观上仍缺少有效措施阻止肥胖进一步流行和发展。尽管市场上出现了各种各样的减肥药物,却因各种不良反应而无法长期服用[3]。因此,迫切地需要一种毒副作用小、效果好、选择性高的调脂药物。
三酰甘油(triglyceride,TG)的合成方式有2种[4]:(1)磷脂酸在磷脂酸磷酸酶作用下,水解释放出无机磷酸转变为二酰甘油(diacylglycerol,DG),在二酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)的作用下酯化生成TG;(2)脂酰辅酶A在单酰基甘油酯酰转移酶作用下酯化生成DG,DG与脂酰辅酶A在DGAT作用下酯化生成TG。无论哪种方式,DGAT都作为TG合成中的唯一限速酶[5]。所以,抑制DGAT活性进而阻止机体合成脂肪成为现在治疗肥胖的首要选择。本文主要对天然来源的DGAT抑制剂的研究进展进行综述。
1 DGAT的作用机制及分类
DGAT是一种微粒体酶,根据其结构、定位的差异可分为4种类型[6]:DGAT1、DGAT2、双功能酶(wax ester synthase,WS/DGAT)和胞质内DGAT(CytoDGAT)。其中DGAT1属于酰基辅酶A-胆固醇酰基转移酶基因家族,DGAT2属于单酰基甘油酯酰转移酶家族。研究发现二者催化相同的酶促反应,并且在脂肪组织、小肠和肝脏中,这2种酶都普遍表达,但不具有任何显著的氨基酸序列相似性[7]。WS/DGAT和CytoDGAT是近几年才发现的亚型,WS/DGAT是一种双功能酶,其主要功能是催化蜡酯的合成,同时也参与少量TG的合成[8]。CytoDGAT是一种可溶性酶,目前在花生等作物中被发现[9]。Conte等[10]研究发现敲除小鼠基因后,小鼠在出生不久后死亡,并且发现基因表达减少50%并不能有效地抑制TG的合成;敲除基因的小鼠仍能正常存活,肠道内还能继续合成TG,但不在组织中沉积[11]。综上所述,抑制TG的合成需要抑制DGAT的活性,而由于DGAT2轻微的抑制作用并不能阻止TG的合成,过度抑制又会产生不良反应,所以抑制DGAT1的活性成为治疗肥胖的一个方向。
2 天然来源的DGAT1抑制剂
2.1 黄酮类
黄酮类的天然产物广泛存在于自然界,Oh等[12]从豆科植物补骨脂Linn.中分离得到了2个黄酮类化合物,分别命名为bavachin(1)和bavachinin(2),2个化合物的半数抑制浓度(median inhibition concentration,IC50)分别为(78.5±1.7)、(80.1±1.3)µmol/L。Yin等[13]分离出了2个黄酮类化合物,分别命名为neo-bavaisoflavone(3)和corylifol A(4),2个化合物的IC50值分别为(94.1±1.4)、(96.2±1.1)μmol/L,化学结构见图1。上述4个化合物均对DGAT1有良好的抑制活性,且对DGAT2均无抑制活性。通过对比化合物1、2发现,化合物2中7′′位的羟基被甲氧基取代,从而导致其活性减弱。化合物4的活性弱于化合物3,原因是化合物4仅比化合物3多了1个异戊烯基,从而降低了其对DGAT1的抑制活性。
2.2 木脂素类
Li等[14]从五加科植物刺五加(Rupr. Maxim. ) Harms.的甲醇提取物中分离得到7个木脂素类化合物,分别命名为(7, 7′,7″,8,8′,8″)-4′,5″-dihydroxy-3,5,3′,4″-tetramethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineo-lignan-7″,9″- diol(5)、(7,7′,7″,8,8′,8″)-4′,3″-dihydroxy-3,5, 3′,5′,4″-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineo-lignan-7″,9″-diol(6)、(7,7″,8,8′,8″)-3′,4″- dihydroxy-3,5,4′,5″-tetramethoxy-7,9′:7′,9-diepoxy- 4,8″-oxy-8,8′-sesquineo-lignan-7″:9″-diol(7)、4′,4″-dihydroxy- 3,5,3′,5′5″-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′- sesquineo-lignan-7″,9″-diol(8)、7″configuration(9)、7″configuration(10)和acanthopanax A(11)。随后测定了这7个化合物的DGAT1抑制活性,化合物5~10的IC50值分别为(74.1±1.2)、(61.1±1.3)、(79.1±1.1)、(82.4±1.5)、(97.1±1.1)、(91.3±1.3)μmol/L,化合物11的IC50>200 μmol/L。化合物5比化合物9、10有更好的DGAT1抑制活性。此外,化合物6表现出比化合物8更好的DGAT1抑制活性,表明R4处的甲氧基在抑制DGAT1活性中起重要作用。化合物7表现出比化合物9、10更强的DGAT1抑制活性,这表明4′-OCH3可以增强这种作用。化合物9、10对DGAT1表现出相似的活性,表明7″的构型对DGAT1的抑制作用较弱。化合物11对DGAT1无明显抑制活性,对DGAT2的IC50值为(93.2±1.2)μmol/L,这可能与呋喃环有关。上述具有DGAT1抑制活性的木脂素类化合物的化学结构见图2。
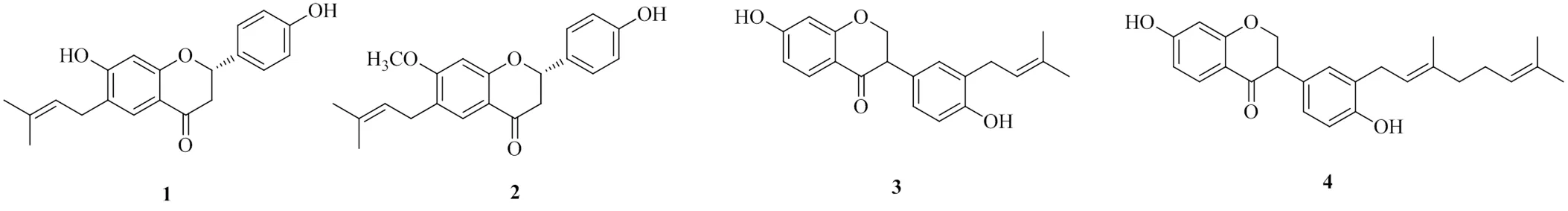
图1 具有DGAT1抑制活性的黄酮类化合物的化学结构
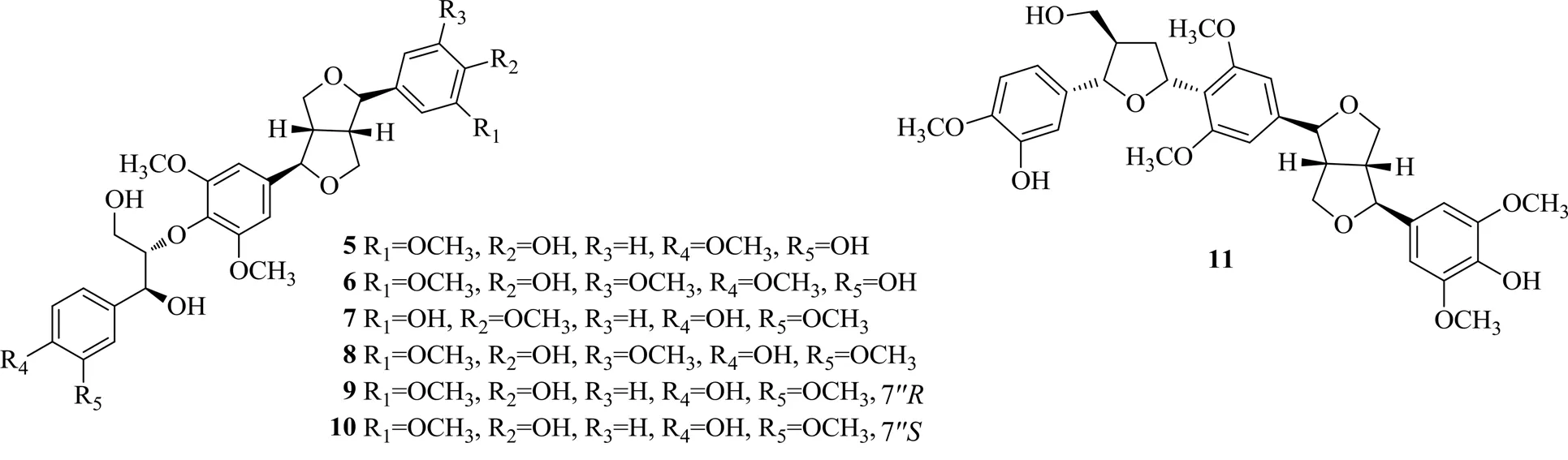
图2 具有DGAT1抑制活性的木脂素类化合物的化学结构
2.3 三萜类
Zhang等[15]在桦木科植物白桦SUK.皮中分离得到10个三萜类化合物,分别命名为lupenone(12)、lupeol(13)、betulinicacid(14)、betulinaldehyde(15)、betulin(16)、3-deoxybetulonicacid(17)、glochidonol(18)、lup-20/29-ene-1β/3β-diol(19)、3α-hydroxylup-20(29)-en-23,28-dioicacid(20)和3α, 11α-dihydroxy-23-oxo-lup-20(29)-en-28-oicacid(21)。用体外DGAT1抑制试验测得这10个化合物的IC50值分别为:>100、>100、(11.2±0.3)、(18.6±0.9)、(38.6±1.2)、(13.2±1.1)、>100、>100、(15.2±0.2)、(20.2±1.5)μmol/L。化合物13在C-28处有甲基取代基,其抑制活性明显低于相同位置取代的羧基、醛基和甲醇基团的化合物14~17。化合物14~17相比,R2的取代基不同,但是化合物14、17、20都有很高的DGAT1抑制活性,表明羟基取代基无明显增DGAT1活性的能力,且R3位置的基团变化无法引起DGAT1抑制活性的改变。上述具有DGAT1抑制活性的三萜类化合物的化学结构见图3。
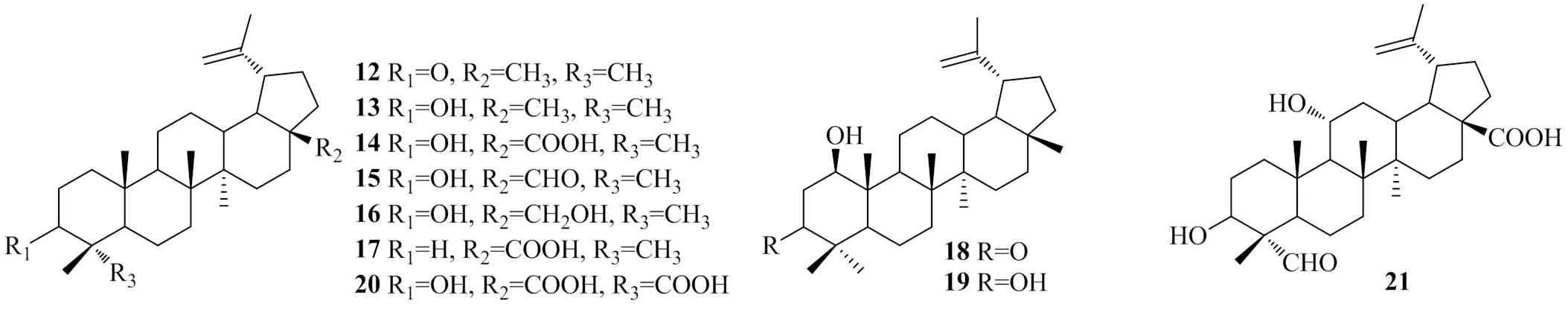
图3 具有DGAT1抑制活性的三萜类化合物的化学结构
2.4 补骨脂酚类
Latha等[16]研究发现补骨脂的乙醇提取物具有抗高血糖和氧化的作用。Wu等[17]和Lin等[18]分别从中分离得到补骨脂酚类化合物,将其命名为12,13-dihydro-12,13-dihydroxybakuchiol(22)和Δ11-12-hydroxy-12-dimethylbakuchiol(23)。体外活性显示,这2个化合物的IC50值分别为(135.1±1.2)、(73.4±1.3)μmol/L。化合物23相比于化合物22有更好的抑制活性,对比结构发现,两者支链尾部的羟基异丙基官能团相同,化合物23少了1个亚甲基碳信号,多了1个C-11处的双键碳信号。说明了羟基异丙基对DGAT1的抑制活性并无太大影响。所以推测是结构中C-11位置上存在双键,可以增强此类化合物对DGAT1的活性。具有DGAT1抑制活性的补骨脂酚类化合物的化学结构见图4。
2.5 香豆素类
Chai[19]从补骨脂的醋酸乙酯提取物中分离纯化得到3个香豆素类化合物,分别命名为bavacoumestan D(24)、bavacoumestan C(25)和bavacoumestan B(26)。测定了这3个化合物对DGAT1的抑制活性,其IC50值分别为(65.2±1.1)、(52.3±1.3)、(116.5±1.2)μmol/L,其中化合物25对DGAT2的IC50值为(154.1±1.5)μmol/L,化合物24、26对DGAT2均无抑制活性。化合物26的抑制活性明显小于化合物25,是由于C-1′′位置的羟基造成的,而这个羟基也对抑制DGAT2的活性起重要作用。具有DGAT1抑制活性的香豆素类化合物的化学结构见图5。
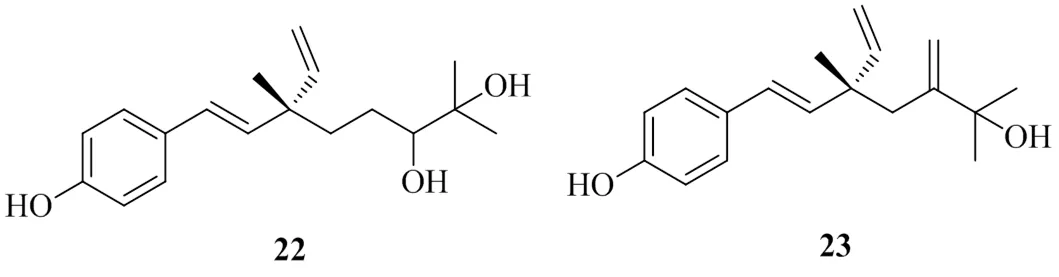
图4 具有DGAT1抑制活性的补骨脂酚类化合物的化学结构
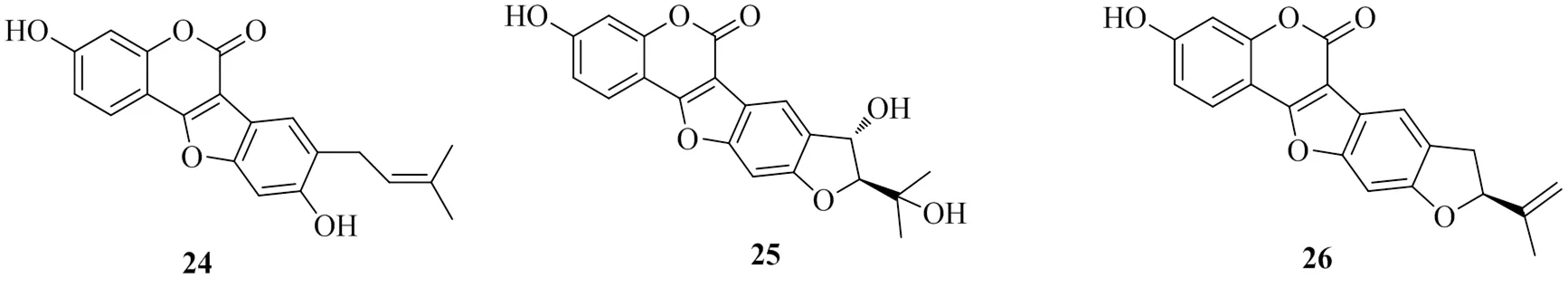
图5 具有DGAT1抑制活性的香豆素类化合物的化学结构
2.6 二萜二聚体类
Liu等[20]从楝科植物大叶山楝(Wall.) R. N. Parker.中分离纯化得到了4个全新的二萜二聚体类化合物。这是从楝科植物中分离出的新的碳骨架的非对映异构体,4个化合物分别命名为aphadilactone A(27)、aphadilactone B(28)、aphadilactone C(29)和aphadilactone D(30)。对这4个化合物进行体外DGAT1活性测试,其中化合物29[IC50为(0.46±0.09)μmol/L]是迄今为止发现的天然产物中活性最强的DGAT1抑制剂,且其对DGAT2抑制活性的IC50>100 μmol/L,无明显抑制活性。Liu等[20]检测了这4个化合物在10 μmol/L下的DGAT1抑制活性,发现化合物27、29分别对DGAT1活性的抑制率为25.5%、85.9%,而其他类似物无明显抑制活性。实验结果也表明,11′构型,对该活性至关重要,且化合物29中的11构型,使DGAT1的抑制活性增加。结构-活性关系分析表明,DGAT1抑制剂的活性结合位点对底物的立体化学具有很高的选择性。具有DGAT1抑制活性的二萜二聚体类化合物的化学结构见图6。
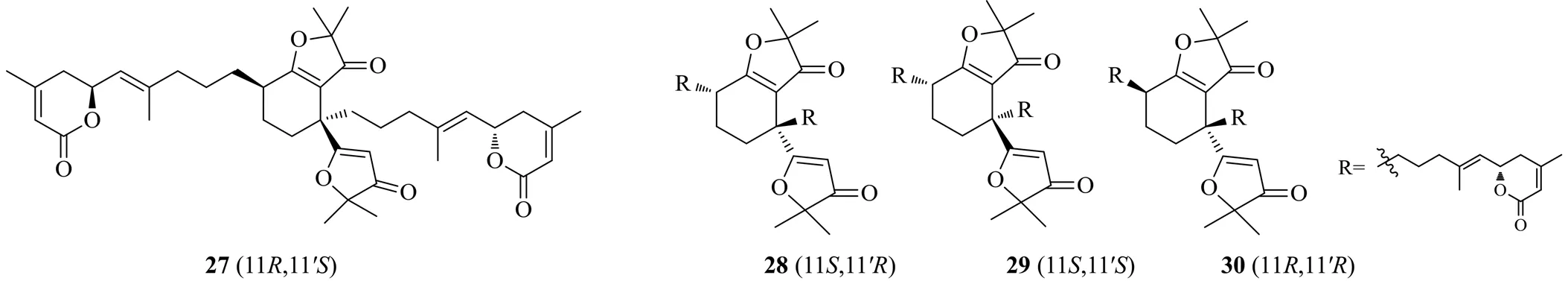
图6 具有DGAT1抑制活性的二萜二聚体类化合物的化学结构
2.7 醌类
Jung等[21]在玉米L.籽粒中分离出了玉米圆斑病菌,在马铃薯蔗糖琼脂平板上培养2周后,用C18固相萃取柱进一步纯化后得到2个醌类化合物,将其命名为cochlioquinone A(31)和cochlioquinone A1(32)。Lee等[22]对这2个化合物进行体外DGAT1活性检测,其IC50值分别为5.6、6.3 μg/mL。观察化合物32的化学位移后,发现它是化合物31的衍生物类似物,C-7上的羰基被取代,这2个化合物都有较好的DGAT1抑制活性,可为治疗肥胖药物的研发提供依据。具有DGAT1抑制活性的醌类化合物的化学结构见图7。
2.8 杂萜类
Lee等[23]从青霉属F1959中分离得到3个杂萜类化合物,分别命名为phenylpyropenes A(33)、phenylpyropenes B(34)和phenylpyropenes C(35)。测得这3个化合物的IC50值分别为(78.7±1.6)、(21.7±0.2)、(11.04±0.2)μmol/L。随后用乙酰辅酶A为底物进行了测定DGAT酶动力学参数的实验,结果表明,与对照组相比,化合物35使最大反应速率分别降低了48%(30 μmol/L)、66%(10 μmol/L)。化合物35的米氏常数(m)为8 μmol/L,抑制常数(i)为10.4 μmol/L,表明化合物35有很强的非竞争抑制性。为了进一步确定化合物35对细胞中TG形成的影响,在完整的细胞分析中使用肝癌HepG2细胞测量了乙酸对细胞脂质的影响。实验结果表明化合物35以剂量相关性地方式抑制乙酸在TG中的掺入,IC50值为(27.8±7.4)μmol/L,且化合物35在10、30 μmol/L时没有显示出细胞毒性。上述具有DGAT1抑制活性的杂萜类化合物的化学结构见图8。
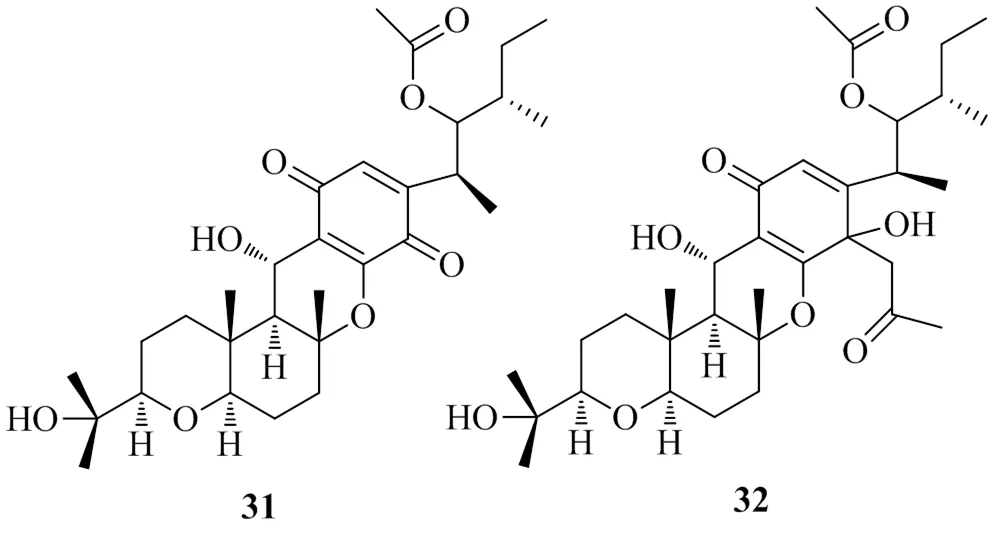
图7 具有DGAT1抑制活性的醌类化合物的化学结构
2.9 聚乙炔类
Lee等[24]使用大鼠肝脏微粒体作为酶源,通过体外实验筛选,发现五加科植物人参C. A. Meyer.根的石油醚提取物对DGAT活性具有相对较强的抑制作用。采用硅胶、中低压制备色谱仪、扫描电镜和反相高效液相色谱法对人参根的石油醚提取物进行了分馏,分离得到了2个聚乙炔类化合物,根据其1H-NMR、13C-NMR和HMBC数据,结构确定为 (9,10)-epoxyheptadecan-4,6-diyn-3-one(36)和1-methoxy-(9,10)-epoxyheptadecan-4,6-diyn-3-one(37)。测得这2个化合物的IC50值分别为9、32 μg/mL。具有DGAT1活性的聚乙炔类化合物见图9。
2.10 酚酸类
Inokoshi等[25]从腐质霉属sp. FO-2942的培养液中分离鉴定了5个三缩酚酸类化合物,分别命名为amidepsines A~E(38~42),其IC50值分别为10.2、19.2、51.6、17.5、124 μmol/L。对比推测,由于R2位置的羟基起作用,当羟基被取代时,该类化合物的抑制活性减弱。上述具有DGAT1活性的酚酸类化合物的化学结构见图10。
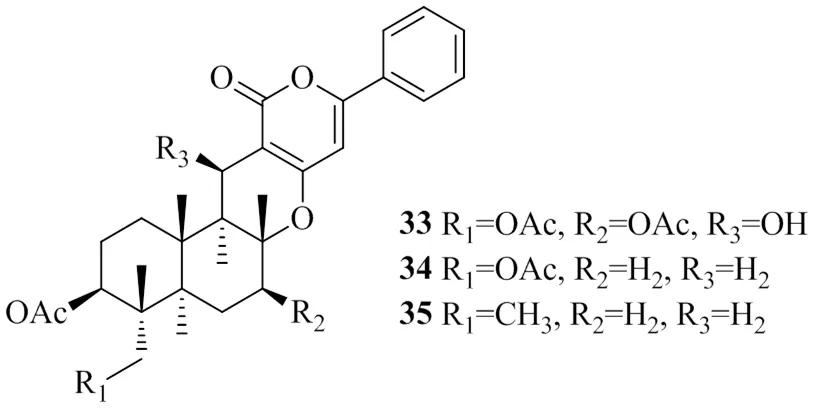
图8 具有DGAT1抑制活性的杂萜类化合物的化学结构
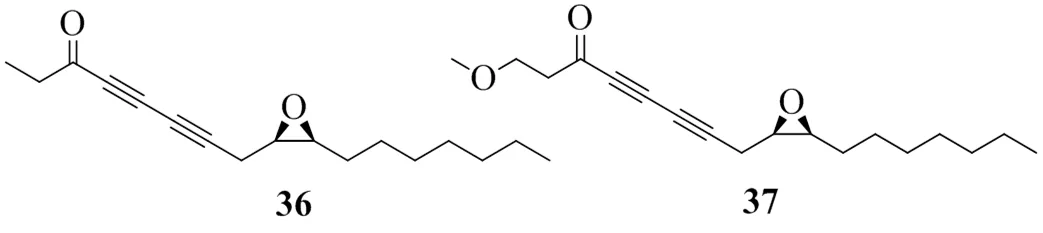
图9 具有DGAT1抑制活性的聚乙炔类化合物的化学结构
2.11 酰胺类
Lee等[26]从双子叶植物胡椒L.中分离出5个酰胺类化合物,分别命名为retrofractamide C(43)、(2,4,8)--[9-(3,4-methylenedioxyphenyl)- 2,4,8-nonatrienoyl]piperidine(44)、pipernonaline(45)、piperrolein B(46)和dehydropipernonaline(47),其IC50值分别为900、(29.8±2.4)、(37.2±3.8)、(20.1±1.5)、(21.2±2.1)μmol/L。这5个化合物都是含有不饱和链的结构,但是化合物43几乎没有DGAT1抑制活性,而化合物44~47具有较好的DGAT1抑制活性。对比发现,它们在支链末端的结构不同,具有异丙基结构的支链活性明显小于具有哌啶结构的化合物。由此可知,对于此类化合物,哌啶结构取代异丙基结构会显著提高其对DGAT1的抑制活性。上述具有DGAT1活性的酰胺类化合物的化学结构见图11。
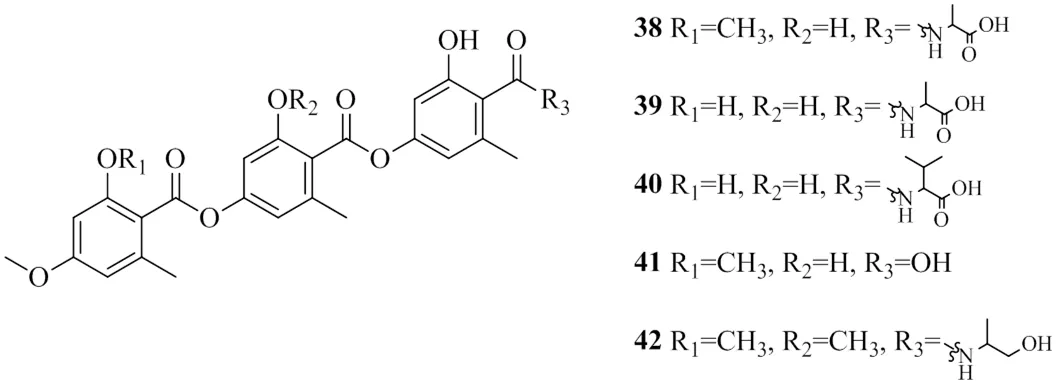
图10 具有DGAT1抑制活性的酚酸类化合物的化学结构
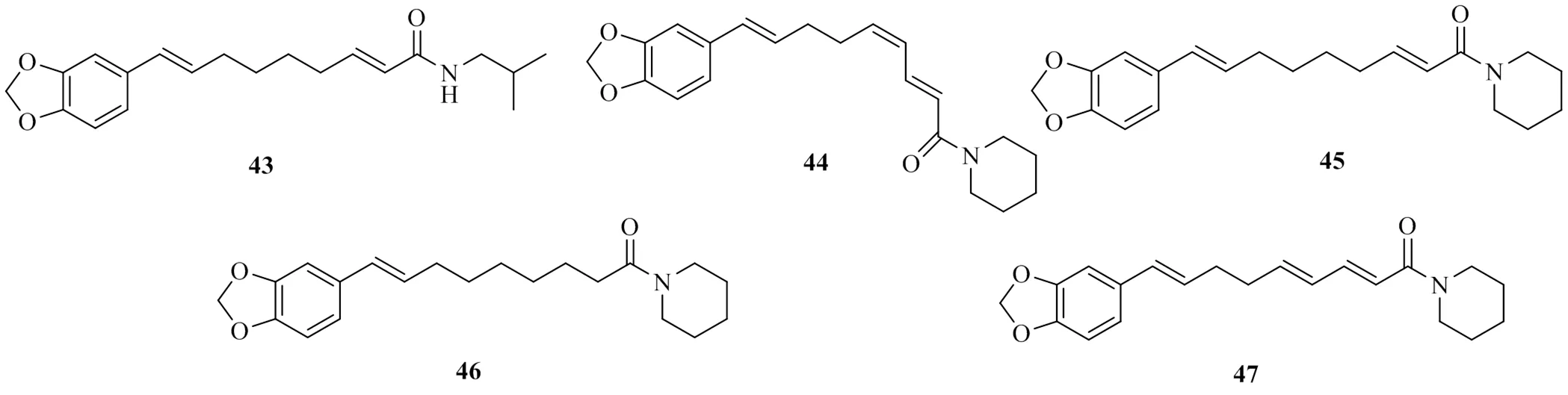
图11 具有DGAT1抑制活性的酰胺类化合物的化学结构
2.12 倍半萜类
Park等[27]在寻找天然的DGAT1抑制剂时发现菊科植物款冬花L.花蕾的乙醇提取物抑制了大鼠肝脏微粒体蛋白酶DGAT1的活性,IC50值为86.2 μg/mL。将其乙醇提取物进行分离纯化,得到4个倍半萜类化合物,分别命名为tussilagonone(48)、tussilagone(49)、7β-(3-ethyl-cis-crotonoyloxy)-1α-(2-methylbutyryloxy)-3,14-dehydro-- notonipetranone(50)和bisabolane-typesesquiterpenoid- 8-angeloyloxy-3,4-epoxy-bisabola-7(14),10-dien-2-one(51)。测定了它们对DGAT1的抑制活性,其IC50值分别为99.2、18.8、47.0、211 μmol/L。对比后发现,化合物49有良好的DGAT1抑制活性。进一步研究化合物49对TG合成的影响,实验发现,化合物49 20、30 μmol/L对细胞TG的合成的抑制率分别为49%、59%。且HepG2细胞在研究浓度下细胞活力没有下降,证明抑制作用并不是细胞毒性导致的。上述具有DGAT1抑制活性的倍半萜类化合物的化学结构见图12。
2.13 苷类
Tabata等[28]从粉红粘帚霉KF-1040的代谢产物中分离出了4个具有DGAT1抑制活性的苷类化合物,分别命名为roselipin 1A(52)、roselipin 1B(53)、roselipin 2A(54)和roselipin 2B(55)。对其进行体外DGAT1活性检测后发现,它们的IC50值分别为17、15、22、18 μmol/L。实验表明,该类化合物在生物体内模拟DG分子与DGAT1相结合从而达到抑制作用。推测此类化合物的DGAT1抑制活性可能跟脂肪酸链和阿拉伯糖醇有关。
Meng等[29]从菊科植物墨旱莲L.中分离得到了6个苷类化合物,根据其1H-NMR,13C-NMR和HMBC数据,分别确定为eprostrata Ⅰ(56)、(5)-trideca-1,5-dien-7,9,11-triyne-3,4-diol-4-β-glucopyranoside(57)、3-β-glucopyranosyl-1-hydroxy-4,6-tetradecene,8,10,12-triyne(58)、2-β-glucosyltrideca-3,11-dien-5,7,9-triyne-1,2,13-triol(59)、2-β--glucosyltrideca-3,11-dien-5,7,9- triyne-1,2-diol(60)和2-β-glucosyltrideca-3,11- dien-5,7,9-triyne-3-1,2-diol(61)。测得其IC50值分别为(93.1±1.2)、(92.4±1.3)、(87.1±1.1)、(81.3±1.3)、(74.4±1.3)、(101.1±1.1)μmol/L,对DGAT2均无抑制活性。上述具有DGAT1活性的苷类化合物的化学结构见图13。
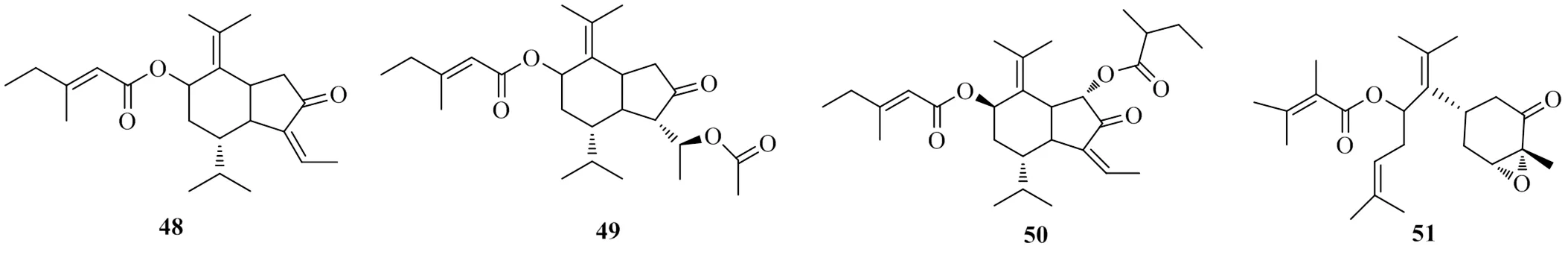
图12 具有DGAT1抑制活性的倍半萜类化合物的化学结构
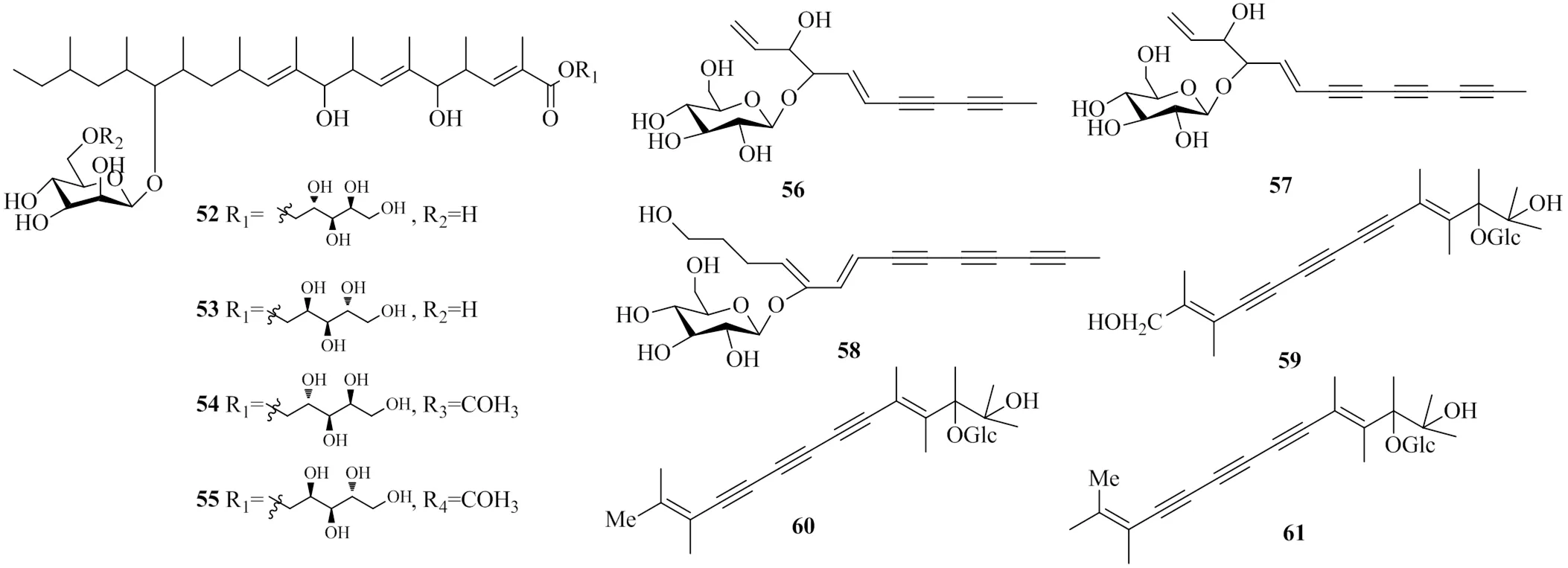
图13 具有DGAT1抑制活性的苷类化合物的化学结构
2.14 噻吩类
Meng等[29]从墨旱莲的甲醇提取物中分离得到了2个噻吩类化合物,通过核磁数据与相关文献对比后,鉴定2个化合物分别为α-terthienylmethanol(62)和α-formylterthienyl(63)。对其进行DGAT1的活性检测,IC50值分别为(89.8±1.4)、(78.4±1.5)μmol/L,且这2个化合物对DGAT2均无抑制活性。具有DGAT1活性的噻吩类化合物的化学结构见图14。
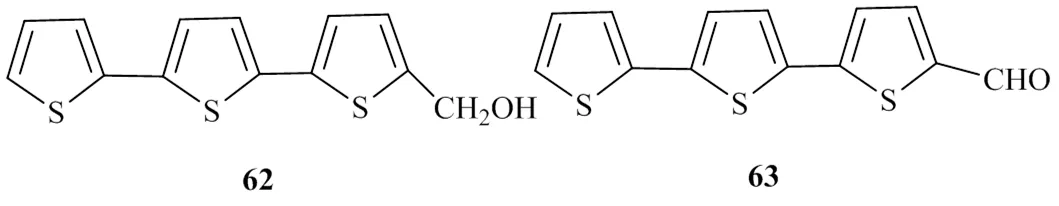
图14 具有DGAT1抑制活性的噻吩类化合物的化学结构
2.15 喹诺酮生物碱类
Ko等[30]在寻找天然的DGAT1抑制剂过程中发现芸香科植物吴茱萸(Juss.) Benth.果实的乙醇提取物能显著地抑制从大鼠肝脏制备的DGAT,对其果实进行分离纯化得到了4种喹诺酮生物碱类化合物,分别命名为1-methyl-2-tetradecyl-4(1)-quinolone(64)、evocarpine(65),1-methyl-2-[(4,7)-4,7-decadienyl]-4(1)-quinolone(66)和1-methyl-2-[(4,9)-6,9-pentadecadienyl]-4(1)- quinolone(67)。研究了这4个化合物对大鼠肝脏DGAT1的抑制作用,发现它们以剂量相关地方式抑制DGAT1活性,其IC50值分别为69.5、23.8、20.1、13.5 μmol/L,对比发现,结构中含有双键比不含双键的化合物抑制活性高,提示该类化合物的DGAT1活性与结构中是否含有双键有关,与双键的位置及数量没有明显的关系。上述具有DGAT1活性的喹诺酮生物碱类化合物的化学结构见图15。
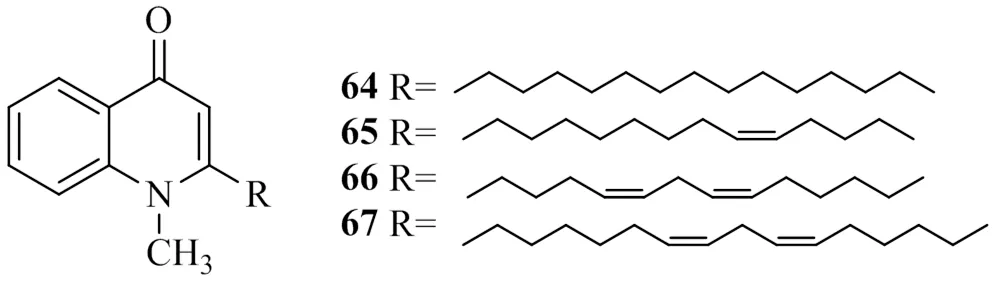
图15 具有DGAT1抑制活性的喹诺酮生物碱类化合物的化学结构
3 结语
天然产物以其生物来源多样、代谢产物复杂多变、毒副作用小和活性强等特点,越来越被学者们关注。植物来源的天然产物中具有DGAT1活性的化合物主要包括黄酮类、萜类、香豆素类和酰胺类等。随着研究的深入,越来越多天然的DGAT1抑制剂不断被开发。DGAT1抑制剂在解决肥胖、治疗高脂血症等方面的功能逐渐被人们完善,为药物的研发提供依据。在研发过程中,还有很多问题需要注意。如DGAT1抑制剂的机制是阻止TG的合成,那么对于非脂肪性摄入导致的肥胖可能会没有药效。其次,如何处理药物的毒性以及药物所带来的不良反应等问题,都值得去思考和解决。尽管面对诸多的挑战,以DGAT1抑制剂为基础研发治疗肥胖药物的前景仍值得期待。
利益冲突 所有作者均声明不存在利益冲突
[1] Grube B, Chong P W, Lau K Z,. A natural fiber complex reduces body weight in the overweight and obese: A double-blind, randomized, placebo-controlled study [J]., 2013, 21(1): 58-64.
[2] Poirier P, Giles T D, Bray G A,. Obesity and cardiovascular disease: Pathophysiology, evaluation, and effect of weight loss [J]., 2006, 26(5): 968-976.
[3] Khera R, Murad M H, Chandar A K,. Association of pharmacological treatments for obesity with weight loss and adverse events: A systematic review and meta-analysis [J]., 2016, 315(22): 2424-2434.
[4] Cases S, Stone S J, Zhou P,. Cloning of DGAT2, a second mammalian diacylglycerol acyltransferase, and related family members [J]., 2001, 276(42): 38870-38876.
[5] 牛永志, 王国平, 郑昀晔, 等. 烟草DGAT基因家族全基因组鉴定与分析 [J]. 中国烟草科学, 2020, 41(1): 1-8.
[6] Orland M D, Anwar K, Cromley D,. Acyl coenzyme A dependent retinol esterification by acyl coenzyme A: Diacylglycerol acyltransferase 1 [J]., 2005, 1737(1): 76-82.
[7] Turchetto-Zolet A C, Maraschin F S, de Morais G L,. Evolutionary view of acyl-CoA diacylglycerol acyltransferase (DGAT), a key enzyme in neutral lipid biosynthesis [J]., 2011, 11: 263.
[8] Li F L, Wu X M, Lam P,. Identification of the wax ester synthase/acyl-coenzyme A: Diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in[J]., 2008, 148(1): 97-107.
[9] Saha S, Enugutti B, Rajakumari S,. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase [J]., 2006, 141(4): 1533-1543.
[10] Conte G, Serra A, Cremonesi P,. Investigating mutual relationship among milk fatty acids by multivariate factor analysis in dairy cows [J]., 2016, 188: 124-132.
[11] Lacasse P, Ollier S, Lollivier V,. New insights into the importance of prolactin in dairy ruminants [J]., 2016, 99(1): 864-874.
[12] Oh K Y, Lee J H, Curtis-Long M J,. Glycosidase inhibitory phenolic compounds from the seed of[J]., 2010, 121(4): 940-945.
[13] Yin S, Fan C Q, Wang Y,. Antibacterial prenylflavone derivatives from, and their structure-activity relationship study [J]., 2004, 12(16): 4387-4392.
[14] Li J L, Li N, Lee H S,. Four new sesqui-lignans isolated fromand their diacylglycerol acyltransferase (DGAT) inhibitory activity [J]., 2016, 109: 185-189.
[15] Zhang N, Li N, Sun Y N,. Diacylglycerol compounds from barks ofwith inhibitory activity against acyltransferase [J]., 2014, 6(2): 164-167.
[16] Latha P G, Evans D A, Panikkar K R,. Immunomodulatory and antitumour properties ofseeds [J]., 2000, 71(3): 223-231.
[17] Wu C Z, Hong S S, Cai X F,. Hypoxia-inducible factor-1 and nuclear factor-κB inhibitory meroterpene analogues of bakuchiol, a constituent of the seeds of[J]., 2008, 18(8): 2619-2623.
[18] Lin X, Li B B, Zhang L,. Four new compounds isolated fromand their diacylglycerol acyltransferase (DGAT) inhibitory activity [J]., 2018, 128: 130-134.
[19] Chai M Y. A new bioactive coumestan from the seeds of[J]., 2020, 22(3): 295-301.
[20] Liu J, He X F, Wang G H,. Aphadilactones A-D, four diterpenoid dimers with DGAT inhibitory and antimalarial activities from a Meliaceae plant [J]., 2014, 79(2): 599-607.
[21] Jung H J, Burm Lee H, Lim C H,. Cochlioquinone A1, a new anti-angiogenic agent from[J]., 2003, 11(22): 4743-4747.
[22] Lee H B, Lim C H, Kwon H J,. Inhibitory activity of diacylglycerol acyltransferase by cochlioquinones A and A1 [J]., 2003, 56(11): 967-969.
[23] Lee S W, Rho M C, Choi J H,. Inhibition of diacylglycerol acyltransferase by phenylpyropenes produced byF1959 [J]., 2008, 18(11): 1785-1788.
[24] Lee S W, Kim K, Rho M C,. New Polyacetylenes, DGAT inhibitors from the roots of[J]., 2004, 70(3): 197-200.
[25] Inokoshi J, Takagi Y, Uchida R,. Production of a new type of amidepsine with a sugar moiety by static fermentation ofsp. FO-2942 [J]., 2010, 63(1): 9-16.
[26] Lee S W, Rho M C, Park H R,. Inhibition of diacylglycerol acyltransferase by alkamides isolated from the fruits ofand[J]., 2006, 54(26): 9759-9763.
[27] Park H R, Yoo M Y, Seo J H,. Sesquiterpenoids isolated from the flower buds ofL. inhibit diacylglycerol acyltransferase [J]., 2008, 56(22): 10493-10497.
[28] Tabata N, Ohyama Y, Tomoda H,. Structure elucidation of roselipins, inhibitors of diacylglycerol acyltransferase produced byKF-1040 [J]., 1999, 52(9): 815-826.
[29] Meng X, Li B B, Lin X,. New polyacetylenes glycoside fromwith DGAT inhibitory activity [J]., 2019, 21(6): 501-506.
[30] Ko J S, Rho M C, Chung M Y,. Quinolone alkaloids, diacylglycerol acyltransferase inhibitors from the fruits ofrutaecarpa [J]., 2002, 68(12): 1131-1133.
Research progress on natural sources of diacylglycerol acyltransferase inhibitors
XIONG Da-xi, CUI Long
College of Pharmacy, Beihua University, Jilin 132000, China
Diacylglycerol acyltransferase (DGAT), the only rate-limiting enzyme, is catalytic enzyme in the last step of triglyceride synthesis which closely related to fat metabolism and lipid deposition in tissues. Many compounds have novel structures, strong activity and low side effects, so natural products are the first choice of inhibitors. In order to find effective natural DGAT inhibitors, the types of compounds with better inhibitory activity in natural products are reviewed in this paper.
natural products; diacylglycerol acyltransferase; structure-activity relationship; obesity; diabetes
R282.71
A
0253 - 2670(2021)13 - 4074 - 08
10.7501/j.issn.0253-2670.2021.13.031
2020-11-02
吉林省科技发展计划项目(20191102056YY)
熊大玺(1996—),男,硕士研究生,主要从事天然药物化学研究。Tel: 13894728078 E-mail: 1440521360@qq.com
崔 龙(1971—),男,教授,博士,主要从事天然药物化学研究。Tel: 18604498621 E-mail: cuilong71@163.com
[责任编辑 崔艳丽]