基于量质传递及化学计量学的药食同源名方青龙白虎汤质量控制研究
陈 姣,王继森,邓晶晶,朱宗萍,廖 婉*,陈 意,杨青松,王 琳,傅超美,朱雅宁, 3*
基于量质传递及化学计量学的药食同源名方青龙白虎汤质量控制研究
陈 姣1,王继森2#,邓晶晶1,朱宗萍1,廖 婉1*,陈 意1,杨青松1,王 琳1,傅超美1,朱雅宁1, 3*
1. 成都中医药大学西南特色中药资源国家重点实验室,药学院,四川 成都 611137 2. 成都市食品药品检验研究院,四川 成都 610045 3. 雅安三九药业有限公司,四川 雅安 625000
建立HPLC指纹图谱检测方法,探寻青龙白虎汤冻干粉制备过程工艺和量质传递规律,并结合化学计量学构建其质量控制体系。制备15批次青龙白虎汤冻干粉,采用HPLC法建立指纹图谱,色谱结果导入《中药色谱指纹图谱相似度评价软件》(2012版)并计算各部分相似度。测定15批样品量质传递过程中没食子酸、原儿茶酸、绿原酸、表儿茶素和鞣花酸的含量,计算转移率和出膏率。结合化学计量学方法进行分析,以挖掘不同产地样品间对质量控制具有显著贡献的主要成分。15批样品指纹图谱相似度均大于0.9,满足规定要求,并标定冻干粉指纹图谱24个共有峰,对其中6种成分进行了指认,分别为没食子酸(1号峰)、原儿茶酸(4号峰)、绿原酸(8号峰)、表儿茶素(14号峰)、东莨菪内酯(19号峰)、鞣花酸(23号峰)。15批冻干粉表儿茶素、没食子酸、鞣花酸、绿原酸、原儿茶酸的质量分数分别为0.724%~1.301%、2.184%~2.840%、0.607%~0.760%、0.061%~0.141%、0.017%~0.079%,转移率分别为78.60%~89.38%、76.98%~89.88%、76.00%~89.78%、76.90%~90.49%、80.02%~90.25%,出膏率为12.87%~15.11%,均未出现离散数据,表明煎煮、浓缩和冻干过程有效成分转移率较稳定。通过化学计量学分析,找到10个对模型贡献较大的成分,其中包括指认的峰14 (VIP=2.812)、峰1(VIP=2.804)、峰23(VIP=2.715)、峰8(VIP=1.053)和峰4(VIP=0.887),可进一步深化青龙白虎汤质量控制研究。通过HPLC指纹图谱结合多指标成分含量测定,首次建立了药食同源名方青龙白虎汤的质量控制方法,此方法快速简单可行,重复性、稳定性良好,能同时适用于饮片、煎煮液、浓缩液和冻干粉量质传递规律的相关性考察;进一步通过化学计量学为青龙白虎汤的质量控制研究提供了重要参考。
青龙白虎汤;量质传递;指纹图谱;化学计量学;没食子酸;原儿茶酸;绿原酸;表儿茶素;鞣花酸;质量控制
青龙白虎汤(Qinglong Baihu Decoction,QBD)出自清代著名医家王孟英《王氏医案》卷二,全方两味。方中青果为主药,具清热解毒、利咽生津之效[1-3];莱菔又名白萝卜,被誉为“蔬中圣品”,具有丰富的营养元素和药用价值,能消食下气、利尿化痰[4-6]、健脾宽中、清热解毒,对于肺热痰火、咳喘痰多、食停不化、脘腹胀满等有很好的疗效。此方为药食两用方,高度契合中医药学自古就有的“药食同源”理论精髓,集预防、保健与治疗等多种应用价值于一身,充分体现了中医药的传统特色,其以“药极简易,性最平和,味不恶劣,易粉易服”等诸多优势而备受青睐。青果色青,莱菔色白,合而为剂,可消经络留滞之痰,解膏粱鱼面之毒,喉病之可免[7]。本方最大特点为善于清热利咽,主治热毒内盛、上灼咽喉、津液损伤所致咽喉肿痛,是预防及治疗呼吸道疾病的药食同源上佳良方。
中药质量评价标准欠完善、质量追溯性和均一性较差等问题一直是亟待解决的技术瓶颈,已成为行业发展的重中之重[8]。中药复方质量易受其组成药味多基原、多品种、多产地、药材来源不稳定、多成分及相互作用复杂等因素影响,影响其质量一致性,不利于有效控制疗效的稳定[9-12]。课题组前期围绕QBD,已完成青龙白虎饮及利咽含片的研究,并初步建立相关质量标准体系[13-14]。但QBD中的化学成分群在煎煮、浓缩、干燥过程中的动态变化亟待进一步研究,以综合、全面的对QBD进行质量控制。因此,本实验采用15批青果饮片和市售新鲜莱菔,首次以古籍记载的煎煮方法为参考依据进行QBD的煎煮-浓缩-干燥工艺研究,以有效成分转移率、出膏率等为质控指标,运用化学指纹图谱分析技术和多指标成分含量测定方法,初步构建QBD全过程质量标准评价体系,再结合化学计量学手段分析QBD内在影响因素,探寻QBD质控影响关键成分,系统的、全方位的对工艺全过程进行质量评价分析,探寻其量质传递规律,以期为后续相关制剂的研究研发提供可靠的技术保障。
1 仪器与材料
1.1 仪器
UltiMate 3000型高效液相色谱仪,美国Thermo Fisher公司;色谱柱Thermo Hypersil GOLD C18(250 mm×4.6 mm,5 μm)和色谱柱AcclaimTM120 C18(250 mm×4.6 mm,5 μm),赛默飞世而科技(中国)有限公司;UPK-I-10T型纯水机,四川优普超纯科技有限公司;AR224CN电子天平,万分之一,奥豪斯仪器(常州)有限公司;CPA225D型十万分之一电子分析天平,赛多利斯科学仪器(北京)有限公司;FTS-10A全自动煎药壶,潮州市一壶百饮电器实业有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;DL-720D数控超声波清洗器,上海之信仪器有限公司。
1.2 试药
甲醇、乙腈为色谱纯,美国Sigma-Aldrich公司;色谱纯磷酸,成都市科隆化学品有限公司;水为超纯水,自制,其它试剂均为分析纯;对照品没食子酸(CAS号149-91-7,批号wkq20010905)、原儿茶酸(CAS号99-50-3,批号wkq20020706)、绿原酸(CAS号327-97-9,批号wkq20042702)、表儿茶素(CAS号490-46-0,批号wkq20012203)、东莨菪内酯(CAS号92-61-5,批号wkq20011001)、鞣花酸(CAS号476-66-4,批号wkq20011002),质量分数均≥98%,均购自成都省维克奇生物科技有限公司。15批青果药材分别购于四川省合江县、四川省广安市、广东省广州市和福建省闽侯县,包含道地药材产地及主产区,均于秋季采收,保证了样品的均一性和代表性,并根据《中国药典》2020年版相关规定储存于干燥处,防蛀,饮片具体信息见表1。经成都中医药大学药学院标本中心蒋桂华教授鉴定为橄榄科橄榄属植物橄榄Raeusch.的干燥成熟果实,药材经炮制得到15批青果饮片,经检验药材和饮片均符合《中国药典》2020年版一部项下的相关规定[1];莱菔市售,产于温江无公害蔬菜基地农场,经标本中心蒋桂华教授定其基原为十字花科植物莱菔L.的新鲜根茎。
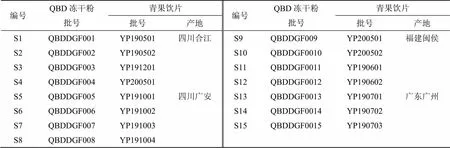
表1 15批青果饮片产地信息
2 方法与结果
2.1 QBD冻干粉的制备
结合QBD相关文献报道[13-14]参考其制备工艺参数,并通过单因素考察确定QBD最佳工艺为青果与莱菔比例为1∶1,6倍量水提取2次,每次60 min。称取青果饮片60 g加水浸泡30 min,然后加入切制小块的新鲜莱菔60 g,6倍量水(720 mL)煎煮2次,每次1 h,合并2次QBD煎煮液得1200 mL。取煎煮液1200 mL减压浓缩至约150 mL,得浓缩液;对浓缩液进行冷冻干燥,即得QBD冻干粉。
2.2 溶液的配制
2.2.1 对照品溶液的制备 称取没食子酸、原儿茶酸、绿原酸、表儿茶素、东莨菪内酯、鞣花酸对照品适量,精密称定,加甲醇制成分别含没食子酸、原儿茶酸、绿原酸、表儿茶素、东莨菪内酯、鞣花酸0.943、0.757、1.025、1.160、1.080、1.032 mg/mL的对照品储备液I,再各量取0.5 mL到5 mL量瓶中混匀,用甲醇稀释定容,得到混合对照品储备液II。
2.2.2 供试品溶液的制备
(1)单味饮片样品供试品溶液:按照“2.1”项下煎煮液制备方法,分别制备青果、莱菔的单煎样品溶液,过0.22 μm微孔滤膜,取续滤液,即得。
(2)QBD煎煮液供试品溶液:取“2.1”项下所制备的QBD煎煮液,过0.22 μm微孔滤膜,取续滤液,即得。
(3)QBD浓缩液供试品溶液:精密量取“2.1”项下所制备的QBD浓缩液2 mL置10 mL量瓶中,加水至刻度,摇匀,滤过,取续滤液,即得。
(4)QBD冻干粉供试品溶液:取“2.1”项下所制备的QBD冻干粉约0.2 g,精密称定,置10 mL量瓶中,加水超声处理(功率500 W、频率40 kHz)10 min使溶解,取出,放冷,定容至刻度,摇匀,滤过,过0.22 μm微孔滤膜,取续滤液,即得。
2.3 HPLC指纹图谱分析
2.3.1 色谱条件 AcclaimTM120 C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈-0.1%磷酸水溶液为流动相(流动相每天新鲜制备,通过0.45 μm滤膜,注射到色谱柱之前进行超声脱气),梯度洗脱:0~25 min,5%~12%乙腈;25~50 min,12%~15.4%乙腈;50~75 min,15.4%~22.5%乙腈;体积流量1.0 mL/min;检测波长237 nm;柱温30 ℃;进样量10 μL。理论板数按没食子酸峰计算不低于5000。
2.3.2 方法学考察
(1)精密度试验:取QBD冻干粉供试品溶液(S1),按“2.3.1”项下色谱条件连续进样6次,记录色谱图。以表儿茶素为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<1%,相对峰面积RSD<3%,以《中药色谱指纹图谱相似度评价系统软件》(2012. 130723版)评价,6次进样的相似度均为1.00,表明仪器精密度良好,符合指纹图谱要求。
(2)重复性试验:按“2.1”及“2.2.2”项下方法平行制备6份QBD冻干粉供试品溶液(S1),按“2.3.1”项下色谱条件进行测定,记录色谱图。以表儿茶素为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各峰相对保留时间RSD<1%,相对峰面积RSD<2.5%,以《中药色谱指纹图谱相似度评价系统软件》(2012.130723版)评价,6次进样的相似度均为1.00,结果表明该方法重复性良好,符合指纹图谱要求。
(3)稳定性试验:取QBD冻干粉供试品溶液(S1),分别于0、2、4、8、12、24、48 h按“2.3.1”项下色谱条件进行测定,记录色谱图。以表儿茶素为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<1.5%,相对峰面积RSD<3%,以《中药色谱指纹图谱相似度评价系统软件》(2012.130723版)评价,7次进样的相似度均为1.00,表明青果供试品溶液在48 h内稳定性良好,符合指纹图谱要求。
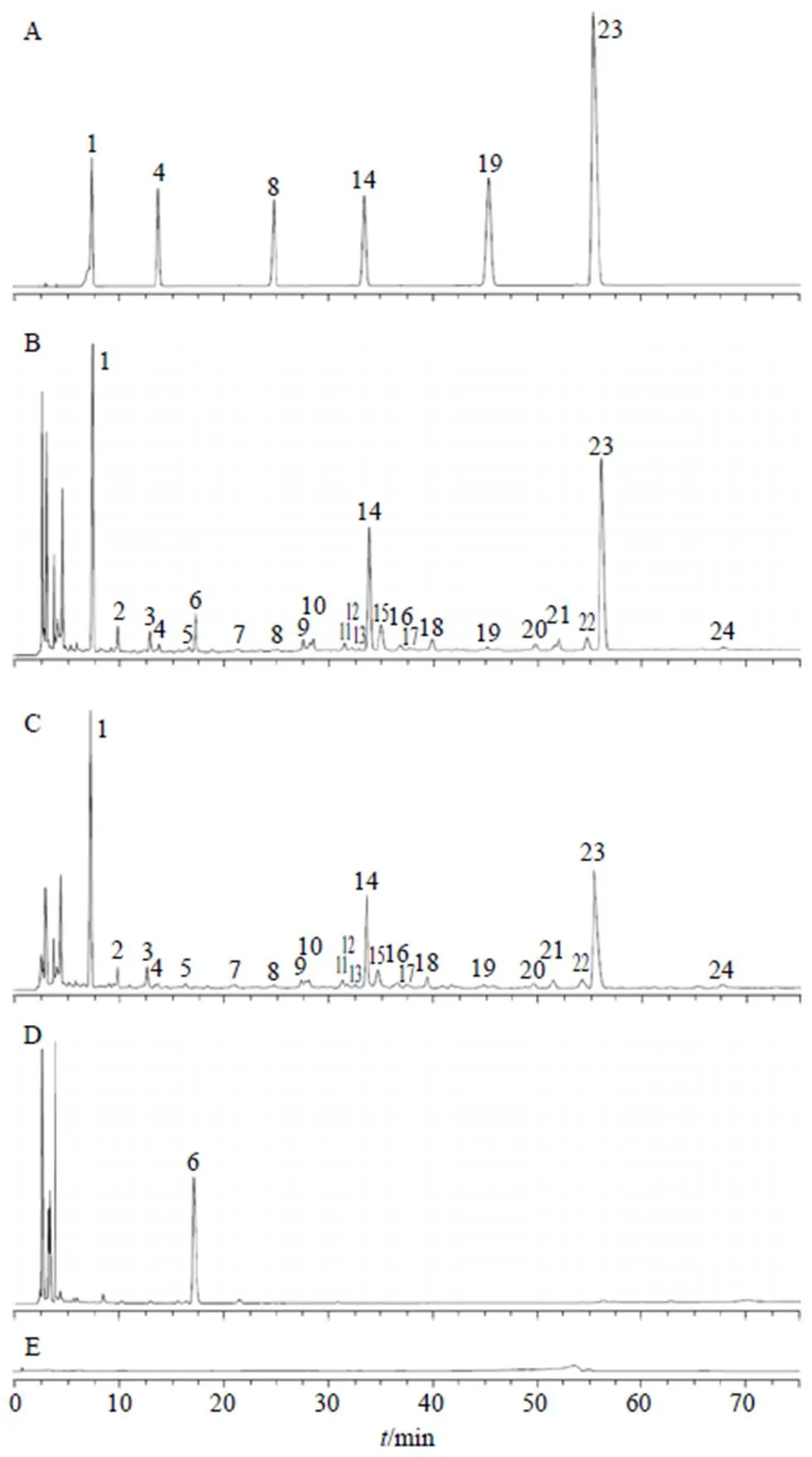
2.3.3 化学指纹图谱建立及相似度评价与分析 根据“2.3.1”项下色谱条件对15批青果饮片及QBD煎煮液、浓缩液和冻干粉的供试品溶液进行检测,记录各样品色谱图。采用国家药典委员会《中药色谱指纹图谱相似度评价系统软件》(2012.130723版)对记录的色谱图进行分析。以S1号样品的特征图谱作为参照谱进行指纹匹配(中位数法,时间窗为0.1 min),确定了24个共有峰。15批青果饮片及QBD煎煮液、浓缩液和冻干粉指纹图谱见图1;进行相似度计算,15批供试品的相似度均≥0.9,表明各批样品的相似度较好,化学成分稳定,结果见表2;选取分离度较好的表儿茶素色谱峰(14号峰)作为参照峰,各峰的相对保留时间和相对峰面积见表3。
2.3.4 色谱峰的化学成分指认及归属 通过与对照品位置比较,指认了其中6个共有峰,分别为没食子酸(1号峰)、原儿茶酸(4号峰)、绿原酸(8号峰)、表儿茶素(14号峰)、东莨菪内酯(19号峰)、鞣花酸(23号峰)。24个共有峰中,其中6号峰归属于莱菔,其余23个峰归属于青果饮片,占青果饮片总峰面积83.69%,占冻干粉总峰面积73.07%。结果表明,QBD冻干粉的主要物质群均可清晰地追溯到饮片,归属明确。
2.4 QBD冻干粉制备过程中有效成分的含量及出膏率的测定
2.4.1 色谱条件 同“2.3.1”项下的色谱条件。
2.4.2 方法学考察[12]
(1)专属性试验:分别精密吸取以上制备的混合对照品储备液II、冻干粉供试品溶液(S1)、莱菔单煎样品溶液、青果单煎样品溶液(S1)、甲醇空白溶剂各10 μL,注入液相色谱仪,按照“2.4.1”项下色谱条件测定,结果供试品色谱中,在与没食子酸、原儿茶酸、绿原酸、表儿茶素、东莨菪内酯、鞣花酸混合对照品色谱相应位置上有色谱峰,甲醇空白样品色谱上没有相应峰,结果表明样品溶液中各成分分离度(>1.5)和理论板数(>5000)均较好,且阴性无干扰,见图2。
(2)线性关系考察:取以上原儿茶酸、绿原酸储备液I各0.2 mL,表儿茶素储备液I 2 mL,鞣花酸储备液I 1 mL定容到5 mL,四者配成混合对照品溶液III进行线性考察;取以上没食子酸储备液I 3 mL定容到5 mL配成没食子酸对照品溶液IV进行线性考察。混合对照品溶液III和没食子酸对照品溶液IV分别稀释0、2、4、8、16、32、64倍后,注入液相色谱仪,按照“2.3.1”项下色谱条件测定,以各成分对照品质量浓度为横坐标(),峰面积为纵坐标(),绘制标准曲线,进行线性回归,得回归方程:没食子酸=0.162 2+1.667 1,2=0.999 1,线性范围8.841~565.8 μg/mL;原儿茶酸=0.237 8+0.029 2,2=1.000 0,线性范围 0.473 1~30.28 μg/mL;绿原酸=0.298 6+ 0.001 8,2=1.000 0,线性范围0.640 6~41.00 μg/mL;表儿茶素=0.291 7+0.989 1,2= 0.999 9,线性范围7.250~464.0 μg/mL;鞣花酸=0.978 4-2.100 3,2=0.999 4,线性范围3.225~206.4 μg/mL;结果表明各成分在相应的质量浓度范围内线性关系良好。

图1 15批(S1~S15)青果饮片 (A)、QBD煎煮液 (B)、QBD浓缩液 (C) 和QBD冻干粉 (D) 的HPLC指纹图谱及其对照指纹图谱(AR、BR、CR、DR)
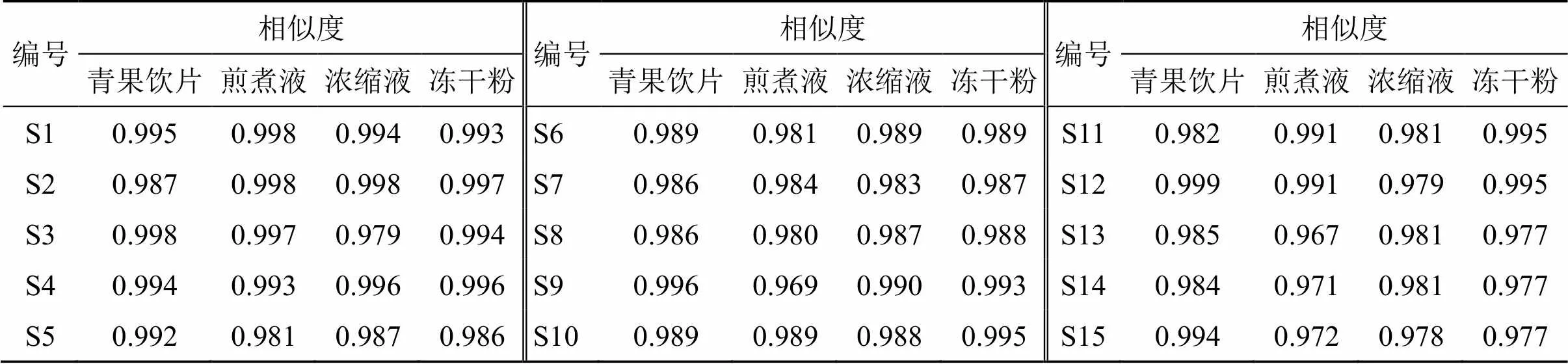
表2 15批青果饮片、QBD煎煮液、QBD浓缩液和QBD冻干粉与各自对照指纹图谱的相似度
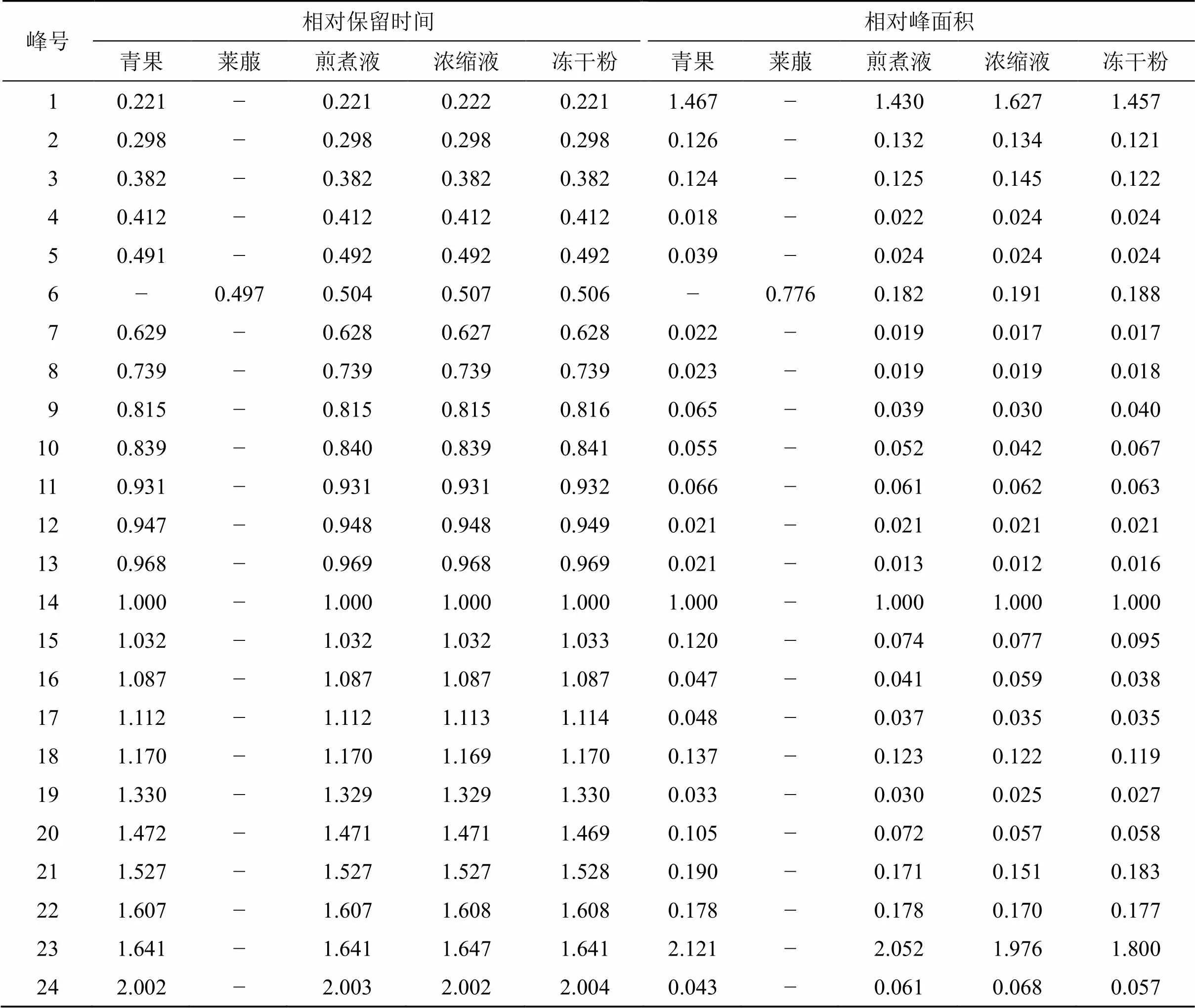
表3 QBD各单味药、煎煮液、浓缩液和冻干粉特征峰相对保留时间与相对峰面积
1-没食子酸 4-原儿茶酸 8-绿原酸 14-表儿茶素 19-东莨菪内酯 23-鞣花酸
(3)精密度试验:取同一QBD冻干粉供试品溶液(S1),按照“2.3.1”项下色谱条件测定,连续进样6次,记录峰面积,计算各成分色谱峰面积的RSD。计算没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸峰面积的RSD分别为0.1%、1.37%、0.98%、0.31%、0.38%,表明仪器精密度良好。
(4)重复性试验:按“2.3.2”项下方法平行制备6份QBD冻干粉供试品溶液(S1),按照“2.3.1”项下色谱条件测定,依次进样分析,记录峰面积,计算各成分质量分数的RSD。结果没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸质量分数的RSD分别为0.78%、0.89%、1.32%、0.74%、1.13%,表明该方法重复性良好。
(5)稳定性试验:取同一QBD冻干粉供试品溶液(S1),分别于制备后0、2、4、8、12、24、48 h按照“2.3.1”项下色谱条件测定,记录峰面积,计算各成分色谱峰面积的RSD。没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸峰面积的RSD分别为0.73%、0.85%、1.02%、1.12%、0.40%,表明供试品溶液在48 h内稳定。
(6)加样回收率试验:精密量取已知含量的QBD冻干粉0.2 g,平行6份,每份都分别加入对照品没食子酸2.828 mg、原儿茶酸0.046 mg、绿原酸0.017 3 mg、表儿茶素1.080 mg、鞣花酸0.801 mg,按“2.2.2”项下方法平行制备各供试品溶液(S1),进样量10 μL注入液相色谱仪,按照“2.3.1”项下色谱条件测定,记录峰面积,分别计算各指标成分的实际测得量和回收率,再计算各指标成分的平均加样回收率。结果没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸峰面积的平均加样回收率分别为99.5%、96.1%、97.0%、97.7%、99.4%,RSD分别为0.25%、0.49%、0.62%、0.62%、0.71%,结果表明该方法准确可靠。
2.4.3 含量测定[16-18]取15批QBD样品,按“2.2.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件对供试品溶液进行指标成分含量测定。以QBD冻干粉制备过程稳定性成分为评价指标,分别计算没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸的得率及转移率,得率=总体样品(指煎煮液、浓缩液和冻干粉)中指标成分质量/饮片投料量,转移率=总体样品(指煎煮液、浓缩液和冻干粉)中指标成分质量/总体饮片中指标成分质量,结果见表4~6。结果显示,15批青果饮片没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸平均质量分数分别为3.78、0.033、0.039 1、1.23、0.949 mg/g,RSD分别为18.18%、21.71%、14.81%、12.11%、25.83%。15批冻干粉中没食子酸、原儿茶酸、绿原酸、表儿茶素、鞣花酸质量分数分别为2.184%~2.84%、0.017%~0.079%、0.061%~0.141%、0.724%~1.301%、0.607%~0.760%,以没食子酸、表儿茶素、鞣花酸等成分含量较高。
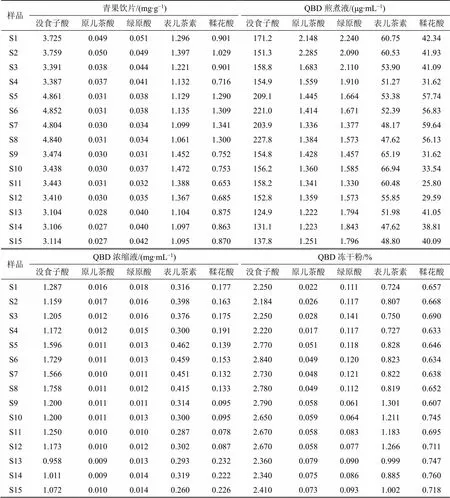
表4 15批青果饮片、QBD煎煮液、QBD浓缩液和QBD冻干粉中有效成分含量
煎煮液、浓缩液和冻干粉中,没食子酸平均得率分别为0.327%、0.322%、0.320%;原儿茶酸平均得率分别为0.002 93%、0.002 86%、0.002 84%,绿原酸平均得率分别为0.003 38%、0.003 35%、0.003 31%,表儿茶素平均得率分别为0.107%、0.105%、0.104%,鞣花酸平均得率分别为0.081 6%、0.076 2%、0.079 9%。没食子酸平均转移率分别为86.35%、85.15%、84.60%,RSD分别为4.94%、5.14%、4.95%;原儿茶酸平均转移率分别为87.81%、86.24%、85.63%,RSD分别为3.09%、3.97%、3.87%;绿原酸平均转移率分别为86.45%、85.52%、84.47%,RSD分别为4.64%、4.45%、4.19%;表儿茶素平均转移率分别为86.55%、85.63%、84.10%,RSD分别为3.99%、3.69%、4.54%;鞣花酸平均转移率分别为85.89%、85.10%、84.10%,RSD分别为4.80%、4.51%、4.54%。
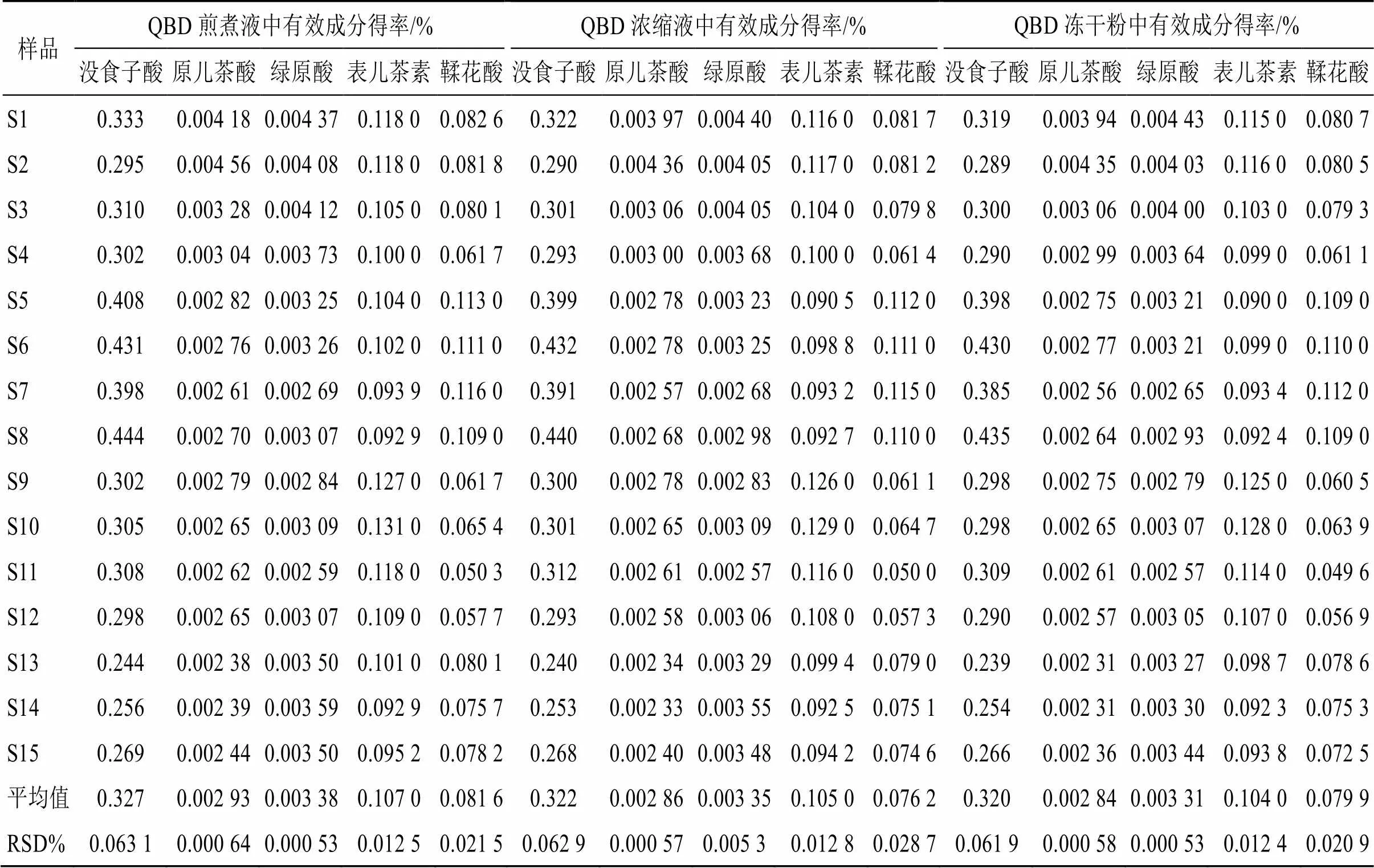
表5 15批QBD煎煮液、浓缩液和冻干粉中有效成分得率
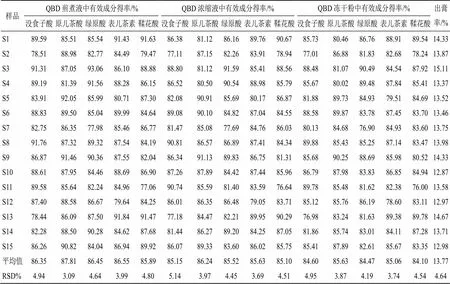
表6 QBD冻干粉制备过程中有效成分转移率及出膏率
2.4.4 出膏率的测定[10]测定15批冻干粉的出膏率(出膏率=冻干粉干膏质量/饮片投料量),结果见表6。15批冻干粉平均出膏率为13.77%,RSD为4.64%,未出现离散数据,说明该制备工艺较合理,未造成明显的批间差异。
2.5 基于化学计量学的QBD质量分析
2.5.1 主成分分析(principal component analysis,PCA)[19-22]将15批样品峰面积信息经Z-Score标准化后获得的数据矩阵导入SIMCA 14.1软件中,进行PCA。15个样品的二维PCA得分图见图3,从PCA得分图可以清楚地看出,15批样品被分成了3类,S1~S8属于四川产地,S9~S12属于福建产地,S13~S15属于广东产地。PCA结果驳斥了指纹图谱的高相似性,纵然指纹图谱显示15批次样品的相似度很高,但是它们仍旧被分成了3类。此外,分成的3类正好和样品的产地有着密不可分的关系,而同一产地几个批次的样品都很好的聚集在一起,说明产地影响着这些样品的质量。
2.5.2 聚类分析[19,23-24]从PCA评分图来看,不同产地样品是有差异的。聚类分析被用来再次验证这一结果,因为聚类分析提供了不同产地样品之间的相似性和变化的明确度量,显示了复杂的数据相互关系。将不同产地的15批冻干粉指纹图谱数据中的24个共有峰的峰面积导入SIMCA 14.1软件中,进行聚类分析。聚类结果见图4,以纵轴为参考依据,左边3批样品在数值小于1的时候已经聚拢,中间几批样品在数值约等于1的时候聚拢,右边几批样品在数值明显大于1的时候才聚拢,表明不同产地样品属不同类别,饮片的产地归属和内在质量差异有待进一步考察分析。
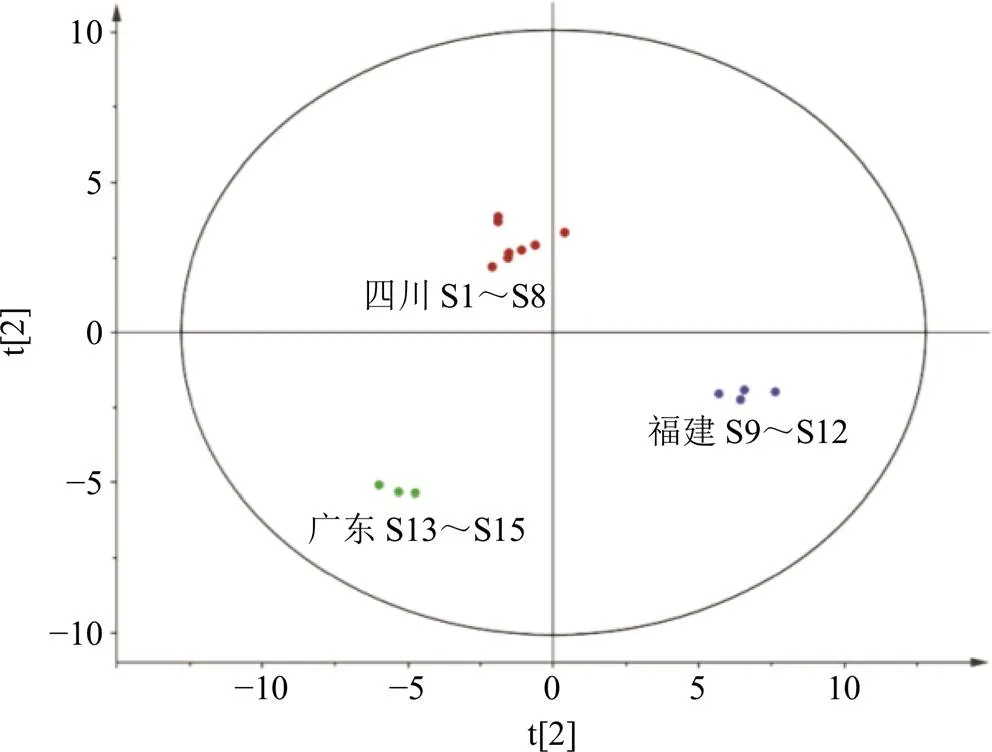
图3 15批QBD冻干粉PCA评分图
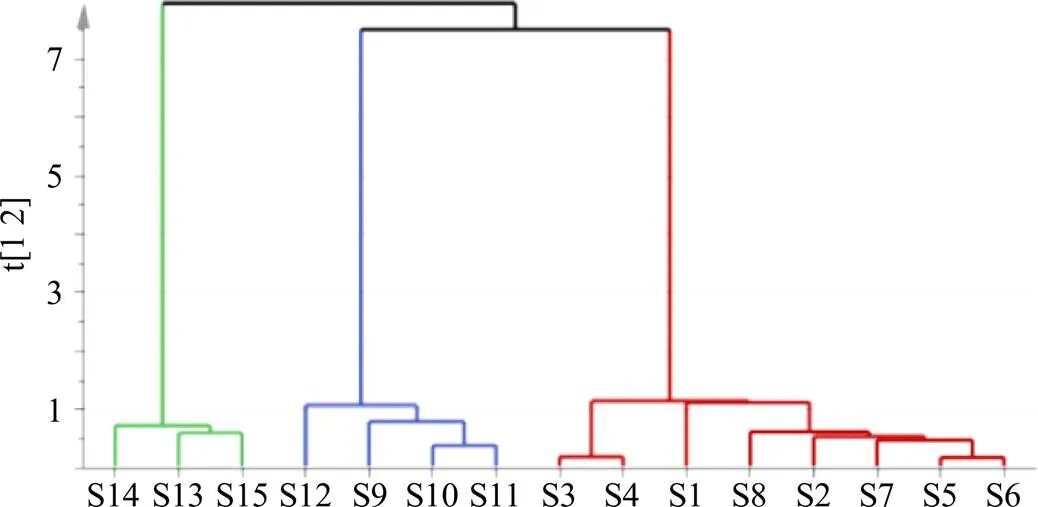
图4 15批QBD冻干粉聚类分析
2.5.3 正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)[25-27]采用有监督的OPLS-DA模型进行建模分析,筛选出对上述样本分类贡献较大的成分,为了确定每个变量对于辨别和获得化学标记的重要性,以变量重要性投影值(variable importance in project,VIP,即该变量对整体模型的贡献度高于平均水平)为有意义变量进行搜寻。VIP>1.0通常被用作衡量某个成分对差异的贡献的共同阈值[28]。本实验中,发现VIP>1的有9个峰,按照VIP值大小依次为峰14(表儿茶素)、1(没食子酸)、23(鞣花酸)、9、16、24、22、8(绿原酸)、21,见图5。同时峰4(原儿茶酸)的VIP值接近1(VIP=0.887),说明表儿茶素、没食子酸、鞣花酸、绿原酸和原儿茶酸是影响样品的主要成分,将这5种成分作为指导QBD汤剂冻干粉的定量质控指标。
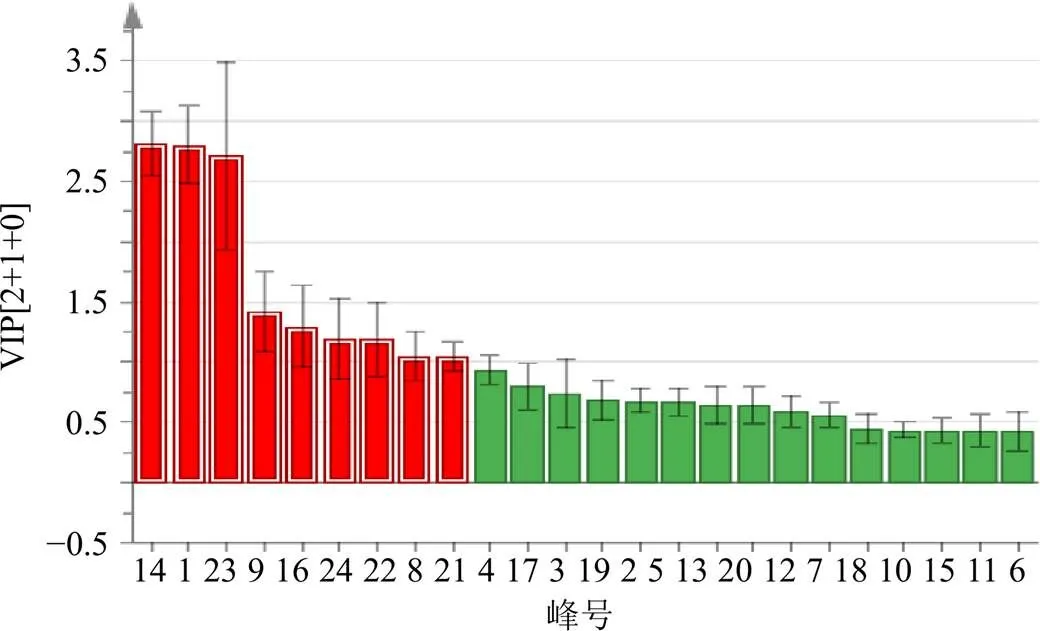
图5 24个共有峰的VIP值
3 讨论
3.1 色谱条件的选择
本实验综合考察了甲醇-0.1%磷酸水溶液、乙腈-0.1%磷酸水溶液、乙腈-0.5%磷酸水溶液、乙腈-水4种流动相、波长(214、237、254、273、280、306 nm)、柱温(25、30、35 ℃)、体积流量(0.8、1.0 mL/min)以及色谱柱(Thermo Hypersil Gold C18(250 mm×4.6 mm,5 μm)、AcclaimTM120 C18(250 mm×4.6 mm,5 μm)等因素,结果表明在流动相为乙腈-0.1%磷酸水溶液、波长237 nm、柱温30 ℃、体积流量为1.0 mL/min、色谱柱为AcclaimTM120 C18(250 mm×4.6 mm,5 μm)等条件下色谱峰峰形、分离度及出峰数量等较优,同时色谱图基线更平稳,各峰之间的比例比较协调,直观效果较好。在综合考察峰形、基线等多项干扰因素下,确定此色谱条件进行指纹图谱及含测相关研究。
3.2 指标成分的确定
QBD组方精简,方中以青果中的酚类成分含量最高,为其主要药效成分,天然硫苷是莱菔中的主要特征性化学成分[29]。结合相关文献查阅[30-33],参照《中国药典》2020年版[1]中对青果饮片明确规定的没食子酸指标成分,并采用化学指纹图谱与多成分含量测定相结合进一步确定该方与药效相关联的关键成分。因方中青果为历版药典收载中药,莱菔为人们经常食用的蔬菜,因此本实验对全方的质量控制研究侧重在青果。青果中的多酚类成分如没食子酸、绿原酸、原儿茶酸、表儿茶素和鞣花酸是发挥清热解毒、利咽、抗氧化的主要成分[34-36],没食子酸还为主要抗菌活性成分[34]。
本实验通过建立HPLC指纹图谱,从定性和定量2个层面对QBD进行质量控制,在定量指标成分选择方面,由于后期发现东莨菪内酯峰型不太好且在标准汤剂中含量极微不好进行定量研究。综合分析,选择含量相对较高的主要药效成分没食子酸、绿原酸、原儿茶酸、表儿茶素和鞣花酸作为QBD冻干粉的含测指标,评价冻干粉批次间的一致性,有利于控制其质量稳定性。
此外,研究发现即使经过初步筛选并优化QBD梯度洗脱条件,色谱图中也只显示出莱菔中的唯一特征峰。课题组接下来将通过解吸电喷雾电离-离子化质谱成像技术(desorption electrospray ionization- mass spectrometry imaging,DESI-MSI)[37]、紫外-可见分光光度法等对HPLC未能检测的未知成分如青果莱菔合煎后产生的新物质及莱菔中的天然硫苷类成分等进行分析鉴定,以更全面控制QBD冻干粉的质量。
3.3 检测结果分析
指纹图谱结果表明,饮片、煎煮液、浓缩液和冻干粉的相似度均大于0.9,一致性良好。QBD冻干粉指标成分质量分数为没食子酸0.239%~0.435%、原儿茶酸0.002 31%~0.004 35%、绿原酸0.002 57%~0.004 43%、表儿茶素0.090 0%~0.128%、鞣花酸0.049 6%~0.112%。含量测定结果表明,15批QBD冻干粉样品含量较高的3种成分中,没食子酸含量的平均值为S5~S8>S9~S12>S1~S4>S13~S15,表儿茶素含量的平均值为S9~S12>S13~S15>S5~S8>S1~S4,鞣花酸含量的平均值为S5~S8>S13~S15>S1~S4>S9~S12。分析造成此含量差异的原因可能是产地不同所导致,化学计量学结果验证了分析的合理性。PCA及HCA结果都表明了产地的不同导致15批样品聚集成不同类别,也为后续实验开展选择青果产地来源明确了方向。
此外,通过OPLS-DA找到的VIP值大于1的已知成分表儿茶素、没食子酸、鞣花酸和绿原酸是对区分不同批次样品质量具有较大贡献的几个主要成分,此外其他VIP值大于1的未知成分将会是课题组接下来需要重点关注的部分。通过化学计量学发现莱菔的特征峰(峰6)的VIP值远小于1,认定此峰可能不是影响QBD质量的主要成分,因此可将其作为定量因素进行研究。QBD冻干粉指标成分的含量范围与转移率范围的结果表明指标成分转移稳定可控。
因提取溶媒为水,5种指标成分极性较强且转移率较高,说明煎煮、浓缩和冻干工艺较稳定,未造成有效成分的明显损失[38]。在量质传递过程中,冻干粉具备稳定、均一的优势,能很好地表达原方信息,而且便于储存,可为QBD冻干粉后续作为物质基准的深入研究提供依据。
本研究所建立的QBD的HPLC特征图谱、有效成分的含量测定和量质传递方法等质控手段,共同作为QBD的质量控制方法。在药食同源名方的研发中,控制原药材质量的均一性尤为重要,为进一步缩小指标成分含量的范围,除了对产地进行分析外,还应展开对采收季节和采收年份等外界因素的分析研究。此外,若药材因产地或批次不同而质量差异较大时,可固定产地或控制药材的含量限度范围,并且在生产加工中可采取饮片均一化投料的方法,可有效实现质量控制,有利于确切反映QBD的质量变化属性,从而确保其功效的稳健发挥,为QBD复方制剂及大健康产品的开发研究提供可靠的质量评价依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 206.
[2] Chen F Z, Yang L P, Huang Y N,. Isocorilagin, isolated from(Lour.) Raeusch, as a potent neuraminidase inhibitor against influenza A virus [J]., 2020, 523(1):183-189.
[3] Duan W J, Tan S Y, Chen J,. Isolation of anti-HIV components fromfruits by high-speed counter-current chromatography [J]., 2013, 46(7): 1057-1068.
[4] 蒋全德, 王景杰, 刘琳娜, 等. 白萝卜提取物对大鼠胃排空、肠推进及豚鼠离体回肠平滑肌的影响 [J]. 山西医科大学学报, 2007, 38(3): 215-217,257.
[5] 张旭, 马波, 杜钢军, 等. 白萝卜提取物对小鼠胃排空、肠推进及家兔离体回肠平滑肌的影响 [J]. 河南大学学报: 医学版, 2011, 30(1): 36-38.
[6] 任秦有, 王胜智, 张超, 等. 莱菔提取物对功能性消化不良患者胃运动功能的影响 [J]. 贵阳中医学院学报, 2011, 33(2): 15-17.
[7] (清) 王士雄著. 陆士谔辑. 达美君等校注. 王孟英医案卷二 [M]. 北京: 中国中医药出版社, 1997: 39.
[8] 江华娟, 李敏敏, 何瑶, 等. 基于HPLC指纹图谱和化学模式识别的经典名方桃红四物汤制备过程质量评价研究 [J]. 中草药, 2021, 52(4): 1000-1010.
[9] 樊启猛, 贺鹏, 李海英, 等. 经典名方物质基准研制的关键技术分析 [J]. 中国实验方剂学杂志, 2019, 25(15): 202-209.
[10] 周菲, 林美斯, 王琳, 等. 经典名方百合地黄汤物质基准制备及过程质量控制研究 [J]. 中草药, 2019, 50(16): 3824-3832.
[11] 国家药品监督管理局. 关于发布古代经典名方中药复方制剂简化注册审批管理规定的公告 (2018年第27号) [EB/OL]. [2018-06-01]. http://www.nmpa.gov.cn/ WS04/CL2138/228247. html.
[12] 陈蒙, 林龙飞, 刘宇灵, 等. 经典名方苓桂术甘汤HPLC指纹图谱的建立及3种成分含量测定 [J]. 中草药, 2019, 50(17): 4152-4157.
[13] 闫莉. 青龙白虎利咽含片的药学研究 [D].成都: 成都中医药大学, 2013.
[14] 闫莉, 傅超美, 季宁平, 等. 青龙白虎利咽含片的提取工艺研究 [J]. 中药与临床, 2012, 3(5): 18-21.
[15] 游宇, 罗林, 傅超美, 等. 青龙白虎保健饮料的研制 [J]. 中药与临床, 2018, 9(2): 20-22.
[16] 田萍, 位恒超, 韩德恩, 等. 真武汤HPLC-ELSD指纹图谱及13种成分含量测定研究 [J]. 中草药, 2020, 51(23): 5980-5989.
[17] 孟哲, 王丽君, 黄洋, 等. 中药三七不同药用部位的指纹图谱及模式识别研究 [J]. 中国药学杂志, 2020, 55(7): 504-509.
[18] Cao X X, Sun L L, Li D,. Quality evaluation ofby fingerprint chemical pattern recognition [J]., 2018, 23(9): E2307.
[19] 李双双, 李双, 杨建明, 等. RP-HPLC法测定桃红四物汤提取物中9种水溶性活性成分的含量 [J]. 中药新药与临床药理, 2017, 28(3): 364-367.
[20] 李耀磊, 左甜甜, 徐健, 等. 基于ICP-MS法对4种动物源性药材中16种无机元素的测定及量变规律研究 [J]. 药物评价研究, 2020, 43(2): 248-254.
[21] 刘冲, 刘荫贞, 乐智勇, 等. 桂枝饮片标准汤剂质量标准研究 [J]. 中草药, 2017, 48(8): 1577-1583.
[22] Shen J, Li P, He C N,. Simultaneous determination of 15 flavonoids from different parts ofand its chemometrics analysis [J]., 2019, 11(1): 20-27.
[23] Chen Z, Li Q, Yu Z,. Analysis of the similarities and differences betweenandrhizomes by chemical profiling and chemometric analysis [J]., 2020, 255: 112719.
[24] Gu F, Hall P, Miles N J. Performance evaluation for composites based on recycled polypropylene using principal component analysis and cluster analysis [J]., 2016, 115: 343-353.
[25] 徐男, 孙蓉, 崔焕月, 等. 化学计量学结合信息熵赋权优选半夏白术天麻汤提取工艺 [J]. 中草药, 2020, 51(4): 995-1002.
[26] 杨冰月, 彭亮, 颜永刚, 等. HPLC指纹图谱结合化学模式识别分析不同产地款冬花生品与蜜炙品 [J]. 中草药, 2018, 49(21): 4991-4997.
[27] 肖琳婧, 刘莹莹, 赵禹, 等. HPLC指纹图谱结合化学计量学的不同产地灯盏花药材和近缘种样品的质量评价 [J]. 中草药, 2019, 50(14): 3438-3443.
[28] 聂欣, 庞兰, 江华娟, 等. 经典名方化肝煎物质基准特征图谱及多指标成分含量测定研究 [J]. 中草药, 2020, 51(20): 5177-5186.
[29] 余辉攀. 莱菔化学成分和牡丹花提取物制备工艺及质量控制方法研究 [D]. 北京: 北京中医药大学, 2014.
[30] He Z Y, Xia W S. Analysis of phenolic compounds in Chinese olive (L.) fruit by RPHPLC- DAD-ESI-MS [J]., 2007, 105(3): 1307-1311.
[31] 姚瑞祺. 青果多酚的提取、分离及体外抗氧化活性研究[D]. 西安: 陕西师范大学, 2009.
[32] Chang Q, Su M H, Chen Q X,. Physicochemical properties and antioxidant capacity of Chinese olive (L.) cultivars [J]., 2017, 82(6): 1369-1377.
[33] 王恒, 宋良科, 汤昊, 等. 不同种质青果清热利咽化学组分的研究 [J]. 中国中药杂志, 2010, 35(6): 669-672.
[34] 孔庚星, 张鑫, 陈楚城, 等. 青果抗乙肝病毒成分研究 [J]. 解放军广州医高专学报, 1997(2): 84-86.
[35] 张亮亮, 杨志伟, 林益明. 橄榄多酚抗氧化活性研究 [J]. 食品工业科技, 2008, 29(4): 57-59.
[36] 袁剑刚, 刘昕, 汤展球. 橄榄的抑菌效应及其药效成分的初步研究 [J]. 食品科学, 2001, 22(3): 82-84.
[37] 曲缘章, 孙博, 朱广伟, 等. DESI-MSI技术在经典名方芍药甘草汤质量控制中应用研究 [J]. 中草药, 2020, 51(13): 3433-3443.
[38] 洪婷婷, 张钰明, 杨琳洁, 等. 经典名方半夏泻心汤水煎液的HPLC指纹图谱及黄芩、黄连量值传递研究 [J]. 中草药, 2020, 51(20): 5166-5176.
Research on quality control of famous prescription with medicine and food homology of Qinglong Baihu Decoction based on quantity-quality-correlation and chemometrics
CHEN Jiao1, WANG Ji-sen2, DENG Jing-jing1, ZHU Zong-ping1, LIAO Wan1, CHEN Yi1, YANG Qing-song1, WANG Lin1, FU Chao-mei1, ZHU Ya-ning1, 3
1. State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Chengdu Institute of Food and Drug Inspection, Chengdu 610045, China 3. Ya’an Sanjiu Pharmaceutical Co., Ltd., Ya’an 625000, China
To explore the preparation process of lyophilized powder of Qinglong Baihu Decoction (青龙白虎汤, QBD) and the law of quantity-quality-correlation by establishing an HPLC fingerprint detection method, and build its quality control system combined with chemometrics.Fifteen batches of QBD lyophilized powder were prepared, the fingerprints were established by HPLC method, then imported the chromatographic results into(2012) and calculated the similarity of each part. The content of gallic acid, protocatechuic acid, chlorogenic acid, epicatechin, and ellagic acid were detected during the quantity-quality-correlation of 15 batches of samples, and the transfer rate and extractum rate were calculated. Combined with the chemometrics methods, the main components of samples from different producing areas which had significant contribution to the quality control were analyzed.The similarity of the fingerprints of 15 batches of samples was > 0.9, which met the specified requirements, and the 24 common peaks of the fingerprints of the lyophilized powder were calibrated, and six of them were identified, they were gallic acid (peak 1), protocatechuic acid (peak 4), chlorogenic acid (peak 8), epicatechin (peak 14), scopoletin (peak 19), and ellagic acid (peak 23). The content range of these components in 15 batches of lyophilized powder were 0.724%—1.301% epicatechin, 2.184%—2.840% gallic acid, 0.607%—0.760% ellagic acid, 0.061%—0.141% chlorogenic acid, 0.017%—0.079% protocatechuic acid, the transfer rates of epicatechin, gallic acid, ellagic acid, chlorogenic acid and protocatechuic acid were 78.60%—89.38%, 76.98%—89.88%, 76.00%—89.78%, 76.90%—90.49%, 80.02%—90.25% respectively, the extractum rate was 12.87%—15.11%, and without discrete data. It showed that during the process of decoction, concentration and lyophilized powder, the transfer rates of effective components were stable. Through chemometrics analysis, it was found that 10 component scontributed significantly to the model, including the designated peak 14 (VIP = 2.812), peak 1 (VIP = 2.804), peak 23 (VIP = 2.715), peak 8 (VIP = 1.053) and peak 4 (VIP = 0.887), which can further deepen the quality control research of QBD.The quality control method of the famous prescription with medicine and food homology of QBD was established for the first time through the HPLC fingerprint combined with the content determination of multiple index components. This method is rapid, simple, feasible, reproducible, stable and it can be applied to the correlation investigation of the quantity-quality-correlation law of decoction pieces, decoction, concentrate and lyophilized powder at the same time; Further through the chemometrics, which provided an important reference for the quality control research of QBD.
Qinglong Baihu Decoction; quantity-quality-correlation; fingerprint; chemometrics; gallic acid; protocatechuic acid; chlorogenic acid; epicatechin; ellagic acid; quality control
R283.6
A
0253 - 2670(2021)13 - 3872 - 13
10.7501/j.issn.0253-2670.2021.13.011
2021-02-25
四川省中医药管理局中医药开发专项(2018KF001);四川省科技厅国际合作项目(2018HH0122);成都市科技局国际科技合作项目(2017-GH02-00054-HZ);成都中医药大学科技转化项目(CGPY1605)
陈 姣,女,硕士研究生,研究方向为中药新制剂和新剂型研究。Tel: 18428303508 E-mail: 1922702305@qq.com
廖 婉,女,博士,教授,硕士生导师,主要从事新制剂、新剂型及中药炮制工艺与机制研究。E-mail: liaowan2011@126.com
朱雅宁,高级工程师,博士生导师,研究方向为中药理论、制药技术与应用研究。E-mail: 676640058@qq.com
#共同第一作者:王继森,男,主管药师,硕士,从事药品检验研究工作。E-mail: 93230623@qq.com
[责任编辑 郑礼胜]
——徐州市青果小作家基地简介