迷迭香酚酸类成分研究
何默忠,曹 伟,曾光尧,陈正收,周应军*
迷迭香酚酸类成分研究
何默忠1,曹 伟2,曾光尧2,陈正收3,周应军2*
1. 湖南一方天江药业有限责任公司,湖南 常德 415000 2. 中南大学湘雅药学院,湖南 长沙 410006 3. 湖南今汉药业有限公司,湖南 浏阳 410300
研究迷迭香中的酚酸类化学成分。迷迭香叶用80%乙醇提取,碱溶酸沉处理后,经硅胶柱色谱、聚酰胺柱色谱、亲脂性Sephadex LH-20柱色谱、重结晶等手段进行分离纯化,并结合多种波谱方法进行结构鉴定。从迷迭香叶80%乙醇提取物中分离得9个酚酸类成分,包括一系列松香烷二萜类化合物,分别为7β-乙氧基迷迭香醌(1)、7-乙酰氧基香茶菜酚A(2)、鼠尾草酚(3)、迷迭香酚(4)、表迷迭香酚(5)、异迷迭香酚(6)、20-去氧鼠尾草酚(7)、木香醌酸(8)、桦木酸(9)。化合物1和2为新化合物。
迷迭香;酚酸类;松香烷二萜;7β-乙氧基迷迭香醌;7-乙酰氧基香茶菜酚A;鼠尾草酚;迷迭香酚
迷迭香L.为唇形科迷迭香属药食两用植物,是目前公认的具有较高抗氧化作用的一种植物。迷迭香是一种安全性高、抗氧化能力强的天然抗氧化剂,弥补了传统合成抗氧化剂的缺陷,还具有抗菌、抗病毒作用[1-2],是公认的最好的天然食品添加剂之一。二萜酚类化合物是迷迭香中的代表性成分,是其发挥抗氧化作用的主要物质[3]。二萜酚类化合物在抗炎、抗肿瘤、抗菌、神经保护等方面的作用也有相关的文献报道[4-7],但对于迷迭香中该类化合物并没有进行系统的研究。为了进一步开发利用迷迭香,更好地提供其药用价值理论依据,本实验对其酚酸类化学成分进行了研究,从中分离得到9个化合物,分别为7β-乙氧基迷迭香醌(7β-ethoxy rosmaqunione,1)、7-乙酰氧基香茶菜酚A(7-acetoxy atuntzensin A,2)、鼠尾草酚(carnosol,3)、迷迭香酚(rosmanol,4)、表迷迭香酚(epirosmanol,5)、异迷迭香酚(isorosmanol,6)、20-去氧鼠尾草酚(20-deoxocarnosol,7)、木香醌酸(royleanonic acid,8)、桦木酸(betulinic acid,9),其中化合物1和2为新化合物。
1 仪器与材料
Bruker AV-400、500 MHz核磁共振波谱仪(瑞士Bruker公司);Agilent6540 Q-TOF质谱仪(美国Agilent公司);ZF-2紫外检测仪(上海市安亭电子仪器厂);R-1001VN旋转蒸发仪(郑州长城科工贸有限公司);DZ-2BC真空干燥箱(天津市泰斯特仪器有限公司);YP802N电子天平(上海精密科学仪器有限公司);GF 254预制硅胶板(青岛海洋化工有限公司);柱色谱硅胶(200~300目,青岛海洋化工有限公司);Sephadex LH-20葡聚糖凝胶(美国GE公司);聚酰胺(100~200目,国药集团化学试剂有限公司);所有试剂均为分析纯或色谱纯。
迷迭香药材于2014年6月采自湖南今汉生物科技有限公司种植基地,由中南大学湘雅药学院李劲平副教授鉴定其为唇形科迷迭香属植物迷迭香L.的叶。
2 提取与分离
称取迷迭香干叶2 kg,通入蒸汽提取20 min除去精油,剩余药材用6倍量的80%乙醇提取3次,每次1 h,合并提取液回收至无醇味。静置过夜后离心,沉淀加入3倍量85%乙醇回流溶解,冷却后离心,滤液回收溶剂至浸膏并干燥,得到100 g提取物。
100 g迷迭香提取物,加入800 mL 60%乙醇溶液回流溶解,再加入2 g活性炭进行吸附,趁热滤过,滤液自然冷却至室温后放入冰箱中冷藏、静置。析出沉淀后抽滤,得到滤液,回收溶剂至一半体积。
另配制约1000 mL 2% Na2CO3溶液,将上述回收至一半体积的滤液加入Na2CO3溶液中,边加边搅拌,约20 min后,滤过。滤液用1 mol/L稀盐酸调节pH值至4左右,再次滤过,并收集固体不溶物,干燥后称定质量,得到22 g样品。
使用硅胶柱色谱对22 g样品进行分段。根据薄层色谱结果选择石油醚-醋酸乙酯系统进行梯度洗脱,流分合并后得到6个部分:A(0.7 g)、B(1.0 g)、C(6.3 g)、D(6.6 g)、E(5.1 g)、F(1.8 g)。
C部分经硅胶柱色谱分离和凝胶柱色谱反复纯化后得到6个化合物,分别为化合物2(15mg)、3(51 mg)、4(7 mg)、7(3 mg)、8(65 mg)、9(9 mg);D部分经硅胶柱和凝胶柱色谱分离纯化后得到2个化合物,分别为化合物5(15 mg)、6(7 mg)。E部分经硅胶柱和凝胶柱色谱分离纯化后得到化合物1(17 mg)。
3 结构鉴定
化合物1的1H-NMR (400 MHz, CDCl3)显示3.85 (= 7.0 Hz) 和3.95 (= 7.0 Hz) 处分别有1个多重峰,HSQC谱表明这2个氢为1个亚甲基,化学位移值提示其可能与氧相连,另外1.36 (= 7.0 Hz) 处有1个甲基的三重峰,1H-1H COSY显示这2组信号互相偶合,推断结构中可能存在-OCH2CH3片段。化合物1的不饱和度为9,13C-NMR显示共有3个羰基、4个烯碳,则还有4个不饱和度,由于其余的碳均为饱和碳,推测结构中含有4个环。2.94 (= 1.1 Hz,6.9 Hz) 处的七重峰信号,与1.12 (= 6.9 Hz) 和1.14 (= 6.9 Hz) 处的2个甲基信号,提示结构中存在1个异丙基,可从1H-1H COSY谱得到证实;1.03和0.90处各有2个甲基,表现为单峰;由HSQC谱可知,1.45和3.22、1.46和1.61、1.17和1.46分别为3个亚甲基。这些特征性信号表明化合物1具有与分离得到的其它化合物相同的三环二萜骨架,其中C环为芳香环,20位的羧基可能形成了另一个内酯环(图1)。
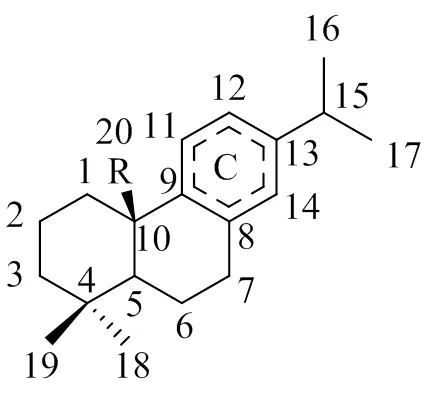
图1 化合物1的基本结构骨架
1H-NMR显示只有1个芳香氢信号6.64,对应的碳信号为133.7,HMBC谱显示其与2.94和4.00的2个氢相关,由其骨架结构可知该碳只能为C-14,2.94为15位的次甲基氢信号,4.00则为7位的氢;4.00 (= 3.1 Hz) 和4.61 (= 3.1 Hz) 处分别有1个互相偶合的氢信号,提示4.61为H-6信号,由值推断H-6和H-7均与氧相连;还剩下2.05处的1个氢信号,属于H-5,该信号为单峰,对该类化合物的谱图分析发现当20位的羧基与6位形成内酯时,H-5和H-6的二面角为90°,不能发生偶合,另外HMBC谱显示4.61的H-6与175.7的羰基碳相关,也佐证了这一内酯环的合理性。
HMBC谱(图2)中2.94的H-15与180.1的羰基碳相关,证明C-12位为羰基,13C-NMR显示共有3个羰基,则C-11只能为羰基。HMBC谱中3.85 (= 7.0 Hz) 和3.95 (= 7.0 Hz) 的亚甲基只与1.36的甲基和4.00的H-7相关,表明乙氧基片段与C-7相连。
得到化合物1的平面结构后,对其立体结构进行了分析。NOESY谱显示H-5、H-6和H-7相关,提示H-7与H-5、H-6的构型一致,为α构型,从而得到化合物1的结构(图3),命名为7β-乙氧基迷迭香醌。
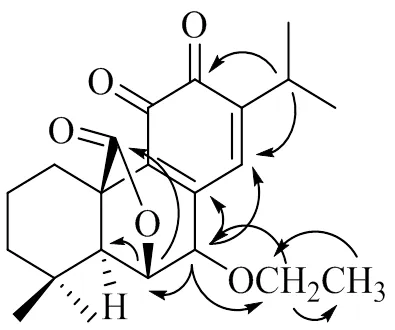
图2 化合物1的主要HMBC相关
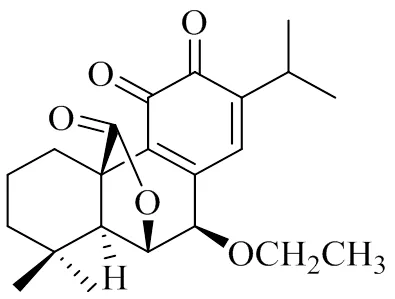
图3 化合物1的结构
化合物2的1H-NMR (400 MHz, CDCl3) 显示2.13处有1个尖锐的甲基单峰,表明结构中存在1个与吸电子基相连的甲基,由HMBC谱可知该甲基与168.8的羰基碳相关,因此推测结构中存在-OCOCH3(乙酰氧基)片段。化合物2的不饱和度为10,13C-NMR (100 MHz, CDCl3) 显示结构中存在4个羰基、4个烯碳,则还有4个不饱和度,由于其余的碳均为饱和碳,推测结构中含有4个环。3.16 (1H,sept,= 7.0 Hz) 和1.19 (= 7.0 Hz),1.23 (= 7.0 Hz) 的2个甲基组成了1个异丙基,可从1H-1H COSY谱得到证实;1.24和1.20处各有1个单峰的甲基;由HSQC谱可知,1.64和3.26、1.52和1.66、1.18和1.49分别为3个亚甲基。这些特征性信号表明化合物2具有与分离得到的其它化合物相同的三环二萜骨架,其中C环为芳香环,20位的羧基可能形成了另一个内酯环(图4)。
图4 化合物2的基本结构骨架
除去特征性信号,1H-NMR显示还有2.05(s)、4.58 (= 3.6 Hz) 和5.92 (= 3.6 Hz) 3个氢信号。4.58和5.92的2个H互相偶合,化学位移值提示均与氧相连,则2.05的H只能为H-5,该信号为单峰,对该类化合物的谱图分析发现当20位的羧基与6位形成内酯时,H-5和H-6的二面角为90°,H-5的峰形为单峰,否则会与H-6偶合表现为d峰或dd峰。
HMBC谱(图5)显示H-5 (2.17) 及3个亚甲基的H均与175.0的羰基碳相关,提示该羰基为附近20位上的羰基;该羰基又与4.58的氢相关,推断该氢为H-6,则只剩下5.92的氢为H-7;此外,H-7与168.8的C相关,2.13的甲基与C-7 (64.4) 相关,表明-OCOCH3片段连接在7位。
7.15处有1个H信号,HSQC显示未与碳相连,推测为1个羟基;13C-NMR显示共有4个羰基信号,除了-OCOCH3和内酯外,还有2个羰基181.4和183.9。150.8处有1个烯碳信号,值提示可能与羟基相连;HMBC谱中5.92的H-7和3.16的H-15均与183.9的碳有相关,则该碳信号为C-14;3.16的H-15还与150.8和125.7的碳有相关,而19.5和19.7的2个甲基与125.65的碳有相关,提示125.7的碳信号为C-13,则150.8的碳信号为C-12;剩下181.4的碳信号为C-11。
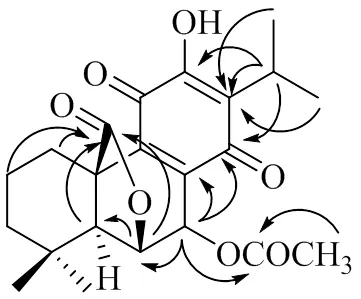
图5 化合物2的主要HMBC相关
得到化合物2的平面结构后,对其立体结构进行了分析。从NOESY谱来看,H-5与H-7没有相关信号,表明H-7为β-构型,则7位取代基为α构型,从而得到化合物2的结构(图6),命名为7-乙酰氧基香茶菜酚A。
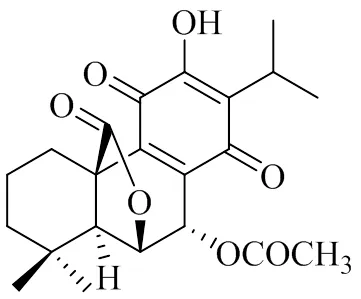
图6 化合物2的结构
化合物3:无色粉末,易溶于甲醇。1H-NMR (500 MHz, DMSO-6): 2.45 (1H, td,= 14.0 Hz, 5.0 Hz, H-1α), 2.65 (1H, d,= 14.0 Hz, H-1β), 1.53 (1H, d,= 12.5 Hz, H-2α), 1.72~1.79 (1H, m, H-2β), 1.23 (1H, m, H-3α), 1.44 (1H, m, H-3β), 1.61 (1H, dd,= 10.5 Hz, 6.0 Hz, H-5), 2.07 (1H, m, H-6α), 1.72~1.79 (1H, m, H-6β), 5.47 (1H, d,= 4.5 Hz, H-7), 6.70 (1H, s, H-14), 3.22 (1H, sept,= 6.8 Hz, H-15), 1.13 (3H, d,= 6.8 Hz, H-16), 1.13 (3H, d,= 6.8 Hz, H-17), 0.81 (3H, s, H-18), 0.79 (3H, s, H-19);13C-NMR (125 MHz, DMSO-6): 28.9 (C-1), 18.7 (C-2), 40.7 (C-3), 34.3 (C-4), 45.1 (C-5), 29.4 (C-6), 77.1 (C-7), 131.7 (C-8), 122.1 (C-9), 48.0 (C-10), 143.2 (C-11), 143.4 (C-12), 134.4 (C-13), 111.4 (C-14), 26.3 (C-15), 22.8 (C-16), 19.5 (C-17), 31.5 (C-18), 22.9 (C-19), 175.6 (C-20)。其1H-NMR和13C-NMR数据与文献报道一致[8],故鉴定化合物3为鼠尾草酚。
化合物4:淡黄色粉末,溶于甲醇。1H-NMR (500 MHz, DMSO-6): 1.82 (1H, td,= 14.0, 5.0 Hz, H-1α), 3.16~3.19 (1H, m, H-1β), 1.28~1.39 (1H, m, H-2α), 1.54 (1H, m, H-2β), 1.18 (1H, m, H-3α), 1.28~1.38 (1H, m, H-3β), 2.23 (1H, s, H-5), 4.45 (2H, s, H-6, H-7), 6.74 (1H, s, H-14), 3.21 (1H, sept,= 6.8 Hz, H-15), 1.14 (3H, d,= 6.8 Hz, H-16), 1.11 (3H, d,= 6.8 Hz, H-17), 0.96 (3H, s, H-18), 0.82 (3H, s, H-19);13C-NMR (125 MHz, DMSO-6): 27.8 (C-1), 19.3 (C-2), 38.3 (C-3), 31.6 (C-4), 49.9 (C-5), 78.3 (C-6), 67.8 (C-7), 129.3 (C-8), 124.0 (C-9), 46.9 (C-10), 144.5 (C-11), 142.2 (C-12), 136.3 (C-13), 119.2 (C-14), 26.6 (C-15), 23.0 (C-16), 23.3 (C-17), 31.5 (C-18), 22.2 (C-19), 178.2 (C-20)。其1H-NMR和13C-NMR数据与文献报道一致[9],故鉴定化合物4为迷迭香酚。
化合物5:白色粉末,溶于甲醇。1H-NMR (500 MHz, DMSO-6): 1.79 (1H, td,= 14.0 Hz, 5.0 Hz, H-1α), 3.16-3.18 (1H, m, H-1β), 1.31~1.34 (2H, m, H-2α, H-3β), 1.53 (1H, m, H-2β), 1.16 (1H, m, H-3α), 1.93 (1H, s, H-5), 4.62 (2H, t,= 2.9 Hz, H-6, H-7), 6.84 (1H, s, H-14), 3.21 (1H, sept,= 6.8 Hz, H-15), 1.13 (3H, d,= 6.8 Hz, H-16), 1.11 (3H, d,= 6.8 Hz, H-17), 0.95 (3H, s, H-18), 0.83 (3H, s, H-19);13C-NMR (125 MHz, DMSO-6): 27.7 (C-1), 19.2 (C-2), 37.9 (C-3), 31.8 (C-4), 54.7 (C-5), 79.4 (C-6), 69.3 (C-7), 130.5 (C-8), 123.4 (C-9), 47.9 (C-10), 144.3 (C-11), 141.9 (C-12), 136.1 (C-13), 117.4 (C-14), 26.6 (C-15), 23.0 (C-16), 23.4 (C-17), 31.7 (C-18), 22.1 (C-19), 178.2 (C-20)。其1H-NMR和13C-NMR数据与文献报道基本一致[10],故鉴定化合物5为表迷迭香酚。
化合物6:淡黄色固体,溶于甲醇。1H-NMR (500 MHz, DMSO-6): 2.44 (1H, m, H-1α), 2.61 (1H, d,= 14.2 Hz, H-1β), 1.52 (1H, m, H-2α), 1.70 (1H, m, H-2β), 1.19 (1H, m, H-3α), 1.42 (1H, m, H-3β), 1.27 (1H, d,= 4.4 Hz, H-5), 4.15 (1H, q,= 4.4 Hz, H-6), 5.11 (1H, d,= 4.4 Hz, H-7), 6.71 (1H, s, H-14), 3.23 (1H, sept,= 6.8 Hz, H-15), 1.14 (3H, d,= 6.8 Hz, H-16), 1.13 (3H, d,= 6.8 Hz, H-17), 0.96 (3H, s, H-18), 0.81 (3H, s, H-19);13C-NMR (125 MHz, DMSO-d): 29.2 (C-1), 18.9 (C-2), 41.1 (C-3), 34.35 (C-4), 55.0 (C-5), 67.7 (C-6), 80.0 (C-7), 128.8 (C-8), 122.3 (C-9), 47.9 (C-10), 143.9 (C-11), 143.4 (C-12), 134.6 (C-13), 115.2 (C-14), 26.7 (C-15), 23.0 (C-16), 23.3 (C-17), 32.4 (C-18), 21.3 (C-19), 175.3 (C-20)。以上数据与文献报道一致[11],故鉴定化合物6为异迷迭香酚。
化合物7:白色固体,溶于二氯甲烷、甲醇。1H-NMR (500 MHz, DMSO-6): 2.15 (1H, m, H-1α), 2.59 (1H, m, H-1β), 1.66 (2H, m, H-2α, 2β), 1.31 (1H, m, H-3α), 1.60 (1H, m, H-3β, 6α), 1.49 (1H, m, H-5), 2.06 (1H, m, H-6β), 4.73 (1H, dd,= 3.5, 1.5 Hz, H-7), 6.65 (1H, s, H-14), 3.10 (1H, sept,= 6.9 Hz, H-15), 1.28 (3H, d,= 6.9 Hz, H-16), 1.27 (3H, d,= 6.9 Hz, H-17), 0.88 (3H, s, H-18), 1.17 (3H, s, H-19), 4.34 (1H, d,= 8.5 Hz , H-20α), 3.10 (1H, d,= 8.5 Hz, H-20β);13C-NMR (125 MHz, DMSO-6): 30.1 (C-1), 19.1 (C-2), 41.3 (C-3), 34.0 (C-4), 43.1 (C-5), 31.2 (C-6), 70.9 (C-7), 133.3 (C-8), 127.4 (C-9), 40.1 (C-10), 140.7 (C-11), 138.8 (C-12), 131.6 (C-13), 112.2 (C-14), 27.3 (C-15), 22.6 (C-16), 22.7 (C-17), 33.0 (C-18), 21.3 (C-19), 68.5 (C-20)。以上数据与文献报道一致[12],故鉴定化合物7为20-去氧鼠尾草酚。
化合物8:棕黄色粉末,溶于甲醇。1H-NMR (500 MHz, DMSO-6): 1.04 (1H, td,= 12.5 Hz, 4.5 Hz, H-1α), 2.85 (1H, d,= 12.5 Hz, H-1β), 1.45 (2H, m, H-2α, 3β), 2.21 (1H, m, H-2β), 1.20 (1H, m, H-3α), 1.34 (1H, d,= 11.5 Hz, H-5), 1.78 (1H, dd,= 12.5, 7.0 Hz, H-6α), 1.89 (1H, dd,= 12.5, 5.0 Hz, H-6β), 2.30 (1H, m, H-7α), 2.61 (1H, dd,= 20.5, 5.0 Hz, H-7β), 3.08 (1H, sept,= 6.8 Hz, H-15), 1.13 (3H, d,= 6.8 Hz, H-16), 1.14 (3H, d,= 6.8 Hz, H-17), 0.91 (3H, s, H-18), 0.81 (3H, s, H-19), 10.40 (1H, brs, 12-OH), 12.54 (1H, brs, -COOH);13C-NMR (125 MHz, DMSO-6): 33.9 (C-1), 19.8 (C-2), 40.7 (C-3), 33.6 (C-4), 51.8 (C-5), 16.9 (C-6), 25.9 (C-7), 143.2 (C-8), 145.5 (C-9), 46.4 (C-10), 183.36 (C-11), 153.1 (C-12), 124.3 (C-13), 187.5 (C-14), 23.9 (C-15), 20.4 (C-16), 20.2 (C-17), 32.6 (C-18), 19.8 (C-19), 175.8 (C-20)。以上1H-NMR和13C-NMR数据与文献报道基本一致[13],故鉴定化合物8为木香醌酸。
化合物9:白色固体,溶于甲醇。1H-NMR (500 MHz, CD3OD): 0.94 (1H, m, H-1a), 1.70 (1H, m, H-1b), 1.55 (2H, m, H-2, 6a), 3.14 (1H, dd,= 5.0, 10.9 Hz, H-3), 0.72 (1H, m, H-5), 1.42 (1H, m, H-6b), 1.40 (2H, m, H-7, 16a), 1.34 (1H, m, H-9), 1.44 (1H, m, H-11a), 1.27 (1H, m, H-11b), 1.06 (1H, m, H-12a), 1.72 (1H, m, H-12b), 2.34 (1H, m, H-13), 1.38 (1H, m, H-15a), 1.96 (1H, m, H-15b), 2.25 (1H, m, H-16b), 3.92 (1H, s, H-17), 1.64 (1H, m, H-18), 3.31 (1H, ddd,= 5.0, 10.6 Hz, 16.9 Hz, H-19), 1.20 (1H, m, 21a), 1.65 (1H, m, 21b), 1.45 (1H, m, H-22a), 1.91 (1H, m, H-22b), 0.97 (3H, s, H-23), 0.77 (3H, s, H-24), 0.99 (1H, s, H-25), 0.88 (3H, s, H-26), 1.02 (3H, s, H-27), 4.61 (1H, m, H-29a), 4.72 (1H, m, H-29b), 1.71 (3H, s, H-30);13C-NMR (125 MHz, CD3OD): 38.5 (C-1), 26.6 (C-2), 78.3 (C-3), 38.7 (C-4), 55.5 (C-5), 18.0 (C-6), 34.2 (C-7), 40.5 (C-8), 50.6 (C-9), 36.9 (C-10), 20.7 (C-11), 25.5 (C-12), 38.3 (C-13), 42.2 (C-14), 30.3 (C-15), 32.0 (C-16), 56.2 (C-17), 47.0 (C-18), 49.1 (C-19), 150.7 (C-20), 29.5 (C-21), 36.8 (C-22), 27.2 (C-23), 14.7 (C-24), 15.3 (C-25), 15.3 (C-26), 13.7 (C-27), 178.9 (C-28), 108.7 (C-29), 18.1 (C-30)。以上数据与文献报道一致[14],故鉴定化合物9为桦木酸。
4 讨论
本实验对迷迭香的酚酸类成分进行了较为系统地分离,得到9个酚酸类化合物,其中包括2个新化合物。分离到的化合物类型主要为松香烷二萜,还包括一个三萜,进一步丰富了迷迭香的物质基础研究。得益于含量丰富的酚类成分,迷迭香表现出强大的抗氧化活性,在油脂、化妆品行业扮演着越来越重要的角色。但是目前迷迭香在医药领域的应用还比较薄弱,基于迷迭香中酚酸类成分广泛的药理作用对其进行深入挖掘具有重要意义,可能会为迷迭香在医药方面的开发利用提供突破口,进一步实现迷迭香的综合应用价值。
利益冲突 所有作者均声明不存在利益冲突
[1] Nieto G, Ros G, Castillo J. Antioxidant and antimicrobial properties of rosemary (L.): A review [J]., 2018, 5(3): 98.
[2] Feriotto G, Marchetti N, Costa V,. Chemical composition of essential oils from,, and, and their effects on the HIV-1 tat protein function [J]., 2018, doi: 10.1002/cbdv.201700436.
[3] Miura K, Kikuzaki H, Nakatani N. Antioxidant activity of chemical components from sage (L.) and thyme (L.) measured by the oil stability index method [J]., 2002, 50(7): 1845-1851.
[4] Mengoni E S, Vichera G, Rigano L A,. Suppression of COX-2, IL-1β and TNF-α expression and leukocyte infiltration in inflamed skin by bioactive compounds fromL [J]., 2011, 82(3): 414-421.
[5] Kar S, Palit S, Ball W B,. Carnosic acid modulates Akt/IKK/NF-κB signaling by PP2A and induces intrinsic and extrinsic pathway mediated apoptosis in human prostate carcinoma PC-3 cells [J]., 2012, 17(7): 735-747.
[6] Bernardes W A, Lucarini R, Tozatti M G,. Antimicrobial activity ofagainst oral pathogens: Relevance of carnosic acid and carnosol [J]., 2010, 7(7): 1835-1840.
[7] de Oliveira M R. The dietary components carnosic acid and carnosol as neuroprotective agents: A mechanistic view [J]., 2016, 53(9): 6155-6168.
[8] Inatani R, Nakatani N, Fuwa H,. Structure of a new antioxidative phenolic diterpene isolated from rosemary (L.) [J]., 1982, 46(6): 1661-1666.
[9] Arisawa M, Hayashi T, Ohmura K,. Chemical and pharmaceutical studies on medicinal plants in Paraguay: Studies on “romero,” Part 2 [J]., 1987, 50(6): 1164-1166.
[10] Schwarz K, Ternes W. Antioxidative constituents ofRosmarinus officinalis and[J]., 1992, 195(2): 95-98.
[11] Nakatani N, Inatani R. Two antioxidative diterpenes from rosemary (L.) and a revised structure for rosmanol† [J]., 1984, 48(8): 2081-2085.
[12] Mothana R A, Al-Said M S, Al-Musayeib N M,.antiprotozoal activity of abietane diterpenoids isolated fromAndr [J]., 2014, 15(5): 8360-8371.
[13] Masuda T, Inaba Y, Takeda Y. Antioxidant mechanism of carnosic acid: Structural identification of two oxidation products [J]., 2001, 49(11): 5560-5565.
[14] Nono R N, Barboni L, Teponno R B,. Antimicrobial, antioxidant, anti-inflammatory activities and phytoconstituents of extracts from the roots ofCogn. (Melastomataceae) [J]., 2014, 93: 19-26.
Phenolic acids of
HE Mo-zhong1, CAO Wei2, ZENG Guang-yao2, CHEN Zheng-shou3, ZHOU Ying-jun2
1. Hunan Yifang Tianjiang Pharmaceutical Co., Ltd., Changde 415000, China 2. Xiangya Shool of Pharmaceutical Sciences, Central South University, Changsha 410006, China 3. Hunan Jinhan Pharmaceutical Co., Ltd., Liuyang 410300, China
To study the phenolic acids of.The compounds were isolated and purified from the 80% ethanol extract of leaves ofafter a process of alkali-solution and acid-isolation by several methods including silica gel column chromatography, polyamide column chromatography, lipophilic Sephadex LH-20 column chromatography, recrystal, et al. And their structures were elucidated on the basis of spectral data.Nine phenolic acids were isolated and identified as 7β-ethoxy rosmaqunione (1), 7-acetoxy atuntzensin A (2), carnosol (3), rosmanol (4), epirosmanol (5), isorosmanol (6), 20-deoxocarnosol (7), royleanonic acid (8) and betulinic acid (9).Compound 1 and 2 are new compounds.
L.; phenolic acids; abietane diterpenoid; 7-β-ethoxy rosmaqunione; 7-acetoxy atuntzensin A; carnosol; rosmanol
R284.1
A
0253 - 2670(2021)13 - 3798 - 06
10.7501/j.issn.0253-2670.2021.13.003
2020-11-19
国家自然科学基金资助项目(81573314)
何默忠,男,本科。Tel: (0376)7231000 E-mail: 2698677806@qq.com
周应军,男,博士,教授,主要从事天然药物化学研究。Tel: 13319588828 E-mail: fisher203@126.com
[责任编辑 王文倩]