基于单细胞转录组学的多基原有毒中药危害识别研究思路及方法
杨 彬,李遇伯, ,张艳军
·专 论·
基于单细胞转录组学的多基原有毒中药危害识别研究思路及方法
杨 彬1,李遇伯1, 2*,张艳军2*
1. 天津中医药大学中药学院,天津 301617 2. 天津中医药大学 组分中药国家重点实验室,天津 301617
目前国家药典委员会已采用风险评估策略开展中药外源性危害物的限量控制,并逐步开展内源性有毒成分风险控制。很多有毒中药毒性数据缺乏,尤其是多基原中药,化学成分复杂,作“同一药用”的毒理学表现是否一致?这给风险评估的第一步危害识别带来极大挑战。主要存在2个关键问题:一是毒性机制报道较少,信息碎片化,缺乏多种细胞多条通路综合考虑毒性结局;二是品种间成分差异显著,毒性物质基础不明确,缺乏能整体表征中药毒性的“等效毒性成分群”。因此,提出构建基于单细胞转录组学的多基原有毒中药危害识别研究思路及方法,以期为多基原有毒中药风险评估体系的构建提供技术支持。
多基原;有毒中药;风险评估;危害识别;单细胞转录组学
随着“一带一路”倡议及“健康中国2030”规划纲要的提出,中医药已成为国家战略的重要组成部分[1]。特别是中医药在防治新型冠状病毒肺炎中发挥了重要作用,中药大健康产业已迎来前所未有的重大发展机遇[2]。然而,中药质量均一性及安全性仍是目前制约中药产业快速发展的瓶颈。如马兜铃酸事件等中药毒性事件时有发生,严重制约了中药国际化进程。因此,探究中药质量控制及毒性评价的理论创新和技术突破,构建以质量控制及毒性评价为核心的中药风险评估体系是推动中药大健康产业快速发展亟待解决的关键问题。刘昌孝等[3]、雷海民[4]、李菲菲等[5]提出应立足于中药用药安全需求,在开展中药材基原、质量标准、安全性等一系列基础研究的基础上,启动以中药临床为导向的中药安全性评价研究,构建中药安全性和质量控制体系,有效管控中药的外源性污染和内源性有毒物质,从而构建中药药物警戒大数据平台,实现中药全生命周期的警戒活动。
除与机体因素有关外,中药毒性与外源性危害物和内源性有毒成分密切相关,其中内源性有毒成分受中药基原、炮制及加工等外部因素影响。目前国家药典委员会已采用风险评估策略开展中药外源性危害物的限量控制,并逐步开展内源性有毒成分的风险控制,以客观认识外部因素引起的中药安全性问题。危害识别是风险评估的第一步,其核心是对毒性效应、毒性物质及毒性机制进行定性描述,并关注毒性成分迁移代谢及相互作用[6-7]。当前很多有毒中药毒性数据缺乏,尤其是多基原中药,市售药材品种混杂,不同基原作同一药用的毒理学表现是否一致?这为风险评估带来极大挑战。主要存在2个关键问题:一是毒性机制信息碎片化,缺乏从多种细胞角度综合考虑毒性结局;二是品种间成分类别、含量差异显著,毒性物质基础不明确,缺乏能整体表征中药毒性的“等效毒性成分群”;因此需采用现代科学语言评价多基原有毒中药危害识别的一致性和特征性,以满足临床合理用药的需要。因此,本文提出从危害识别3个关键要素即毒性效应、毒性物质和毒性机制出发,充分考虑毒性成分迁移代谢及相互作用,借助单细胞转录组学、体外-体内成分分析及虚拟筛选等多学科技术,建立多基原有毒中药危害识别研究思路及方法,以期为多基原有毒中药风险评估体系的构建提供技术支持。
1 基于危害识别的多基原有毒中药研究现状
国家药典委员会提出以“风险控制”为核心开展中药质量安全标准建设[8]。近年来,在广泛开展中药重金属、农药残留等外源性有害残留物风险控制研究的基础上,已逐步开展基于内源性有毒物质的有毒中药风险控制研究[9-10]。如补骨脂[11]、山豆根[12]、淫羊藿[13]以及含有雷公藤甲素[14]、马兜铃酸[15]等毒性成分的中药风险控制研究已有报道。风险评估是风险控制研究的基础,由危害识别、危害特征描述、暴露评估和风险特征描述4个核心步骤组成。危害识别是风险评估的第一步,即一种因素能引起生物系统或人群发生不良反应作用的类型和属性的过程,其核心是对毒性效应、毒性物质及毒性机制进行定性表述,并考虑成分迁移代谢及相互作用,见图1。
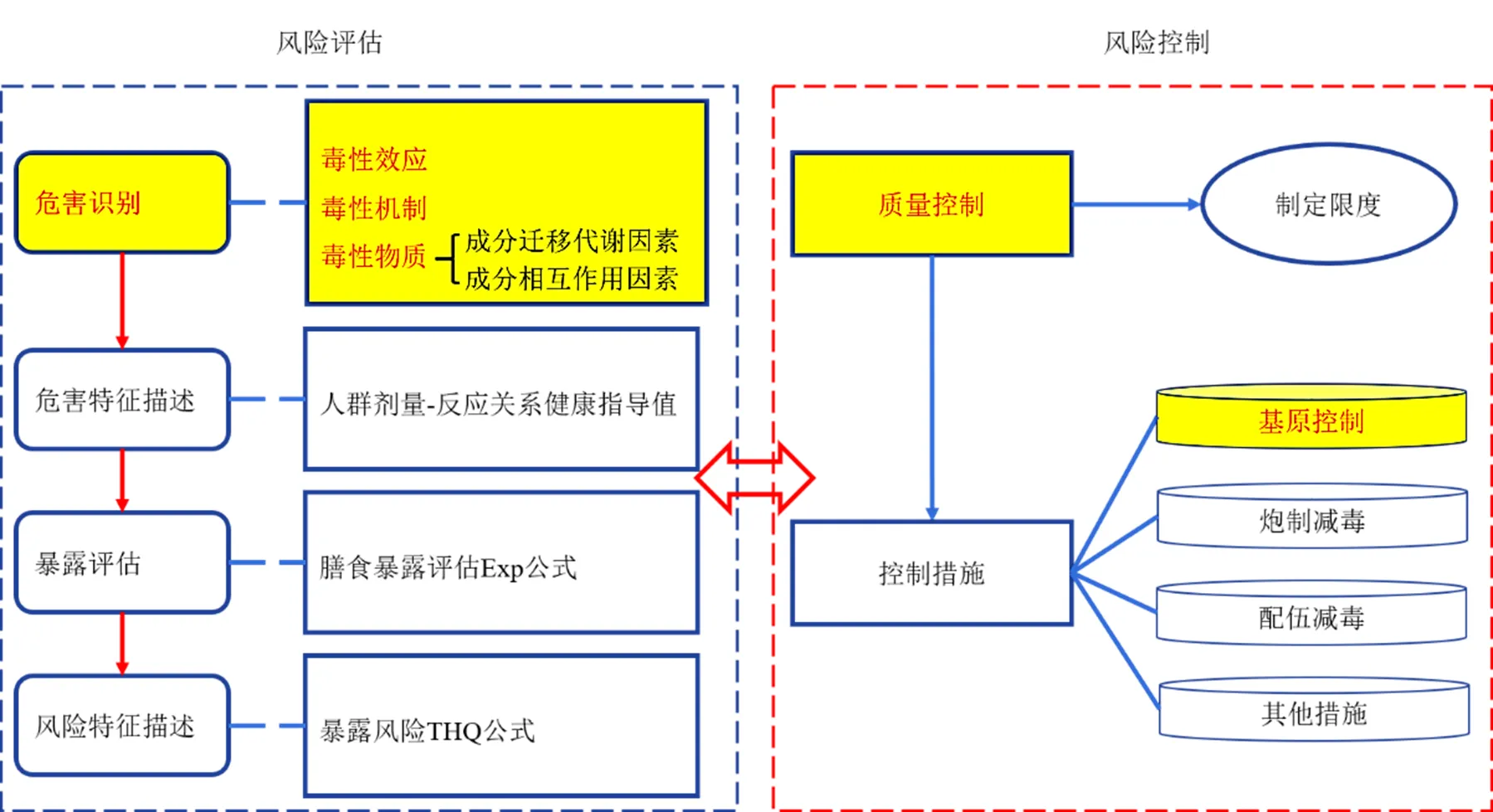
图1 危害识别、风险评估及中药质量控制的关联
“一药多源”历史由来已久,《中国药典》2015年版收载多基原中药152种,占收录品种的24.6%[16]。有毒中药的多基原性导致药材品种混杂,毒性物质及机制未知,这为有毒中药的危害识别带来极大挑战[17]。此外,由于中药毒理学发展相对较晚,除少数品种以外,大多数有毒中药不同基原物种间毒性物质类别和含量不明确,毒性效应和机制亦未知,多基原有毒中药临床互用及同一质量标准是否合理还缺乏科学阐释。因此,为保证多基原有毒中药临床用药的安全性和质量可控性,亟需以危害识别为导向,从其关键三要素-毒性效应、毒性机制及毒性物质出发,开展多基原有毒中药安全性的一致性和特征性研究。
2 单细胞转录组测序技术的研究概况
自2009年问世以来,单细胞转录组测序技术凭借揭示单个细胞的基因结构和基因表达动态,反映细胞发育进化以及异质性而迅速发展[18],并于2013年被列为年度最值得关注的6大领域榜首,并被评为年度技术[19-20]。其技术流程包括单细胞捕获、模板切换法逆转录得到cDNA、单细胞全转录组扩增、转录组文库构建和测序、数据分析等步骤[21-22]。单细胞转录组测序可对单个细胞进行无偏、可重复和高通量的转录分析,再结合定量聚合酶链式反应(polymerase chain reaction,PCR)、荧光免疫等方法验证,已在组织器官发育[23]、癌症异质性[24]、药物敏感性及疾病进程[25]等生命现象的精准剖析中展示巨大的优势。
单细胞转录组技术在中药领域研究中的应用刚刚起步。Zhang等[26]从胃炎-胃癌转化及中医治未病角度切入,赵蔚波等[27]提出单细胞转录组对中医体质的“基本原理”或“关键问题”的展望。Liang等[28]采用单细胞转录组测序揭示了高糖影响2-细胞期胚胎的基因调控变化,为深入了解左归丸在糖耐量受损模型上的潜在分子机制提供了思路。随着分子生物学及组学技术的快速发展,人们可从整体性、系统性等多视角对中药药效及毒性的作用机制进行多层次的研究与阐释。但目前中药毒性研究主要集中于对靶器官组织毒性的作用机制进行科学阐释,其研究对象以器官组织为主,而组织由多种异质性细胞组成,单个细胞之间的差异导致单个细胞属性被大量细胞平均属性掩盖,无法获取数量较少的细胞亚群的表达信息。因此,亟需对单个细胞的基因或蛋白进行检测,以判断细胞功能、探索细胞通信层面的毒性作用机制[29-30]。Wang等[31]和Zhang等[32]提出单细胞转录组学结合多维组学和通路分析,其是评估靶细胞精确毒理学的一种强有力的新方法,引领了系统毒理学的变革。与平均细胞反应和模糊反应细胞独特特性的传统批量分析不同,单细胞技术能够对单个细胞变化进行敏感检测,并精确识别受毒物干扰的细胞及细胞亚群,可以提供丰富的信息来阐明细胞特异性改变和反应轨迹,检测起始点,绘制和发展毒性途径的动力学模型。目前,单细胞转录组学已应用于苯致造血干细胞毒性[33]、黄曲霉毒素B1肝毒性[34]以及药物过敏综合征[35]等毒性机制的研究中。单细胞转录组测序技术的2大优势:一是充分考虑细胞异质性,可对关键细胞亚群进行分类和功能分析;二是可通过拟时序分析描述细胞分化动态过程;这决定了其在中药毒理机制的精准剖析具有广阔的应用前景。
3 有毒中药毒性物质基础的发现策略
有毒中药具有多成分、多靶点、多途径的特色和复杂性,毒性物质的确定对于阐明毒性机制、开发减毒策略及制定质量标准至关重要。毒性物质基础研究多借鉴药效物质基础研究思路,即从体外化学成分及其代谢物入手,结合虚拟筛选、组学技术及分子生物学等方法,逐渐发现与效应指标相关联的物质[36]。
针对复杂的中药体系,必须揭开3个黑箱才能真正阐明中药毒性物质基础:一是中药成分的体外迁移及体内代谢均会影响毒性效应[37-38],发现体外-体内的迁移代谢因素对于识别毒性物质、制定风险控制策略至关重要。二是中药多个毒性成分如何通过多靶点调节机体产生效应呢?组学技术的应运而生为其从多维角度阐释多成分、多机制成为可能,结合虚拟筛选、数学计算等手段,发现毒性物质[39]。Wang等[40]采用虚拟筛选、亲和色谱及原子力显微镜结合的逐步分析法,发现中药药效/毒效物质,这亦为毒性物质研究提供借鉴。三是如何整体表征中药效应的“等效毒性成分群”?中药成分的相互作用均会影响毒性结局,可借鉴“等效成分群”思路,根据活性/毒性物质在体内靶细胞含量及比例建立等效性评价模型,结合效应指标验证,最终发现成分清晰、含量确定、毒性等价及机制明确的“等效毒性成分群”,阐明中药毒性物质基础[41]。
4 基于单细胞转录组学的多基原有毒中药危害识别研究
多基原有毒中药不同品种化学成分差异显著,毒理学数据缺乏,尚不能判断不同基原中药的临床使用风险。为此,课题组以危害识别为导向,从其三要素即毒性效应、毒性机制和毒性物质出发,考虑成分迁移代谢及相互作用,借助单细胞转录组学、体外-体内成分分析及虚拟筛选等多学科手段,提出基于单细胞转录组学的多基原有毒中药危害识别研究思路及方法(图2)。首先明确多基原有毒中药的靶器官毒性效应,随后采用单细胞转录组测序技术考察其毒性分子事件及毒性机制;再通过体外-体内成分分析,明确不同基原有毒中药化学成分迁移代谢规律;结合虚拟筛选等手段,经细胞类型分析和毒性通路验证,确认能整体表征多基原有毒中药毒性的“等效毒性成分群”;最后将数据整合分析,阐明多基原有毒中药危害识别的一致性和特征性。
4.1 多基原有毒中药靶器官毒性效应研究
选择符合《中国药典》规定的多基原有毒中药的不同基原物种,根据临床及动物实验报道长期给药致靶器官组织毒性的用药规律,设定相应的给药剂量和给药时间。对实验动物进行合理分组并设置不同给药剂量后,按照给药方案给药并饲养适当时间。收集靶器官组织、血样,通过检测生化指标、细胞因子表达以及组织病理切片观察等手段明确靶器官毒性效应。在此基础上,绘制关键检测指标与剂量、时间变化曲线,即给药剂量-毒性变化曲线,发现其毒性趋势及关键毒性效应指标,从机体水平和器官水平角度,明确多基原有毒中药靶器官毒性效应的一致性和特征性。
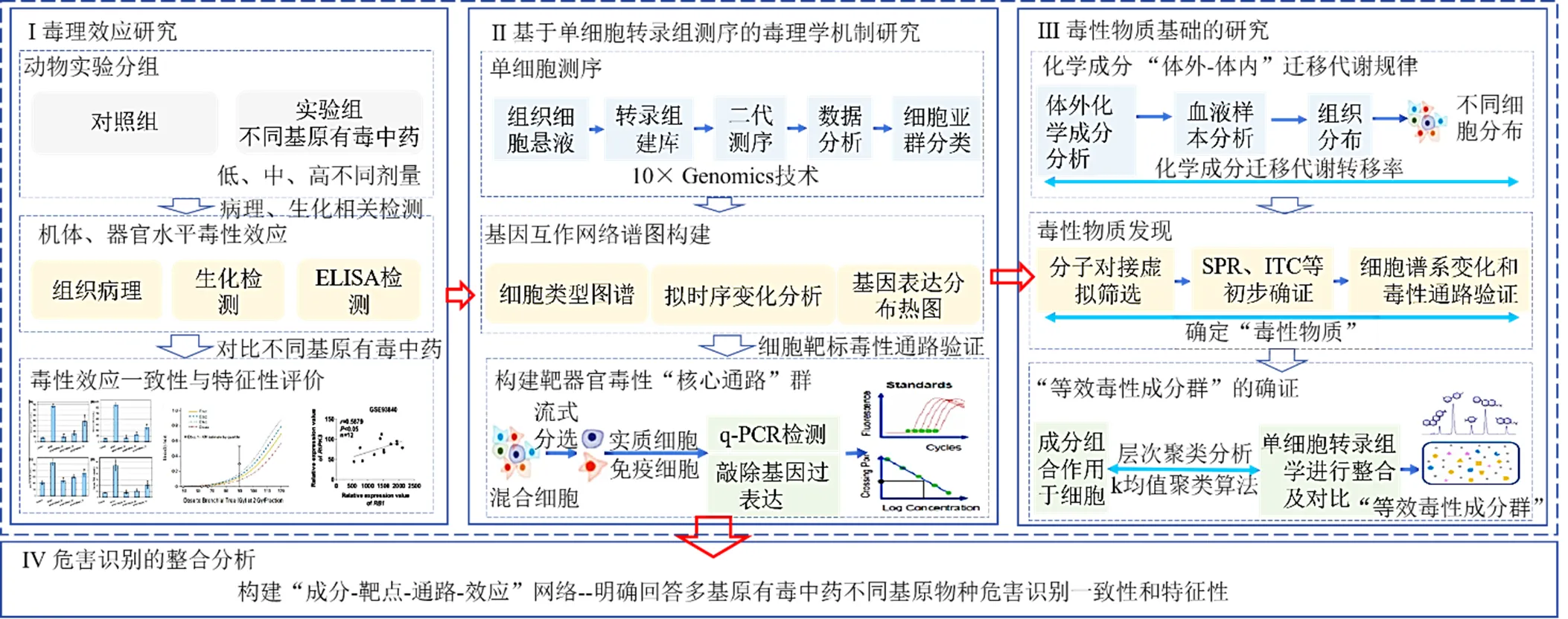
图2 基于单细胞转录组学的多基原有毒中药危害识别研究思路及方法
4.2 基于单细胞转录组测序的靶器官毒性毒理机制研究
单细胞转录组学技术可在单细胞水平分析细胞群体特征性、定义细胞类型、细胞状态和细胞的动态转变,发现转录动力学和基因调控关系。在多基原有毒中药靶器官毒性效应研究明确靶器官毒性的基础上,采用10x Genomics技术进行单细胞转录组测序,选取靶器官毒性效应明显的样本以及对照组靶器官样本,制备单细胞混悬液,将制备好的单细胞悬浮液、10x barcode凝胶磁珠和油滴经由微流体“双十字”交叉系统形成凝胶微珠乳浊液。先进行细胞裂解,凝胶珠溶解释放大量引物序列,带有多聚腺苷酸的RNA逆转录产生带有10x barcode和分子标签(unique molecular identifiers,UMI)信息的cDNA;再将油滴破碎,收集cDNA产物,进行cDNA扩增;cDNA扩增完成后酶切片段化并筛选合适片段,通过末端修复、末端修复和加A,接头连接Read2测序引物,PCR构建cDNA文库。文库质检合格后,利用Illumina测序平台进行测序。
采用CellRanger、Loupe Cell Browser等软件对单细胞数据处理并进行可视化分析。首先进行数据质控,包括整体质控、细胞基因数、线粒体基因数过滤、UMI数量与基因数量相关性分析以及基因分布。随后进行细胞聚类及可视化,采用-分布领域嵌入算法(-stochastic neighbor embedding,-SNE)及统一流形逼近与投影(uniform manifold approximation and projection,UMAP)进行单细胞降维;再进行样本/cluster差异分析,发现不同样本间的特征性,去除批次效应的影响,判断不同样本间是否存在明显的特征性。再对-SNE及UMAP聚类可视化展示的细胞类型定义结果,统计每个cluster鉴定到的细胞类型及所占百分比;采用Heatmap、Ridger Plot、Dot plot图来反映基因表达的水平,由Violin图衡量某基因作为一个子群的marker基因的特异性。采用拟时序分析毒性过程中细胞分化程度;基于基因表达量进行相关性分析以及细胞互作,经基因本体论(gene ontology,GO)功能分析、京都基因及基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析以及基因集变异分析(gene set variation analysis,GSVA)进行功能富集分析,关注靶器官毒性相关的信号通路,最终根据基因相互作用关系分别构建基因互作网络图,明确靶器官毒性的毒性通路。
为了进一步确证靶器官毒性的关键通路,以流式细胞仪分离关键通路所涉及的主要靶器官细胞,采用q-PCR方法检测关键靶点基因的表达,验证基因表达的异同。随后应用敲低、基因过表达等方法,从细胞水平出发,确定这些变化对毒性异同的直接影响,结合目的基因回补实验,观察关键蛋白对应基因改变后导致毒性结局的变化,构建靶器官毒性的“核心通路”群,从分子水平和细胞水平确定关键蛋白与毒性的关联,明确多基原有毒中药靶器官毒性的细胞靶标、关键细胞亚群及毒性通路的一致性及特征性。
4.3 基于细胞类型及靶器官毒性通路的毒性物质发现
中药成分迁移及代谢是毒性产生的关键影响因素。采用适当的提取方法分别制备不同基原物种的提取液。采用色谱-质谱联用技术重点检测文献报道的潜在毒性成分,通过不同组别进行比对,确证潜在毒性成分种类及含量的差异。以靶器官毒性效应研究中收集的组织生物样本,开展不同化学成分在血样、不同组织和经流式分选的主要靶器官细胞的检测。利用色谱-质谱技术,经方法学考察合格后,准确检测不同生物样本中潜在毒性成分的含量,明确潜在毒性成分在体外-体内全过程迁移代谢转移率。
在此基础上,分别将进入主要靶器官细胞的潜在毒性成分进行网络药理学、分子对接等虚拟筛选,初步发现其潜在直接靶标。与单细胞转录组测序发现的差异基因涉及的蛋白经String构建互作网络,Cytoscape识别网络进行分析,根据单细胞转录组测序信号通路的关键蛋白,逆向筛选关键蛋白相关联的直接靶标及对应的化学成分。随后以表面等离子共振等化学方法为手段,考察化学成分与关键蛋白的内稳态平衡解离常数(D)值,明确化学成分与筛选的关键蛋白之间亲和能力强弱,确证毒性物质及直接靶标,即为“潜在毒性物质”。毒性物质的确认还需结合细胞类型分析和毒性通路进行验证。根据“潜在毒性物质”进入主要靶器官细胞的成分含量,分别作用于经流式细胞仪分选的不同类型靶器官细胞,考察细胞类型变化以及毒性通路的调控功能,判断其对靶器官毒性的贡献度,优选贡献度较大的成分即为“毒性物质”。
4.4 “等效毒性成分群”的确认及危害识别整合分析
中药成分的种类、含量及成分比例均会影响毒性结局,需寻找能整体表征中药毒性特征的“等效毒性成分群”。为此,将筛选的毒性物质按照检测的含量及比例分别作用于相应细胞,获得多成分对细胞状态及功能的调控数据。采用聚类分析、k均值聚类算法、单因素方差分析等统计方法,与单细胞转录组进行多模式整合,根据细胞类型和毒性通路发现能表征整体毒性的“等效毒性成分群”,明确多基原有毒中药的毒性物质基础。在此基础上,对上述研究的毒性效应、毒性机制和毒性物质基础进行整合分析,构建“成分-靶点-通路-效应”网络,经纵向和横向进行比对,从危害识别的属性出发,明确多基原有毒中药多基原品种产生毒性的异同。
5 结语与展望
多基原中药的基原物种多为近缘物种,其植物形态和药材性状相似,难以准确鉴别来源。不同基原物种化学成分差异显著,毒理学数据缺乏,目前尚不能准确判断不同基原物种的临床使用风险,影响临床合理用药。本文依据中药风险控制理念,以危害识别为导向,从其三要素即毒性效应、毒性机制和毒性物质出发,考虑成分迁移代谢及相互作用,借助单细胞转录组学、体外-体内成分分析及虚拟筛选等多学科手段,提出多基原有毒中药危害识别研究思路及方法。根据多基原中药文献调研,该研究思路及方法可能会存在3种研究结果:一是毒性物质基础不同,毒性通路及效应也不同;二是毒性物质基础相同,含量差异导致毒性效应不同;三是毒性物质基础不同,但存在结构功能相似性,可能作用通路相同,毒性表现相似。在本文所建立的研究方法的基础上,如何根据可能出现的3种结果综合制定多基原有毒中药的风险控制指标与标准,仍需进一步深入研究,以最终为多基原有毒中药的风险评估提供数据,保证临床安全用药。
利益冲突 所有作者均声明不存在利益冲突
[1] 姚玲, 申俊龙, 李洁. 基于进口鼓励国际化视野的中药资源“一带一路”国际贸易趋势研究 [J]. 中草药, 2019, 50(14): 3510-3516.
[2] 程翼宇, 钱忠直, 张伯礼. 创建以过程管控为核心的中药质量控制技术体系 [J]. 中国中药杂志, 2017, 42(1): 1-5.
[3] 刘昌孝, 张铁军, 黄璐琦, 等. 发展监管科学, 促进中药产业传承创新 [J]. 药物评价研究, 2019, 42(10): 1901-1912.
[4] 雷海民. 监管科学助力中药监管能力升级[N]. 中国医药报, 2020-07-06(1).
[5] 李菲菲, 吴倩文, 顾昱昊, 等. 中医药防治新冠肺炎疫情现状引发的对中药监管科学的一些思考 [J]. 中国食品药品监管, 2020(3): 10-21.
[6][M]. World Health Organization, 2012: A-18.
[7] 左甜甜, 王莹, 张磊, 等. 中药中外源性有害残留物安全风险评估技术指导原则 [J]. 药物分析杂志, 2019, 39(10): 1902-1907.
[8] 金红宇, 王莹, 刘丽娜, 等. 以“风险控制”为核心推进中药质量安全标准建设 [J]. 中国药品标准, 2017, 18(6): 408-410.
[9] 聂黎行, 钱秀玉, 蒋沁悦, 等. 中成药中重金属及有害元素残留分析、风险评估和限量制定建议[J]. 药学学报, 2020, 55(11): 2695-2701.
[10] 朱晓东. 6种常用中药中重金属含量、形态分析与风险评价研究 [D]. 乌鲁木齐: 新疆医科大学, 2020.
[11] 田文杨, 兰姗, 张力, 等. 补骨脂的安全性评价与风险控制措施探讨 [J]. 中国中药杂志, 2017, 42(21): 4059-4066.
[12] 陈丹, 高学敏, 张力, 等. 山豆根的安全性评价与风险控制措施的探讨 [J]. 中国中药杂志, 2017, 42(21): 4086-4092.
[13] 王丹, 贾德贤, 李真真, 等. 淫羊藿的安全性评价与风险控制措施探讨 [J]. 中国中药杂志, 2019, 44(8): 1715-1723.
[14] 张雪, 彭富全, 何风雷, 等. 含雷公藤甲素中药的风险控制 [J]. 中成药, 2019, 41(7): 1667-1671.
[15] 田婧卓, 梁爱华, 刘靖, 等. 从马兜铃酸含量影响因素探讨含马兜铃酸中药的风险控制 [J]. 中国中药杂志, 2017, 42(24): 4679-4686.
[16] 石典花, 张军, 孙立立. 基于3种多基源饮片质量考察谈等量性研究的必要性 [J]. 中华中医药杂志, 2018, 33(1): 320-324.
[17] 羊菲, 金若敏. 基于中药特点的肝毒性研究与思考 [J]. 上海中医药大学学报, 2020, 34(1): 1-10.
[18] Tang F C, Barbacioru C, Wang Y Z,. mRNA-Seq whole-transcriptome analysis of a single cell [J]., 2009, 6(5): 377-382.
[19] The biology of genomes. Single-cell sequencing tackles basic and biomedical questions [J]., 2012, 336(6084): 976-977.
[20] Method of the year 2013 [J]., 2014, 11(1): 1.
[21] 过冬冬, 孙芬, 贺轩昂, 等. 单细胞测序技术在肝脏疾病的应用与展望[J]. 生物技术通报, 2021, 37(1): 137-144.
[22] Potter S S. Single-cell RNA sequencing for the study of development, physiology and disease [J]., 2018, 14(8): 479-492.
[23] Mathys H, Davila-Velderrain J, Peng Z Y,. Single-cell transcriptomic analysis of Alzheimer’s disease [J]., 2019, 570(7761): 332-337.
[24] Zhang M, Yang H, Wan L,. Single-cell transcriptomic architecture and intercellular crosstalk of human intrahepatic cholangiocarcinoma [J]., 2020, 73(5): 1118-1130.
[25] Croft A P, Campos J, Jansen K,. Distinct fibroblast subsets drive inflammation and damage in arthritis [J]., 2019, 570(7760): 246-251.
[26] Zhang P, Yang M R, Zhang Y D,. Dissecting the single-cell transcriptome network underlying gastric premalignant lesions and early gastric cancer [J]., 2020, 30(12): 4317.
[27] 赵蔚波, 王琦, 郑燕飞, 等. 应用单细胞测序技术进行中医体质研究探讨 [J]. 天津中医药, 2019, 36(10): 942-945.
[28] Liang Q, Qu Z P, Liang Y,.alters expression of energy metabolism genes and prevents cell death in high-glucose loaded mouse embryos [J]., 2018, 2018: 2409471.
[29] Borcherding N, Voigt A P, Liu V,. Single-cell profiling of cutaneous T-cell lymphoma reveals underlying heterogeneity associated with disease progression [J]., 2019, 25(10): 2996-3005.
[30] Zheng H P, Pomyen Y, Hernandez M O,. Single-cell analysis reveals cancer stem cell heterogeneity in hepatocellular carcinoma [J]., 2018, 68(1): 127-140.
[31] Wang W, Wang X D. A refocus on the advances of single-cell biomedicine [J]., 2020, 36(5): 395-398.
[32] Zhang Q, Caudle W M, Pi J B,. Embracing systems toxicology at single-cell resolution [J]., 2019, 16: 49-57.
[33] Sun R L, Xu K, Ji S B,. Toxicity in hematopoietic stem cells from bone marrow and peripheral blood in mice after benzene exposure: Single-cell transcriptome sequencing analysis [J]., 2021, 207: 111490.
[34] Zhang B Y, Dai Y Q, Zhu L Y,. Single-cell sequencing reveals novel mechanisms of aflatoxin B1-induced hepatotoxicity in S phase-arrested L02 cells [J]., 2020, 36(6): 603-608.
[35] Kim D, Kobayashi T, Voisin B,. Targeted therapy guided by single-cell transcriptomic analysis in drug-induced hypersensitivity syndrome: A case report [J]., 2020, 26(2): 236-243.
[36] Liu Y, Ai N, Liao J,. Transcriptomics: a sword to cut the Gordian knot of traditional Chinese medicine [J]., 2015, 9(11): 1201-1213.
[37] Li C N, Lan M, Lv J,. Screening of the hepatotoxic components inand their effects on rat liver BRL-3A cells [J]., 2019, 24(21): E3920.
[38] Gu Y, Lu J, Sun W,.Oxymatrine and its metabolite matrine contribute to the hepatotoxicity induced by radix in mice [J]., 2019, 17: 2519-2528.
[39] 彭成, 肖小河, 李梢, 等. 中药“毒与效”整合分析的研究进展和前沿分析 [J]. 中国科学基金, 2017, 31(2): 176-183.
[40] Wang X, Li Y, Chen M L,. Stepwise rapid tracking strategy to identify active molecules fromsonchifolia Hance based on “affinity mass spectrometry-atomic force microscopy imaging” technology [J]., 2020, 217: 121031.
[41] Shi W, Zhang C, Zhao D,. Discovery of hepatotoxic equivalent combinatorial markers fromTuber by fingerprint-toxicity relationship modeling [J]., 2018, 8(1): 462.
Research ideas and methods of hazards identification of multi-base source toxic traditional Chinese medicine based on single cell transcriptomics
YANG Bin1, LI Yu-bo1, ZHANG Yan-jun2
1. School of Traditional Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Currently, Chinese Pharmacopoeia Commission has adopted the risk assessment strategy to carry out the limited control of exogenous hazards of traditional Chinese medicine (TCM) and gradually carried out the risk management of endogenous toxic compounds in TCM. Chemical composition of multi-base source TCM is significantly different and whether the safety of the “same medicinal product” is consistent still lack of scientific explanation. This brings great challenges to hazard identification, which is the first step of risk assessment. There are two key problems in multi-base source toxic TCM. First, the toxicity mechanism is rarely reported and lack of comprehensive consideration of the toxicity in multiple pathways and various cells in condition of information fragmentation. Second, the basis of toxic substances is not clear, and there is a lack of “equivalent toxic composition group” that can characterize the toxicity of TCM as a whole. Therefore, ideas and methods of hazards identification of multi-base source toxic traditional Chinese medicine based on single cell transcriptomics are proposed to establish in this article, in order to provide technical support for the construction of toxic TCM risk assessment system.
multi-base source; toxic traditional Chinese medicine; risk assessment; hazards identification; single cell transcriptomics
R285.53
A
0253 - 2670(2021)13 - 3783 - 07
10.7501/j.issn.0253-2670.2021.13.001
2020-11-25
国家自然科学基金青年项目(82004225);天津市人才发展特殊支持计划-高层次创新创业团队
杨 彬(1987—),男,实验师。E-mail: yang3023008@163.com
李遇伯(1978—),女,教授,博士生导师,研究方向为中药安全性评价研究。E-mail: yuboli1@163.com
张艳军(1967—),男,教授,博士生导师,研究方向为中药药理及安全性评价研究。E-mail: zyjsunye@163.com
[责任编辑 崔艳丽]