益生菌对脂多糖诱发大鼠脑内神经炎症及认知功能障碍保护作用的实验研究
李正民,李江静,庄莹莹,闫 辉,刘伟娜,屈丽虹
(空军军医大学唐都医院麻醉科,陕西 西安 710038)
神经退行性变目前已成为我国老年人群中主要的致残致死原因之一,包括阿尔茨海默病(Alzheimer disease,AD)、帕金森病等在内的疾病,由于其发病机制不明,目前尚无治愈这些疾病的药物,因此神经退行性病的发病机制和治疗靶点一直是国内外学者的研究热点之一。已有研究证实神经退行性变其本质是神经慢性炎症,从炎症入手或许是可以解开神经退行性病的一把钥匙。AD俗称老年性痴呆或认知障碍,是老年人常见的中枢神经系统退行性疾病[1]。在动物模型中的一项实验研究表明,细菌脂多糖(Lipopolysaccharide,LPS)注射到大脑的第四脑室中,可以重现AD中的许多炎症和病理特征[2],而且又有研究表明腹腔注射LPS可引起小鼠海马区域淀粉样β蛋白沉积进而导致小鼠认知功能障碍[3],因此腹腔注射LPS可模拟AD样病理改变,是一种可用于研究AD相关的神经炎症和随后神经功能障碍合适的动物模型[4-5]。
近年来,越来越多的研究表明,人类共生微生物是影响宿主健康的重要环境因素。大约95%的共生微生物位于肠道,它们在人类营养、消化、神经营养、炎症、生长、免疫和抵御病原体感染方面发挥着重要作用[3]。在众多的肠道微生物中,乳酸菌、双歧杆菌和肠球菌已被证明可以通过改善肠道微生物平衡而对宿主产生有益的影响,因此被归类为益生菌[4]。本实验通过腹腔注射LPS模拟神经炎症[4-5],利用口服益生菌的干预方式,观察益生菌是否对LPS所致的认知障碍起保护作用,是否会减轻神经炎症的产生,为神经炎症以及神经退行性病变的防治研究提供进一步实验基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康成年雄性SD大鼠共32只,体重220~250 g,购自第四军医大学动物中心,自由饮食,12 h明暗循环。
1.1.2 主要仪器与试剂:水迷宫视频分析系统WMT-1005(成都泰盟),酶标仪(Bio-Rad),肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、一氧化氮合酶(iNOS)酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技有限公司)。益生菌(LACTIBIANE,Store Houses,B.V.),脂多糖(Sigma),兔抗BDNF单克隆抗体(Abcam),小鼠抗GAPDH单克隆抗体(Abcam),GE9612T-S基因扩增仪(杭州柏恒科技有限公司),Line Gene 9640 荧光定量 PCR 仪(杭州博日科技有限公司)。总RNA 抽提纯化试剂盒(上海生工生物工程股份有限公司),Real Time PCR 反转录试剂盒(TAKARA), 实时荧光定量 PCR 反应试剂盒(TAKARA)。
1.2 实验方法
1.2.1 实验模型和分组:将大鼠随机分为四组,每组8只。对照组:大鼠灌胃2 ml生理盐水,连续3周。LPS组:大鼠灌胃2 ml生理盐水连续3周,自第3周开始,生理盐水灌胃处理后腹腔注射LPS,剂量为250 μg/(kg·d),连续1周。LPS+益生菌组:将乳酸杆菌(Lactobacillus)溶于生理盐水中,制备成浓度为5×107CFU/ml 的益生菌悬液,取2 ml益生菌悬液灌胃,即108CFU/d,连续3周灌胃给药,自第3周开始益生菌悬液灌胃处理后腹腔注射LPS,剂量为250 μg/(kg·d),连续1周。益生菌组:取2 ml益生菌悬液灌胃,即108CFU/d,连续3周灌胃给药,观察该益生菌悬液对健康成年大鼠神经系统及认知功能是否有影响。
1.2.2 行为学实验方法:开始LPS腹腔注射的第2天即开始水迷宫学习行为训练。水迷宫采用直径为1.5 m、高为0.5 m的圆形的黑色水池,并且在水池壁内测贴有不同颜色、不同形状的图案作为标志。开始训练时,在池中加入黑色墨水,使水不透明,水温保持(25±1)℃。调节合适的实验室亮度,保持实验室周围环境安静舒适。在某一象限内放置一个直径约为10 cm的有机玻璃平台,置于水面下约1 cm。水迷宫行为学实验分为两个阶段,即训练学习阶段和测试阶段。训练学习阶段为期5 d,每天将每组大鼠(n=8)从四个象限设定好的位置分别放入水中,直到大鼠找到水下的平台,并在平台上保持停留15 s,如果大鼠在60 s内未找到平台,实验员应将其引导至平台上并停留15 s。行为学训练后第6天为测试阶段,移去水下的平台,观察大鼠60 s内通过平台所在区域的次数及首次达台时间。所有实验都通过摄像头录像,并通过电脑图像分析软件进行分析。
1.2.3 酶联免疫吸附试验(ELISA):接受行为学测试后的大鼠立即麻醉,断头,取出大脑组织,并分离出大脑皮层组织,立即置于液氮速冻后放于-80 ℃冰箱保存。之后取出冷冻大脑皮层组织,在低温环境下进行组织匀浆,离心后取上清液,用ELISA试剂盒测定TNF-α、IL-1β、IL-6、iNOS的水平。先制备标准品(倍比稀释,浓度参照说明书),随后按序依次加样,设立标准孔、空白孔、待测样品孔,100 μl/孔,轻晃混匀,37 ℃孵育90 min,之后加入生物素化抗体工作液(1∶100),100 μl/孔,37 ℃孵育60 min,洗板3次,加入酶结合物工作液(1∶100),100 μl/孔,37 ℃孵育30 min,洗板5次,加入底物溶液,90 μl/孔,37 ℃避光孵育15 min左右,加入终止液50 μl/孔,570 nm波长测OD值,计算浓度。
1.2.4 蛋白免疫印迹(Western blot):从-80 ℃冰箱取出已经冷冻的皮层额叶组织低温下匀浆提取蛋白,BCA法进行蛋白定量,沸水煮10 min待用。各组取样品30 μg,以样品中的GAPDH作为内参,经SDS-PAGE凝胶电泳,转膜,然后用5%脱脂奶粉TBST液室温封闭1 h,根据各蛋白分子量不同,将膜剪裁开,分别放入按比例配制好的一抗中(兔抗BDNF单克隆抗体,小鼠抗GAPDH单克隆抗体),置于4 ℃冰箱中孵育过夜。TBST洗膜5次,每次5 min,分别放入对应二抗中,室温孵育1 h。洗膜5次,每次5 min,之后化学发光发荧光显色。
1.2.5 聚合酶链反应(PCR) :将动物注射麻醉后,处死,取出脑组织,剪碎浸入5~10倍体积的RNA GUARD液中并置入4 ℃冰箱过夜后移入-20 ℃冰箱中保存备用。注意此步骤动作一定要非常迅速,以尽可能避免组织中的降解。按照步骤依次提取组织总RNA,合成cDNA第一链及进行扩增。PCR扩增反应条件为:将反应体系混匀后短暂离心混匀,反应液于94 ℃预变性10 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min;完成40个循环后72 ℃充分延伸5 min。委托上海英骏生物技术有限公司设计与合成引物:脑源性神经营养因子(BDNF)-F(bp577):5’-CTGGAGAAACTCCCGGTATC-3’,BDNF-R(bp711c):5’-GGTAGTTCGGCATTGCGAGT-3’。

2 结 果
2.1 各组LPS导致的认知功能障碍比较 在水迷宫定位航行试验中训练第1天时,LPS组大鼠潜伏期长于对照组大鼠,两组比较差异有统计学意义(P<0.05)。大鼠在水迷宫训练至第5天时,LPS+益生菌组大鼠潜伏期短于LPS组大鼠,两组比较差异有统计学意义(P<0.05,图1A)。水迷宫空间探索实验结果显示:与对照组相比,LPS组大鼠首次达台时间延长,穿越平台次数减少,差异有统计学意义(P<0.05),而LPS+益生菌组大鼠与LPS组大鼠相比,LPS+益生菌组大鼠首次达台时间缩短,穿越平台次数增多,差异有统计学意义(P<0.05,图1B)。
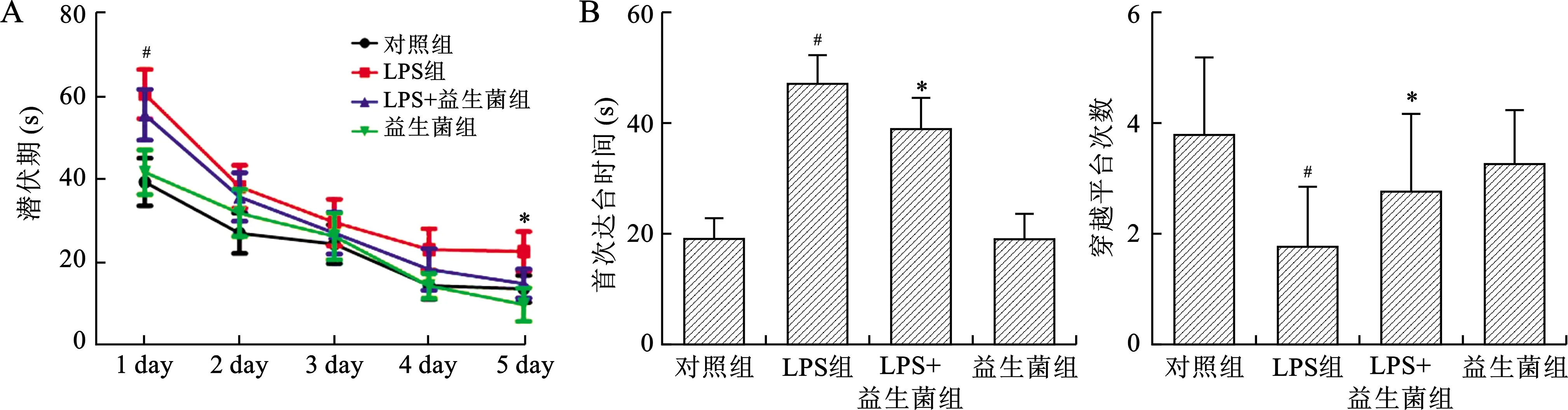
A:各实验组大鼠水迷宫定位航行实验中训练潜伏期统计结果;B:各实验组大鼠水迷宫空间探索实验中首次达台时间与穿越平台次数统计结果
2.2 各组大鼠大脑皮层组织促炎因子水平比较 ELISA实验结果显示:与对照组相比,LPS组大鼠大脑皮层组织TNF-α、IL-1β、IL-6、iNOS水平升高,差异有统计学意义(均P<0.05),而LPS+益生菌组与LPS组相比,TNF-α、IL-1β、IL-6、iNOS水平降低,差异有统计学意义(均P<0.05),见表1(图2)。

表1 各组大鼠大脑皮层组织促炎因子水平比较
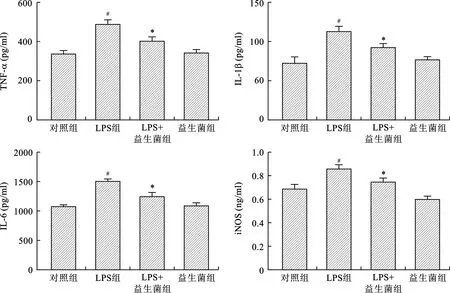
注:与对照组相比,#P<0.05;与LPS组相比,*P<0.05
2.3 各组大鼠大脑皮层BDNF表达水平比较 与对照组相比,LPS组大鼠大脑皮层组织BDNF表达水平降低,差异有统计学意义(P<0.05),而LPS+益生菌组与LPS组相比,BDNF表达水平升高,差异有统计学意义(P<0.05);qt-PCR结果与Western blot结果一致,见表2(图3)。

表2 各组大鼠大脑皮层BDNF表达水平比较

A:大鼠大脑皮层对BDNF的表达Western blot及统计结果;B:大鼠大脑皮层对BDNF的qt-PCR结果统计。与对照组相比,#P<0.05;与LPS组相比,*P<0.05
3 讨 论
本研究聚焦于益生菌对LPS所致大鼠神经炎症及认知功能的影响,实验结果显示,腹腔注射LPS导致大鼠学习记忆能力下降,表现出认知功能障碍,而益生菌可以改善LPS所致的大鼠认知功能障碍,提高其空间学习记忆能力,并且降低LPS所致大鼠大脑皮层组织TNF-α、IL-1β、IL-6、iNOS的表达,升高BDNF的表达,减轻神经炎症反应[6-7]。
有证据表明肠道微生物群与中枢神经系统(CNS)之间存在双向联系,存在肠-脑轴[8]。事实上,肠道菌群组成的改变可能在一些神经系统疾病的发病机制中起关键作用[9]。在这一方面,益生菌的使用是一个有趣、可行的方法平衡肠道菌群的组成,从而对宿主健康产生有益的影响[10]。大量研究表明,含益生菌的口服细菌疗法对各种神经系统疾病有多种益处。近期,也有报道称益生菌补充乳酸菌和双歧杆菌通过抗炎、抗氧化和神经保护作用对神经退行性疾病有积极的影响[11]。已有研究表明,LPS可激活中枢神经系统中toll样受体4 (TLR4)信号,该信号与神经胶质细胞和各种神经炎症介质的激活有关,最终导致神经元凋亡[12]。神经炎症与认知障碍和记忆衰退有关,因为在炎症期间,海马体更容易在突触传递和可塑性方面发生变化[13]。已有研究结果证实了益生菌的有益作用,增强肠上皮完整性,保护屏障不受破坏,减少促炎反应,抑制神经炎症和神经变性的起始或增殖。例如,它已被证明无论在体外还是在大脑中,肠球菌都有效,乳杆菌减少TNF-α生产和补充这些益生菌菌株在动物实验中减少氧化应激和诱导抗氧化酶的产生[14]。本研究实验结果也证实了上述观点。
BDNF是表达最广泛、研究最密切的神经营养因子之一,在结构上与神经生长因子、神经营养因子-3和神经营养因子-4相关,调节特定神经元群体的生存能力和功能完整性[15]。BDNF参与中枢神经系统内的多种功能,包括神经元存活和分化[16],而BDNF水平的变化可能通过突触传递功能障碍和可塑性导致认知缺陷,导致精神分裂症相关的化学和结构失衡[17]。与对照组相比,小鼠海马特异性缺失BDNF会导致新的物体识别和空间学习障碍[18]。在水迷宫中测试时,发现BDNF基因单拷贝缺失小鼠的学习能力明显受损,需要的训练时间是野生型小鼠的两倍。本文实验结果发现LPS导致大鼠脑内BDNF表达下降,而口服益生菌可增加BDNF的表达。而已经有学者认为益生元和益生菌作为认知障碍的潜在治疗方法[19],因为肠道微生物群可以通过改变神经递质的功能来调节中枢神经系统中的BDNF功能,比如通过影响kynurenine通路等调节机制,或者通过改变大脑中的短链脂肪酸(SCFAs)的可用性和作用[15]。
有学者提出饮食干预是改变肠道菌群最有效的方法之一[20],基于我们的研究结果,益生菌因其有效的抑炎作用可以作为神经炎症及神经退行性疾病的防治方法之一,并且其抑炎作用确实改善了LPS引起的认知功能障碍。综上所述,益生菌可以通过抑制炎症反应而对LPS诱发大鼠认知功能障碍起到保护作用。这一结论为益生菌对神经炎症的防治提供了进一步的实验基础,为进一步探索益生菌抑炎作用提供了方向。

