要题发散上好复习课——以难溶电解质的溶解平衡计算教学为例
安徽 董 顺
化学复习课是巩固学生基础知识、发展学生化学核心素养的重要阵地。复习的任务在于提高学生的思维品质和学习能力,把握化学知识的整体结构和内在规律,并运用所学知识解决实际问题。
在当前的高三复习中存在着“重知识轻思维”的倾向,这一点在一轮复习中最为明显,很多教师将精力集中于基础知识的梳理,轻视了学生从已有认识中提炼新知识和思想的过程。“要题发散”式教学,即利用典型高考试题作为复习课的教学资源,围绕“要题”精心设计问题,组织学生开展学习活动,使相关化学知识自然生成,进而揭示化学的本质内涵,打造简约而高效的化学课堂。
难溶电解质的溶解平衡是近年高考的重点内容,高考中出现的频率较高,而且运算量较大,而现今中学生运算能力普遍欠缺,下面以难溶电解质的溶解平衡计算教学为例简述“要题发散”式教学在复习课中的应用。

( )


【答案】C
【解析】当开始形成沉淀时Qc=Ksp
Cl-开始沉淀所需Ag+浓度为:
Br-开始沉淀所需Ag+浓度为:
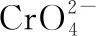

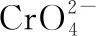
【发散1】Cl-开始沉淀时,溶液中c(Br-)为多少?
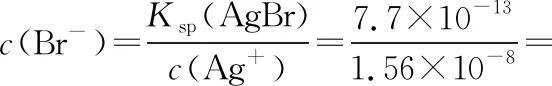




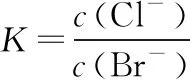
【发散4】向1 mL AgBr饱和溶液中滴加1 mL 0.2 mol·L-1NaCl溶液,能生成AgCl沉淀吗?
【解析】设AgBr饱和溶液的浓度为xmol·L-1,
则AgBr饱和溶液中c(Ag+)=c(Br-)=xmol·L-1
Ksp(AgBr)=c(Ag+)·c(Br-)=x2

混合后c(Ag+)=4.4×10-7mol·L-1,c(Cl-)=0.1 mol·L-1
Qc(AgCl)=c(Ag+)·c(Cl-)=4.4×10-8>Ksp(AgCl)
因此,有AgCl沉淀生成。
【思考】Ksp小的难溶电解质能否转化为Ksp稍大的难溶电解质?
【发散4】说明当两难溶电解质Ksp相差不太大时,难溶的电解质也能够转化为稍易溶的电解质。
【发散5】计算该温度下AgBr的溶解度。(g/100 g H2O)
【解析】由【发散4】知,该温度下AgBr饱和溶液的浓度为8.8×10-7mol·L-1,忽略溶质AgBr的体积,近似为1 L 水中溶解8.8×10-7mol AgBr,即1000 g水中溶解AgBr的质量为8.8×10-7mol×188 g·mol-1=1.65×10-4g,故AgBr的溶解度为S=1.65×10-5g。
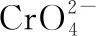
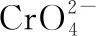
【发散7】已知Ag2CrO4为砖红色沉淀,AgCl为白色沉淀,AgBr为淡黄色沉淀,若用AgNO3标准溶液滴定溶液中Cl-的含量,是否能用KBr或K2CrO4作指示剂。

【答案】(3)2.0×10-55.0×10-3
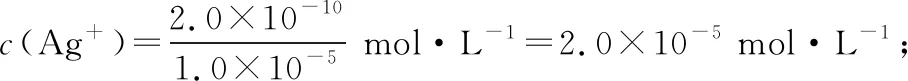
【过渡】以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中Cl-,可以绘制出与酸碱中和滴定曲线类似的曲线。
【例3】(2018·全国卷Ⅲ·12)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图1所示。下列有关描述错误的是

图1
( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动
【答案】C

【讲解】本题的滴定曲线与NaOH标准溶液滴定HCl溶液所得的中和滴定曲线类似,在NaOH滴定盐酸的中和滴定曲线中,横坐标为V(NaOH),纵坐标为pH,即-lgc(H+),而本题横坐标为V(AgNO3),纵坐标为-lgc(Cl-),滴定的理论终点都应该是恰好反应的点,酸碱中和滴定是酸碱恰好中和过程中满足c(H+)·c(OH-)=Kw,沉淀滴定就是恰好沉淀完全,过程中满足c(Ag+)·c(X-)=Ksp(AgX)。
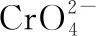

【答案】4.7×10-7
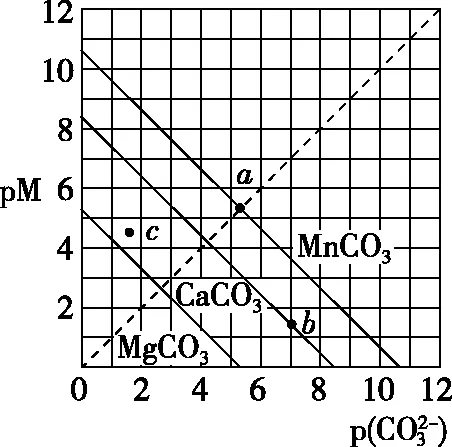
图2
( )
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
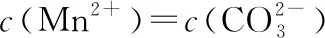


【答案】A
高三化学复习应兼顾知识点的全面性和题型的多样性,因此复习方法也应该多样化,以针对不同的复习内容和不同学生的实际学情。教师在要题的选择与发散上应精心思考,引导学生从变化的现象中发现不变的本质,从不变的本质中探求变化的规律,使学生解题的技巧自然掌握,知识点融会贯通。


