树立证据推理意识 培养高阶思维能力——以“盐类水解”单元复习片段为例
安徽 曹 君
高中教学的目的是培育学生的学科核心素养,学科核心素养是指学生应具备的适应终身发展和社会发展所需要的必备品格和关键能力。新一轮课程改革在新高考改革的引领下如火如荼的进行着,很多化学高考题需要学生解决真实情境中的实际问题,从而让学生由传统的解题变为解决问题,迫使高中教学的改变,在课堂上除了知识的传授之外,更要培养学生的学科核心素养。设计大单元教学,通过挑战性的主题复习,使学生从开始学习时掌握的单个知识点,组成线,形成面,从而形成知识结构网络,使学生从单点思维、多点思维等低阶思维水平上升至多点关联结构水平,甚至培养学生思维拓展等高阶思维能力,从而让学生真正掌握必备知识,具备解决实际问题的关键能力。教科书及教辅上不缺少结论,但缺少论证的过程;不缺少实验习题,但缺少实验具体操作。反应原理中有很多概念,学生们容易迷失,故笔者以复习盐类水解时学生们容易混淆的两个挑战性问题作为主题进行教学,通过带领学生进行探究、论证,从而促进化学学科核心素养在课堂落地生根。
一、培养证据推理意识,形成关联性思维
学生在学习水解相关理论时,对溶液体系的核心知识的掌握是零散的,学生的思维也是处于单点思维阶段,在遇到问题时,往往顾此失彼。在复习到温度对盐类水解的影响时,学生们往往仅会考虑温度对水溶液中的弱酸阴离子或弱碱阳离子水解的影响,很难关联起温度对水的电离即水的离子积的影响,为此笔者提出一个问题:温度升高时,Na2CO3溶液的pH如何变化?


图1 1.0 mol·L-1碳酸钠溶液pH随温度变化曲线
通过学生参与实验,可得到与图1类似的图像,如果没有办法完成该实验,可以直接以信息的形式给学生展示图1。从图中可以看见溶液的pH先增大后减小,并不是随着温度的升高而一直增大。图像冲击了学生固有的思维模式,学生对以往记忆中“越热越水解”产生了质疑,通过小组讨论,学生得出在该溶液中除了碳酸钠的水解对溶液pH有影响之外,还有一个重要的因素,就是温度对水的电离常数的影响,这两个因素学生都已掌握,但是在处理问题时,学生思维可能还是停留在单点思维阶段,不能相互关联,通过实验数据的分析,学生们可以发现温度升高时,溶液pH并不是一定升高,从而引导学生更深层次的思考问题,进而培养学生证据推理的意识。学生通过碳酸钠浓溶液中的实验现象理解了温度与pH的关系之后,其稀溶液中pH随温度如何变化呢?笔者设计了如下习题检测学生复习的效果,训练其思维能力。
【练习1】对0.10 mol·L-1的碳酸钠溶液加热,利用传感器测定溶液的温度和pH,结果如图2所示,下列对实验结果的分析不正确的是
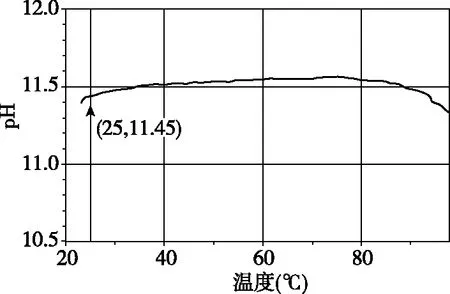
图2 0.1 mol·L-1碳酸钠溶液pH随温度变化曲线
( )
B.随着温度升高,溶液中c(OH-)先增大后减小
D.溶液pH减小的原因是:加热促进水的电离,Kw随温度升高而增大
【答案】B
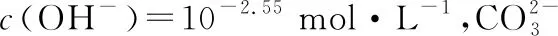
根据对上述两个图像的分析,可以得出碳酸钠溶液的pH受多个因素影响,如果仅以溶液pH的大小来判断碳酸钠的水解程度是不科学的。碳酸钠溶液中的情况学生们已经清楚知道了,其他的强碱弱酸盐水溶液的pH随温度如何变化呢?图3是1.0 mol·L-1醋酸钠溶液的pH随温度变化的曲线:
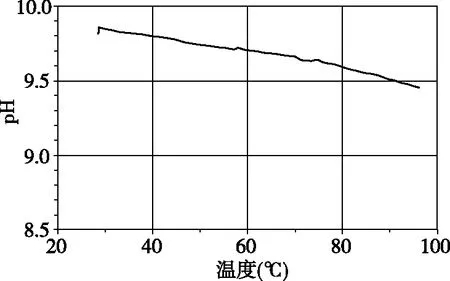
图3 1.0 mol·L-1醋酸钠溶液pH随温度变化曲线
醋酸钠溶液的pH随温度的升高逐渐减小,可以让学生思考,曲线为何呈现图3中的变化趋势。综上,我们可以得出强碱弱酸盐的水溶液在温度升高时,弱酸阴离子水解程度增大,溶液中氢氧根浓度在增大,但水的离子积常数也在增大,且溶液中氢离子浓度也在增大,所以无法确定溶液pH的变化情况。对于溶液显酸性的强酸弱碱盐溶液来说,升温的结果一定导致其pH变小。因为,在该溶液中不再有水的离子积变化的干扰,升温对水解平衡常数及弱碱阳离子的水解程度的影响是一致的,都有利于使溶液中氢离子浓度的增大使溶液pH减小。如果学生能自己分析得出结论,说明学生的思维层次进入到了思维拓展这一个高阶阶段。
通过挑战性的问题及数字化实验,可以帮助学生提高思维的深度。学生不会再简单地说水解程度越大,溶液pH就增大或减小,而是综合分析温度对盐类水解及水的电离的影响程度再得出结论,具体结果可通过实验测定,或者理论计算得出,从而培养学生的证据推理意识。
二、培养模型认知能力,形成辩证性思维

【实验】
量取 3 mL 1 mol·L-1FeCl3溶液于试管中,逐滴加入1.0 mol·L-1Na2SO3溶液。试管中的实验现象为:溶液由橘黄色变为红褐色并有沉淀生成,振荡后沉淀消失,继续滴加Na2SO3溶液,溶液颜色加深,放置一小时后溶液变为绿色(为了课堂安排的更紧凑,通过录像播放了提前做过的该实验视频,本节课结束时溶液已基本变为绿色)。
该实验现象冲击了学生的认知体系,帮助学生调用起氧化还原思维模型,氯化铁具有氧化性,亚硫酸钠既有氧化性又有还原性。在本实验中,开始有沉淀,振荡后沉淀消失,最后试管中溶液变为绿色,说明FeCl3溶液与Na2SO3混合时,存在双水解,同时因氯化铁显氧化性、亚硫酸钠显还原性,而发生了氧化还原反应,两个反应存在竞争关系。反应开始阶段水解占有优势,是因为溶液中离子发生复分解反应时活化能比较低,从反应动力学角度看,由反应开始时可见红褐色沉淀生成可知,水解反应速率较快,氧化还原反应活化能要大得多,反应速率一般比较小;但从反应热力学角度看,溶液最终呈绿色则证明氧化还原反应的趋势更大。通过实验探究得到的宏观现象找到证据,进一步思考微观分析沉淀为什么会溶解,溶液为什么会变成绿色,最后可以用离子方程式表征出整个过程中离子间可能发生的化学反应。
类似的氧化还原与水解反应竞争的反应还有很多,比如常见的物质硫化钠溶液与氯化铁溶液混合后,滴加的先后顺序不同,量不同,得到的实验现象也不相同,教师可以带领学生改变二者的浓度,改变加入先后顺序,进行实验探究,通过反应条件的改变,使化学反应向我们期望的方向进行,让学生知道化学反应是可以调控的,帮助其形成辩证性思维,防止学生出现非黑即白地看待问题。
在高三一轮复习时,各位教师应打破模块之间的壁垒,实现教学内容的重构。要抓住知识的重点、难点和关键点,了解学生学习的盲点和思维障碍,对教学内容进行合理安排,设计出真实性、趣味性、探究性、开放性的问题,激发学生的认知冲突,培养学生独立分析问题、解决问题的能力,促进高阶思维的形成。通过大单元教学,向综合性、信息性、实验性的方向转变。依据学生的认知水平,设计一系列有层次的挑战性问题,引导学生深度思考,并通过实验培养学生寻找证据和解释证据的能力,建立起解决相关问题的模型,不断修正并优化模型,从而解决实际生产及生活中遇到的真正的问题,或解释问题能趋近问题的本质。这正是本轮高考改革和课程改革的呼唤。

