关注碳排放 关注CO2的综合利用——以2020—2021年高考真题为例
江西 张万程 管晓玲
近年来,由于全球经济的快速发展,工业化和城市化进程快速推进,全球CO2排放量持续增加,由CO2排放带来的全球环境问题日益引起国际社会的广泛关注。中国政府在第七十五届联合国大会上提出:“中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。CO2是初中化学的重要知识点,内容涉及CO2的制备、性质、检验、除杂、用途及其对环境的影响等,高中化学以初中所学碳及其化合物知识为基础,对碳族元素及其化合物进行更深入的学习,对于涉及CO2的知识,较多学生还停留在初中的知识水平,但在历年的高考试题中,以CO2为载体的试题几乎每年均有涉及,本文对CO2可关联的知识点进行归纳,并对2020年真题进行例析,望后期对备考师生有所帮助。
一、知识归纳总结
1.CO2的分子结构:

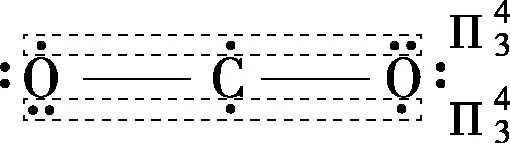
2.CO2的物理性质:
CO2是无色、无味、无毒的气体,不助燃,空气中CO2含量达到2.5%时,火焰会熄灭。高度冷却下,CO2凝结为白色雪状晶体,压缩成块状的CO2固体称为“干冰”,分子晶体,可做制冷剂,常用于人工降雨。CO2的临界温度为304 K,加压可液化,在该温度下,可作为优良溶剂进行超临界萃取。
3.CO2的制法:


4.CO2的化学性质:
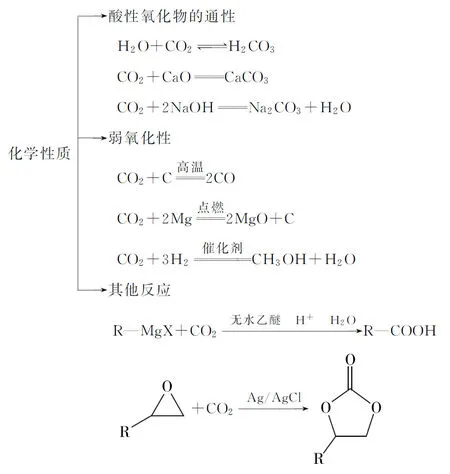
图1
二、2020—2021年高考中涉及CO2的考查
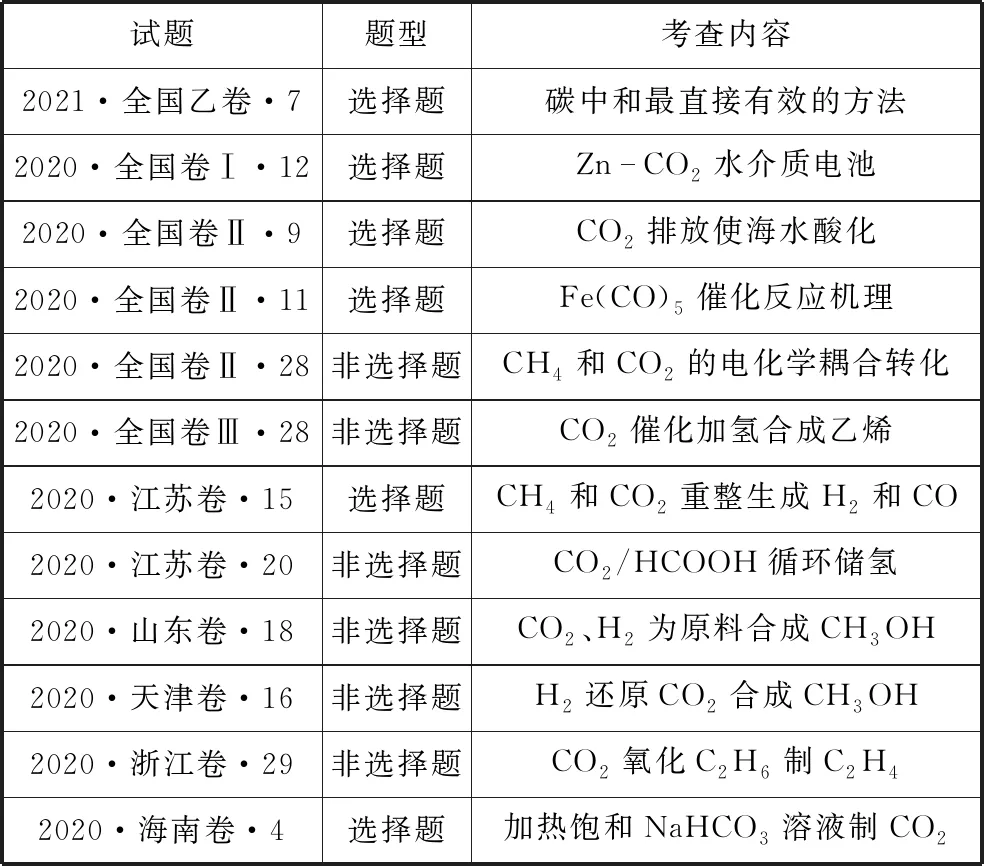
表1 2020—2021年高考试题对CO2考查的统计
从2020年各卷区试题可看出,涉及CO2载体的试题题型含选择题与非选择题,所考查的内容包含CO2的制取、电化学、催化反应机理、耦合反应、化学反应原理、化学储氢等。考查形式丰富多样,充分体现高考命题的学科价值和社会价值,培养考生科学推理论证的关键能力。
三、典型试题例析
1.电化学知识选择题的考查
历年涉及CO2的电化学试题:2019年江苏卷第20题电解CO2制HCOOH、2018年全国卷Ⅰ第13题天然气中CO2和H2S的协同转化装置、2018年全国卷Ⅱ第12题“可呼吸”Na-CO2二次电池。
【例1】(2020·全国卷Ⅰ·12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如图2,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法错误的是

图2
( )
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
D.充电时,正极溶液中OH-浓度升高
【答案】D
【解析】根据电池装置示意图进行电极反应分析,分析结果如表2。
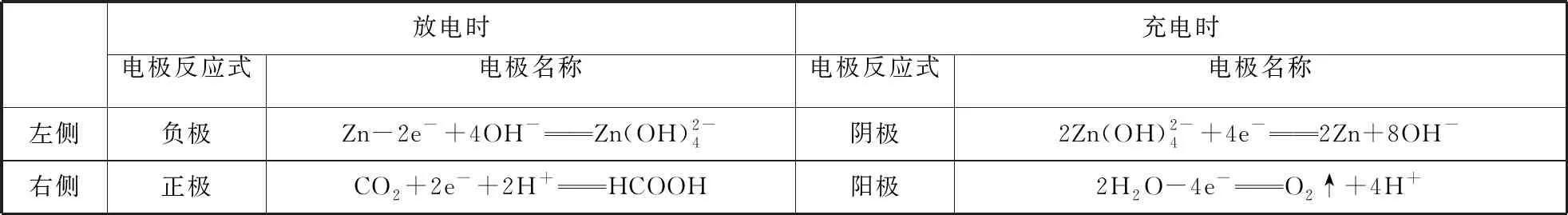
表2

【试题点评】试题中双极隔膜表述较为简略,双极隔膜(BPM)是一种新型离子交换膜,膜主体分为阳离子交换层、阴离子交换层、中间界面层,水解离催化剂被夹在中间的离子交换聚合物中,水解产物H+和OH-在电场力的作用下快速迁移到两侧溶液中,为膜两侧的半反应提供各自理想的pH条件。试题中未明确给出双极隔膜的原理,在图2中,电解质溶液1和电解质溶液2未给出具体电解质溶质,在选项设置上,转移的电子数目和充电时的电极名称等均给考生造成了不小的困难。忽略这些问题,这道试题的价值非常高,引导高中的化学教学应从宏观把握,充分体现学科素养,培养学生的认知能力,同时本题也体现了高考命题的社会价值和学科价值。试题存在的少许缺陷,为试题改编提供了条件,如可对双极隔膜的原理、两侧电解质溶液等问题进行延伸考查。
2.CO2和CH4的耦合转化:
CO2和CH4通过耦合转化重整,可得到烃类物质、H2、CO等,以此为载体可从化学反应原理、电化学方面进行综合考查。
【例2】(2020·江苏卷·15)CH4与CO2重整生成H2和CO的过程中主要发生下列反应


在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图3所示。下列有关说法正确的是
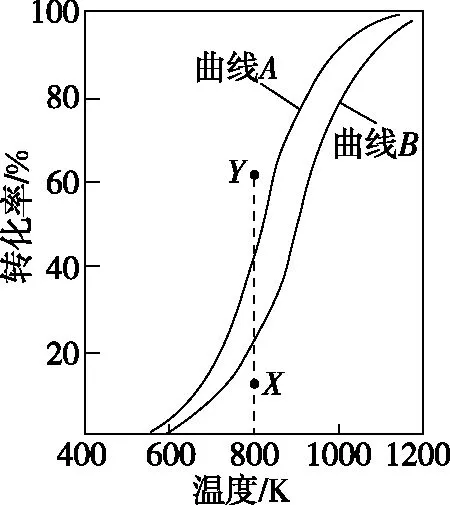
图3
( )
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
【答案】BD
【解析】由CH4与CO2重整生成H2和CO的过程中的两个主要反应可知,CH4(g)参与的反应为吸热反应,正向气体体积减小,故升高温度、减小压强能提高CH4的平衡转化率,当n(CH4)∶n(CO2)=1∶1时,CO2(g)的转化率比CH4(g)高,A项错误,B项正确;使用催化剂只能改变反应速率,不能改变平衡转化率,C项错误;欲使CH4转化率达到Y点的值,可采取增大CO2(g)的浓度或减小压强等方法,D项正确。
【例3】(2020·全国卷Ⅱ·28节选)(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图4所示:
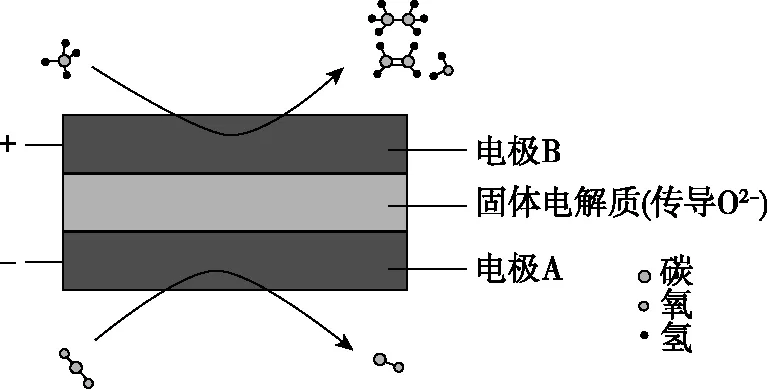
图4
①阴极上的反应式为________________。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和 CO2体积比为________。

【解析】根据固体电解质能传递O2-,对电解原理进行如下分析:
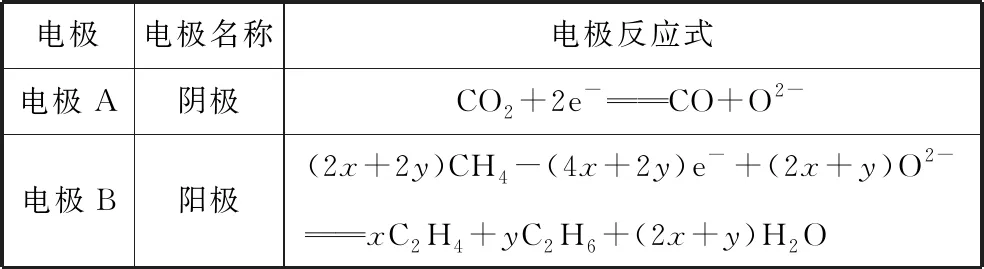
表3

【试题点评】由于CH4和CO2的耦合反应产物体积比不能确定,在讨论阳极电极反应时,可假定C2H4和C2H6的量,生成C2H4和C2H6的体积比不同,电路中转移的电子数目也不等。
3.以CO2和H2为原料合成CH3OH:
以CO2和H2为原料合成CH3OH可实现CO2的回收及综合利用,山东卷和天津卷均有所涉及,试题以化学反应原理题型形式出现,涉及多重反应化学平衡常数的计算以及反应条件的选择。
【例4】(2020·山东卷·18)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:


ΔH2=-90.4 kJ·mol-1

回答下列问题:
(1)ΔH3=________kJ·mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO(g)为bmol,此时H2O(g)的浓度为________mol·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为________。
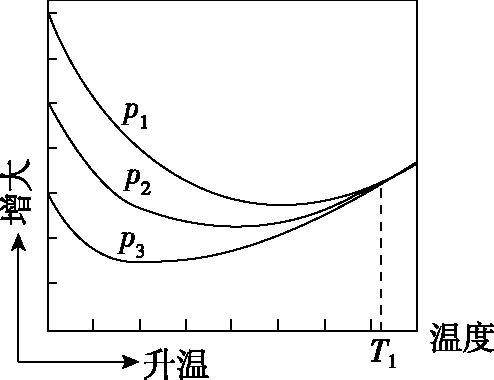
(3)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图5所示。
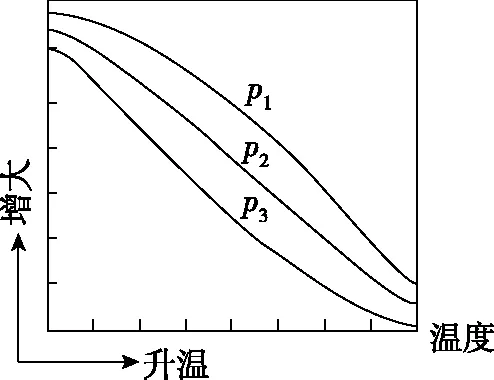
甲
乙
已知:

(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为________(填标号)。
A.低温、高压 B.高温、低压
C.低温、低压 D.高温、高压
【答案】(1)+40.9
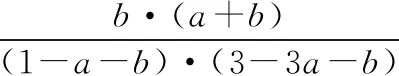
(3)乙p1>p2>p3T1时,以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响
(4)A
【解析】(1)根据盖斯定律,反应Ⅲ=反应Ⅰ-反应Ⅱ,即ΔH3=ΔH1-ΔH2,带入数据可得ΔH3=+40.9 kJ·mol-1;

(3)由于反应Ⅰ和反应Ⅱ有CH3OH(g)生成且均为放热反应,随着温度升高,CH3OH(g)的产率逐渐降低,符合图甲曲线变化趋势,则图乙表示CO2(g)的平衡转化率;压强越大,CO2(g)的平衡转化率及CH3OH(g)的产率均增大,则有p1>p2>p3;温度升高对ΔH>0的反应有利,当温度为T1时,以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响;
(4)结合图像可知应选择低温、高压,有利于提高CO2的平衡转化率和CH3OH的平衡产率。
【试题点评】试题以CO2和H2为原料合成CH3OH为载体考查盖斯定律、化学平衡常数计算、图像的识别与反应条件的选择等知识,试题中多重反应的平衡常数的计算难度较大,如果结合三个反应计算,往往会陷入困境,可通过元素守恒等方法,得出各物质的消耗量和剩余量,使问题柳暗花明。
4.以CO2为原料制取烯烃:
CO2具有弱氧化性,可催化加氢制取乙烯,亦可氧化C2H6制取烯烃,浙江7月选考第29题考查了CO2氧化C2H6制取C2H4,体现对资源的综合利用。
【例5】(2020·全国卷Ⅲ·28)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=________。当反应达到平衡时,若增大压强,则n(C2H4)________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图6所示。
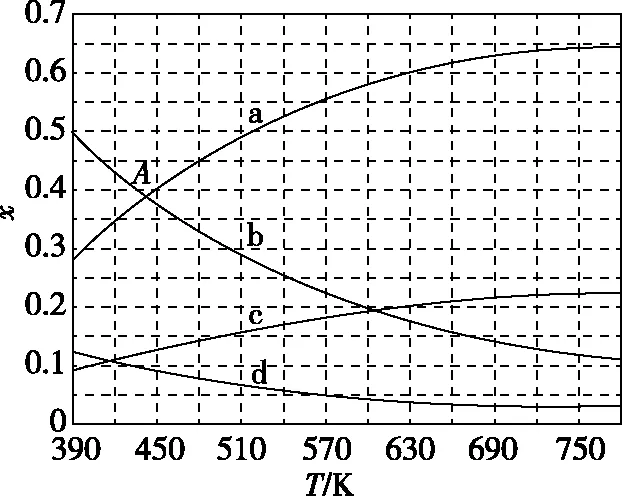
图6
图6中,表示C2H4、CO2变化的曲线分别是________、________。CO2催化加氢合成C2H4反应的ΔH________0(填“大于”或“小于”)。
(3)根据图6中点A(440 K,0.39),计算该温度时反应的平衡常数Kp=________(MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当________________。
【答案】(1)1∶4 变大
(2)d c 小于
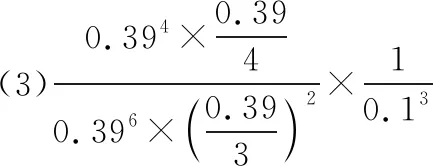
(4)选择合适的催化剂


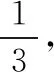
(4)不同的催化剂对反应有不同的选择性,可生成不同的产物,且能提高反应速率,在一定的温度和压强下,可选择合适的催化剂以提高反应速率和乙烯选择性。
【试题点评】试题中原料投料比与反应物的化学计量数之比一致,故从反应开始到平衡时,各物质的比值均保持恒定,反应的热效应未知,故图中减小趋势的曲线并不代表反应物,仔细阅读试题可知曲线发生变化是达到平衡时,升高温度的变化曲线,结合各物质的比值进行判断分析曲线所属及计算Kp。
四、以CO2为载体的原创试题
CO2作为一种温室气体,减少其在空气中的含量或从源头上减少排放是科研的热点,可通过电化学还原法将CO2还原为各种有机化合物或合成气。
【原创试题1】“十三五”期间中国应对气候变化工作取得显著成效,并向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。CO2的回收及综合利用越来越受到国际社会的重视,将CO2转化为高附加值化学品已成为有吸引力的解决方案。
Ⅰ.CO2合成二甲醚(DME):
(1)合成二甲醚反应:



则合成二甲醚的反应的ΔH=________kJ/mol。
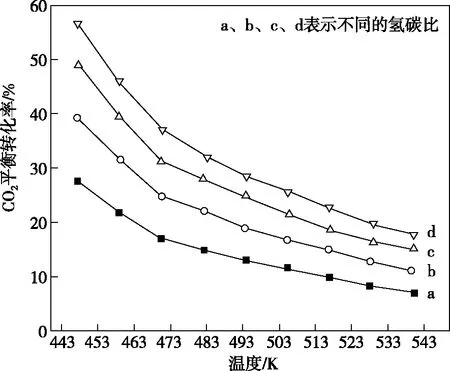
图7
(3)在503 K时,当以氢碳比为0.9时合成二甲醚(如图8),则化学平衡常数Kp=________MPa-4(用气体的平衡分压代替物质的量浓度计算压强平衡常数Kp,气体分压=气体总压×各气体的体积分数,列出表达式)。

图8
Ⅱ.CO2合成甲醇(MT):


ΔH=+41.17 kJ/mol

在不同条件下CO2平衡转化率和甲醇的平衡产率如图9所示:
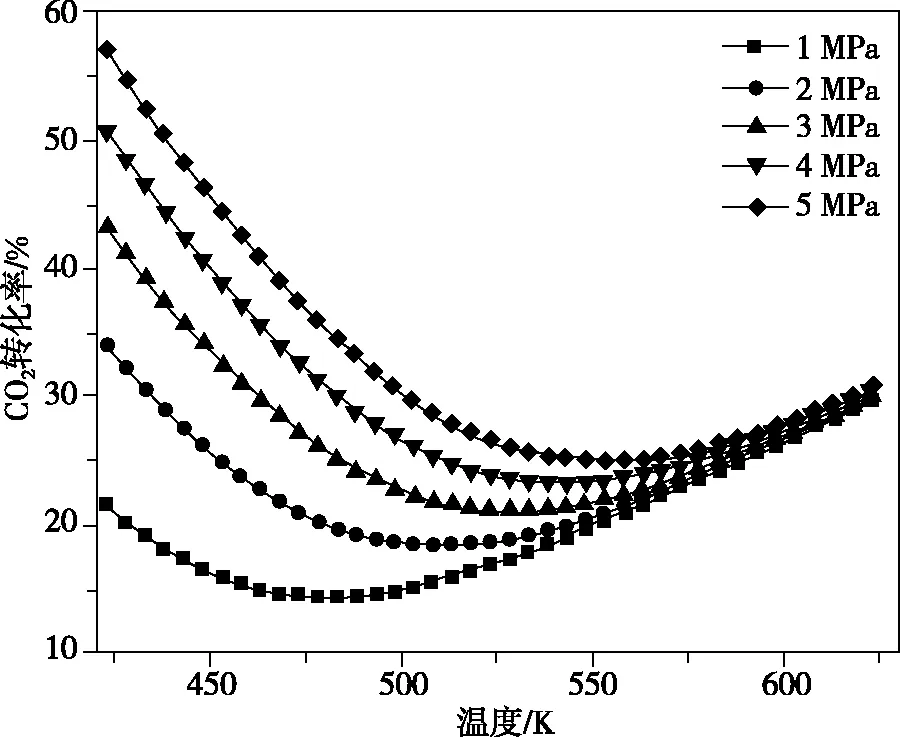

图9
①由图9可知,CO2平衡转化率随反应温度的升高________,原因是________________。
②温度升高甲醇的平衡产率降低的原因是_______________________。
Ⅲ.我国科研团队研究发现使用GaZrOx双金属氧化物催化剂实现CO2加氢制MT和DME的活性明显优于纯Ga2O3和ZrO2催化剂,其反应机理如图10所示:
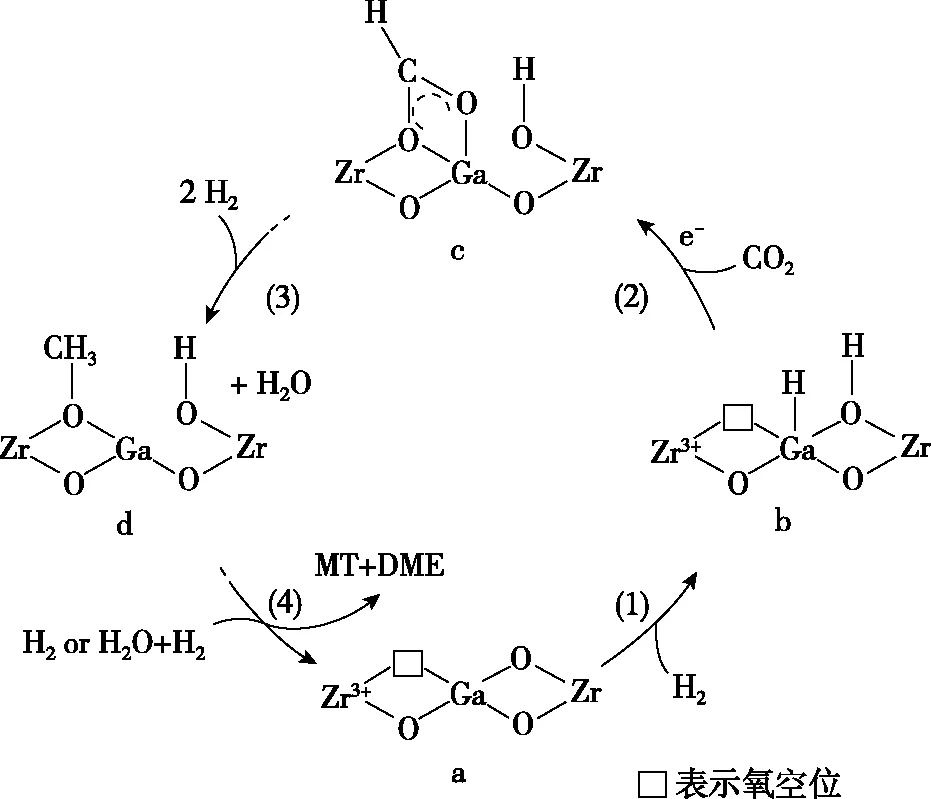
图10
(5)下列有关叙述正确的是________。
a.步骤a→b有化学键的断裂和形成
b.氧空位用于捕获CO2,氧空位越多,速率越快
c.整个催化过程中,Zr元素的化合价未发生变化
d.过渡态C中甲酸盐物种通过氢化或水解可得MT和DME
【命题意图】试题以CO2合成二甲醚和甲醇载体,考查化学反应原理相关知识,考查的知识点包括盖斯定律的应用、图像的分析、化学平衡常数的计算、图像变化原因的分析、催化反应机理的分析等,引入催化过程中氧空位概念,考查考生获取信息、应用信息解决问题的能力、论证推理的能力,渗透对科学探究与创新意识、变化观念与平衡思想、证据推理与模型认知等学科核心素养的考查。
【答案】Ⅰ.(1)-122.54
(2)d>c>b>a
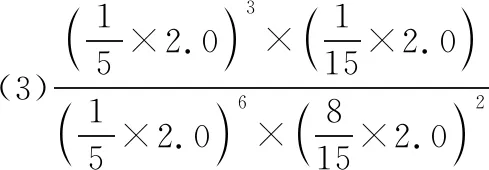
Ⅱ.(4)①先减小后增大 CO2合成甲醇和逆水煤气反应相互竞争,当温度较低时,合成甲醇反应起主要作用,反应放热温度升高,CO2平衡转化率降低;当温度继续升高,逆水煤气反应起主要作用,反应吸热温度升高CO2平衡转化率升高
②CO2合成甲醇与CO合成甲醇反应均为放热反应,升高温度平衡逆向移动,甲醇平衡产率降低
五、总结


