新课标、新高考、新教材背景下教育质量检测工具的跨区域研发项目成果展示
【例1】某项目式学习小组在探究镁的性质时,设计实验并用手持探测器测得溶液中某气体的含量变化曲线如表1所示:
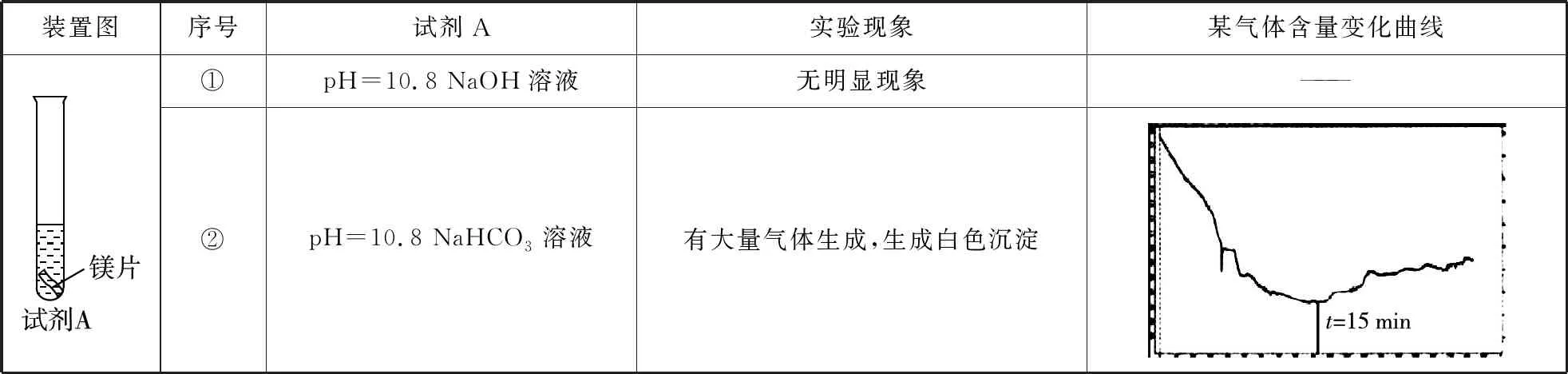
表1

( )
A.镁与冷水、氢氧化钠溶液不反应
B.实验序号②曲线表示CO2气体在溶液中含量的变化
C.实验序号②气体成分:CO2和H2
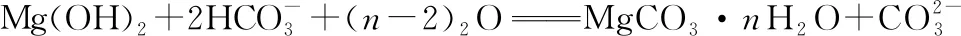
【答案】A

【作者单位 姓名】江西省龙南中学 张万程
【例2】钌的配合物离子[Ru(OOCH3)ClL3]可催化甲醇脱氢,反应过程如图1所示。
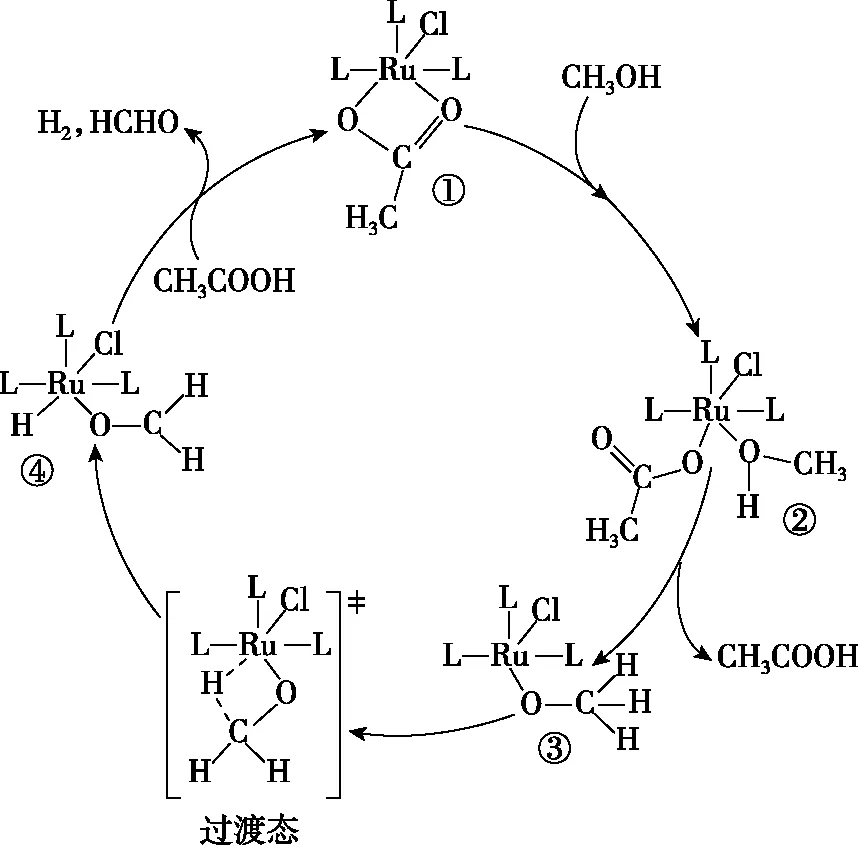
图1
下列叙述错误的是
( )
A.②和④及CH3COOH均是反应的中间产物
C.反应过程中有极性键与非极性键的断裂与形成
D.如果原理为乙醇,则主要产物为乙醛
【答案】C
【解析】
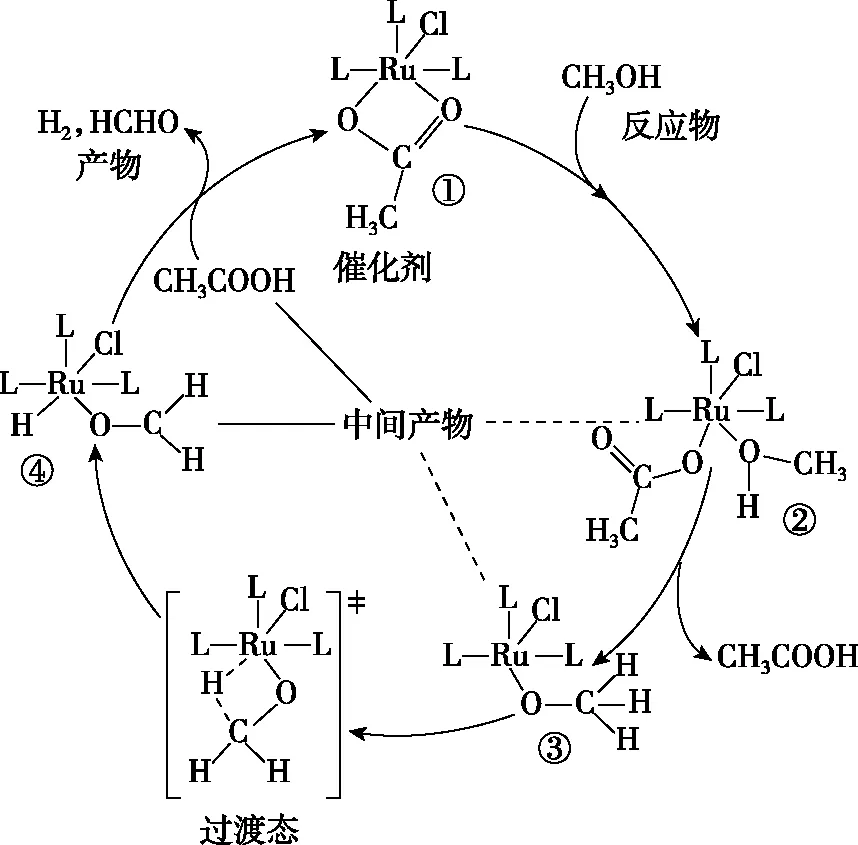
图2
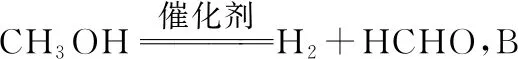
【作者单位 姓名】江西省南昌市新建区第一中学 谢叶归
【例3】实验室制备乙酸丁酯的反应原理为

已知
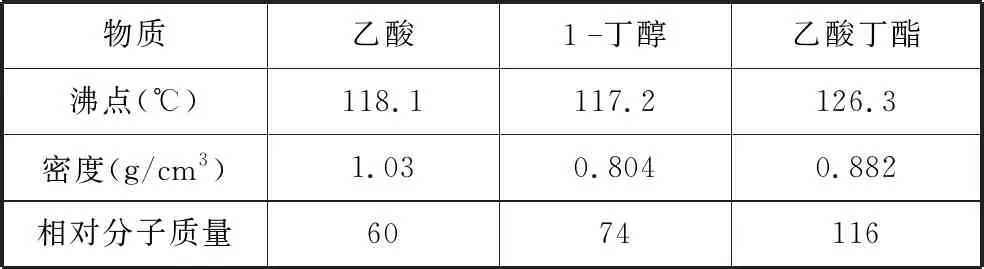
表2
实验一 制取乙酸丁酯
步骤1 量取9.2 mL 1-丁醇(即正丁醇,以下简称丁醇)注入试管中,再量取7.0 mL冰醋酸,慢慢沿试管壁注入试管,边加边轻轻振荡试管。
步骤2 向试管中滴加4~5滴98%浓硫酸轻轻振荡,塞上带长导管的橡胶塞,并按图3装配好实验装置。

图3
步骤3 点燃酒精灯,用酒精灯给石棉网加热,当试管内的液体有明显沸腾状时起,加热回流10 min左右,停止加热,让试管中的液体自然冷却。
步骤4 待试管已经不太热后,用水快速冷却至室温。
实验二 提纯乙酸丁酯
步骤1 将试管中反应后的液体倒入________中,振荡后,分液。
步骤2 测酯层的pH。
步骤3 依次用水、15% Na2CO3溶液,进行洗涤。
步骤4 测酯层的pH。若酯层仍呈________性,则重复步骤3,直至酯层呈中性。
步骤5 将洗净的乙酸丁酯倒入量筒中,测其体积为VmL。
请回答相关问题:
1.实验一中给试管加热的方法是:________。
2.实验二步骤1中的仪器名称为:________;该仪器使用前需要:________;步骤4中酯层仍呈________性。
3.实验一中提高原料利用率的措施有:________,________。
4.该实验条件下,乙酸丁酯的产率为________。
5.为了增大原料的利用率,某同学对实验装置进行了改进,如图4所示,该装置能提高原料的利用率,是因为有以下两个改进:一是________;二是增加了分水器。其中分水器提高原料利用率的原理是:________________。
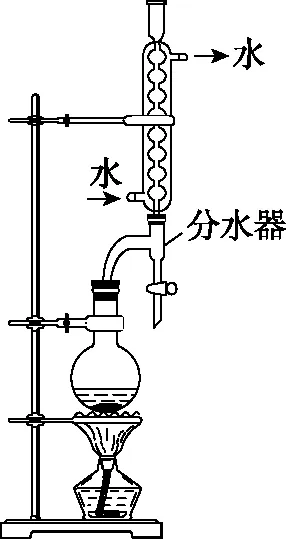
图4
6.实验中诸多因素可能造成产率过低,下列会造成产率过高的因素有________。(填字母代号)
A.温度过高
B.分液时控制不好,造成酯的流失
C.Na2CO3溶液浓度过大
D.洗涤不充分
E.反应时间不足
F.温度过低
【答案】1.空气浴
2.梨形分液漏斗 检查是否漏水 酸
3.加热回流10 min左右 长导管冷凝回流
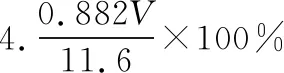
5.改用球形冷凝管 产物中的水分离出去,使平衡向酯化反应方向移动
6.D
【解析】1.试管浴石棉网间留空隙,是通过空气流动来控制温度,是空气浴,本小题考查学生基本实验操作。
2.分离提纯乙酸丁酯的方法是分液,故用梨形分液漏斗;使用之前需要检查是否漏水,本小题考查基本仪器的使用方法及用途。通过测酯层的pH来判断酯层是否还含有未洗净的醇和酸,从而判断酯层是否洗净,本小题考查分析推测能力。
3.提高原料利用率的方法是使原料充分反应,尽可能多的转化为产物,本小题考查归纳与论证,识别有效证据能力。
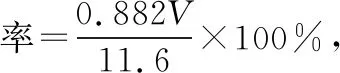
5.使用冷凝管可使反应物充分反应;增加分水器后,冷凝管中冷凝后液化流入分水器,由于酯的密度较小,在水层上,当分水器中水达到分水器支管处时,酯回流到烧瓶。而水从反应体系中脱离,使平衡正向移动,本小题考查“变化观念和平衡思想”的学科素养。
6.实验中造成产率过低的操作较多,如温度过高造成乙酸或正丁醇挥发;分液时造成酯的流失;温度过低或反应时间不足致反应不完全;Na2CO3溶液浓度过大,造成生成的酯部分水解;洗涤不充分,酯中含未反应的醇或酸导致实验结果偏高,本小题考查探究与创新,评价方案能力。
【作者单位 姓名】山西省孝义中学校 李爱琴
【例4】常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL起始浓度也均为0.10 mol·L-1的一元弱酸HX和HY溶液,已知HX电离程度小于HY,且当Ka≤10-5时,可以认为弱酸达电离平衡时的浓度近似等于起始浓度,其滴定曲线如图5所示,请回答下列问题:
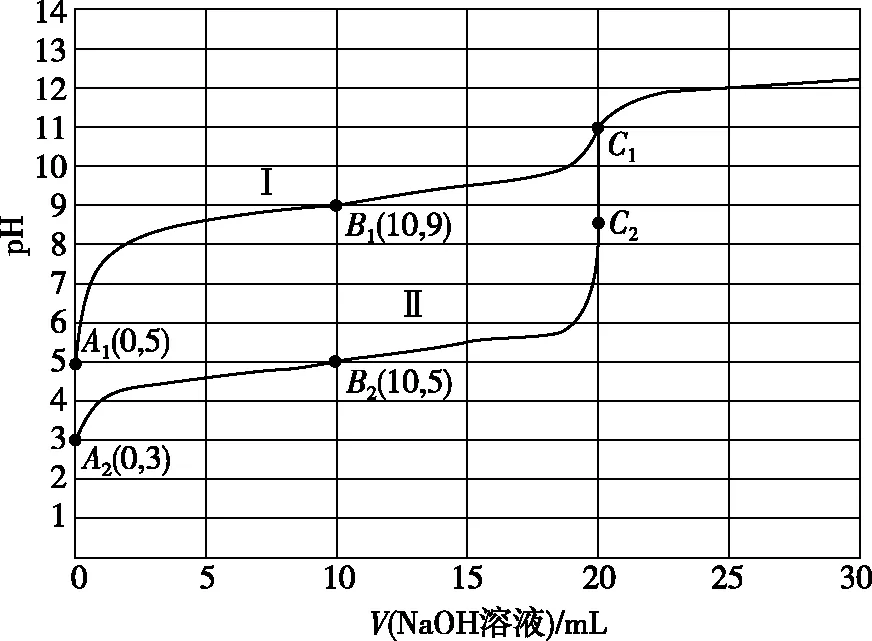
图5
(1)曲线Ⅰ对应的为酸________,弱酸HY的电离常数为________,已知弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数,称为弱电解质电离度,则弱酸HX和HY电离度之比为________;
(2)在B1和B2点对应的溶液中,应满足的关系为c(HX)-c(HY)=________,c(Na+)、c(X-)和c(Y-)离子浓度由大到小的关系为________;
(3)当两溶液均满足pH=7时,请完成以下问题:如果某溶液中Ka
(4)两条曲线终点坐标分别C1和C2,其纵坐标数值分别为________,根据终点坐标判断,曲线________选用酚酞作终点指示剂误差更小;
(5)如果把曲线上pH=7的点称为D点,则在曲线Ⅱ上B2和D2点之间(不包括端点),c(Na+)、c(H+)、c(OH-)、c(Y-)之间存在关系为________,在曲线Ⅰ上的A1至C1点范围内,满足c(Na+)>c(X-)>c(OH-)>c(H+) 的区间为________;如果把曲线上加入40 mL NaOH溶液的点称为E点,则B1、C1和E1三点溶液中由水电离出的c(H+)大小关系为________。
【答案】(1)HX 10-50.01
(2)c(HX)-c(HY)=c(Y-)-c(X-)c(Y-)>c(Na+)>c(X-)
(3)< = 100
(4)10.85 8.85 Ⅱ
(5)c(Y-)>c(Na+)>c(H+)>c(OH-) (D1,C1] C1>B1>E1
【解析】本题以文字和图像形式呈现,考查了考生的读图像能力和运用三大守恒规律对中和滴定后溶液中离子浓度关系比较和判断的能力,尤其对滴定过程中“五点一区间上”离子种类、浓度大小、等式关系等进行了重点考查,考查了考生对平衡移动原理、电离常数、水解常数以及指示剂的理解与应用。考查考生信息搜索能力、数据处理能力、归纳概括能力,培养考生变化观念与平衡思想、科学探究与创新意识的学科素养。
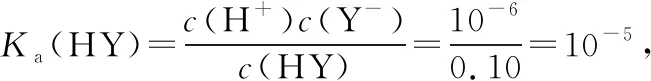
2.在B1和B2两点均为等浓度酸和盐和混合溶液,两溶液中c(Na+)相等,根据两点坐标值可知,B1点溶液呈碱性,X-水解程度大于HX电离程度,满足c(HX)>c(Na+)>c(X-),B2点溶液呈酸性,HY电离程度大于Y-水解程度,满足c(Y-)>c(Na+)>c(HY),所以c(Y-)>c(Na+)>c(X-)。两溶液中分别应满足以下物料守恒关系:c(HX)+c(X-)=2c(Na+)、c(HY)+c(Y-)=2c(Na+),所以c(HX)+c(X-)=c(HY)+c(Y-),即c(HX)-c(HY)=c(Y-)-c(X-)。
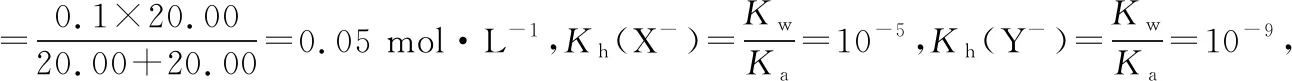
5.从图像不难看出,曲线Ⅰ的D1点在B1的左侧,此点满足:c(Na+)+c(H+)=c(X-)+c(OH-),由于OH-是X-水解产生的,所以也同时满足c(Na+)=c(X-)>c(OH-)=c(H+),如果再加入NaOH溶液直到C1点,则会同时满足c(Na+)>c(X-)、c(OH-)>c(H+),即满足c(Na+)>c(X-)>c(OH-)>c(H+),所以合理区间为(D1,C1]。曲线Ⅱ上D2点在B2点的右侧,是酸和盐的混合溶液,此点满足电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),而在B2和D2点之间(不包括端点)应满足:c(H+)>c(OH-),所以c(Y-)>c(Na+),则c(Na+)、c(H+)、c(OH-)、c(Y-)之间在大小关系为:c(Y-)>c(Na+)>c(H+)>c(OH-)。B1、C1和E1三点溶液中物质成分分别为等浓度的HX和NaX、NaX、等浓度的NaX和NaOH,其溶液分别为0.033 mol·L-1、0.05 mol·L-1和0.025 mol·L-1,由于Ka(HX)=10-9,所以E1点溶液中c(OH-) 远大于B1点溶液中c(H+),对水的电离抑制作用更强,C1只有盐溶液且盐溶液浓度最大,所以B1、C1和E1三点溶液中由水电离出的c(H+)大小关系为C1>B1>E1。

