响应面法优化蛹虫草子实体虫草素提取工艺*
李剑梅,郝 捷,池景良,张疏雨,柴林山,朱万芹
(1.辽宁省微生物科学研究院,辽宁 朝阳 122000;2.内蒙古昆明卷烟有限责任公司,内蒙古 呼和浩特 010020)
蛹虫草(Cordyceps militarys) 又名北冬虫夏草,属于真菌门(Fungi)子囊菌亚门(Ascomycota)粪壳菌纲(Sordariomycetes) 肉座菌亚纲(Hypocreomyce-tidae) 肉座菌目 (Hypocreales) 虫草科(Cordy-cipitaceae) 虫草属 (Cordyceps),是一种具有多种药理功能的食(药) 用菌[1-2]。研究表明,蛹虫草子实体中含有虫草素、虫草酸、虫草多糖、麦角甾醇、氨基酸等多种生理活性物质,具有很高的药用和保健价值,其中虫草素(cordycepin) 即3’-脱氧腺苷(3’-deoxyadenosine),是首先从真菌中分离出来的核苷类抗菌素,在抑菌、抗病毒、抗肿瘤、调节免疫力、降血脂、抗血小板凝集、改善记忆力等方面发挥作用。目前,已有不少以虫草素为主要成分的药品、保健品及化妆品研发成果,如虫草素胶囊、用于治疗动脉粥样硬化及抗抑郁的药物等,我国由虫草素合成的治疗白血病的新药也已进入Ⅰ期临床阶段[3-6]。试验依据虫草素溶于水、热乙醇的理化性质,采用回流水浴提取技术,在单因素试验基础上,采用响应面试验方法优化蛹虫草子实体中虫草素提取工艺,以提升蛹虫草子实体中虫草素提取效率,为蛹虫草子实体中虫草素充分提取及相关产品的研发提供科学依据。
1 材料与方法
1.1 材料及试剂
蛹虫草子实体,由辽宁省微生物科学研究院药用蕈菌研究室提供,取1 kg蛹虫草子实体于55℃鼓风干燥箱干燥至恒重,粉碎,过80目筛,备用。
虫草素标准对照品(纯度≥98%),索莱宝生物公司;乙腈,赛默飞世尔科技(中国) 有限公司;色谱纯、无水乙醇为国产分析纯。
1.2 主要仪器设备
AL204型电子天平,梅特勒-托利多仪器有限公司;Waters2695型高效液相色谱仪,美国waters公司;色谱柱 Agilent ZORBAXEclipseXDB-Cl8(4.6 mm×250 mL TI,5 mm),安捷伦科技(中国) 有限公司;SL-H-4水浴锅,江苏荣华仪器制造有限公司;电热恒温鼓风干燥箱,上海跃进医疗器械厂。
1.3 试验方法
1.3.1 虫草素含量测定
1) 标准溶液
称取虫草素标准品10 mg,去离子水溶解,用流动相(乙腈5%、去离子水95%) 定容至100 mL,摇匀,配成浓度为100 μg·mL-1虫草素标准品储备液。准确吸取虫草素储备液0.25 mL、0.50 mL、1.25 mL、2.50 mL、5.00 mL、12.50 mL,置于 25 mL容量瓶中,用去离子水定容,稀释成1.00 μg·mL-1、2.00 μg·mL-1、5.00 μg·mL-1、10.00 μg·mL-1、20.00 μg·mL-1、50.00 μg·mL-1标准品溶液。
2) 样品溶液
准确称取蛹虫草子实体粉末1.0 g,置于磨口三角瓶中,回流水浴提取,4 000 r·min-1离心10 min,收集上清液,用去离子水定容至100 mL,摇匀;准确量取提取液5 mL,过0.22 μm微孔滤膜,待测。
3) 色谱条件
色谱柱为 Agilent ZORBAXEclipseXDB-Cl8 (4.6 mm×250 mL TI,5 mm);检测器:紫外检测器;检测波长:260 nm;柱温:35℃;流动相:乙腈-水(乙腈5%、去离子水95%);流速:1.0 mL·min-1;进样量:10 μL。
1.3.2 单因素试验
各因素固定值分别为10%乙醇提取、料液比1∶30、提取温度80℃、提取时间2 h。保持其他3个因素不变,每次改变1个因素。各因素水平分别为:乙醇溶液体积分数分别为10%、20%、30%、40%、50%、60%;提取温度分别为50℃、60℃、70℃、80℃、90℃;提取时间分别为1 h、2 h、3 h、4 h、5 h;料液比 (g∶mL) 分别为 1 ∶10、1 ∶20、1 ∶30、1∶40、1∶50、1∶60。采用外标法,利用高效液相色仪测定供试样品液中虫草素吸收峰面积,按照虫草素标准曲线方程计算供测样品液中虫草素浓度,虫草素得率(M,‰)公式为:
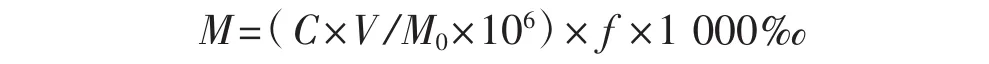
式中:C为供测样品液中虫草素浓度(μg·mL-1);V为供测样品液体积(mL);M0为供测蛹虫草子实体粉的质量(g);f为供测样品的稀释倍数。
1.3.3 响应面优化试验
在单因素试验基础上,以提取温度(A)、提取时间(B)、乙醇体积分数(C)、料液比(D) 为变量因素,以虫草素得率为响应值,运用Design Expert 8.0.7软件和BBD设计方案,建立4因素3水平的响应面分析试验,并对回归模型进行方差分析,确定最佳提取工艺。
2 结果与分析
2.1 高效液相色谱测定结果
各虫草素标准品溶液进样后,以峰面积为纵坐标,标准品质量浓度为横坐标,进行线性回归,其标准曲线见图1。
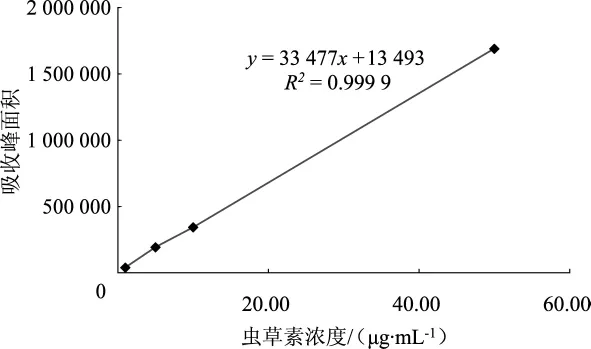
图1 HPLC法虫草素标准曲线Fig.1 Standard curve of cordycepin
由图1可得虫草素的标准曲线方程为:Y=33 477X+13 493(R2=0.999 9)。其表明虫草素在1.00 μg·mL-1~50.00 μg·mL-1的浓度内与峰面积呈良好的线性关系,其标准品色谱图见图2,供试品色谱图见图3。
由图2、图3可知,在规定的色谱条件下,供试样品与虫草素标准品溶液在相同的保留时间出现了虫草素特征吸收峰,且样品色谱峰分离效果良好。
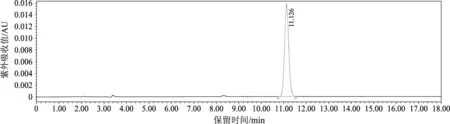
图2 虫草素标准品HPLC色谱图Fig.2 HPLC chromatograms of cordycepin standard
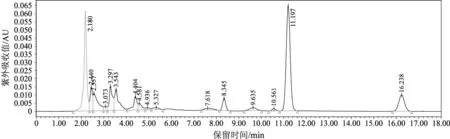
图3 供试样品HPLC色谱图Fig.3 HPLC chromatograms of sample
2.2 单因素试验结果
乙醇体积分数对虫草素得率的影响见图4。
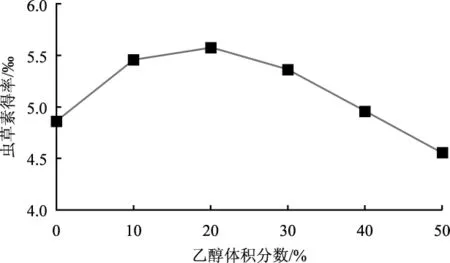
图4 乙醇体积分数对虫草素得率影响Fig.4 Effect of ethanol concentration on the yield of cordycepin
由图4可知,乙醇体积分数对虫草素得率的影响较大,起初随着乙醇体积分数的升高,虫草素得率随之升高,当浓度达到20%时,虫草素得率最高(5.575‰),随后呈下降趋势。可能由于在一定乙醇体积分数范围内,其可促进虫草素的释放,浓度过高会导致细胞膜上蛋白质迅速变性,反而不利于虫草素的提取,同时随着乙醇溶液体积分数的增大,脂溶性杂质的成分溶出量增加,可与乙醇、水分子结合,为虫草素的竞争性抑制剂,导致虫草素得率降低[7-8]。因此,最适提取溶剂为20%乙醇溶液。
2.2.2 提取时间对虫草素得率的影响
提取时间对虫草素得率的影响见图5。
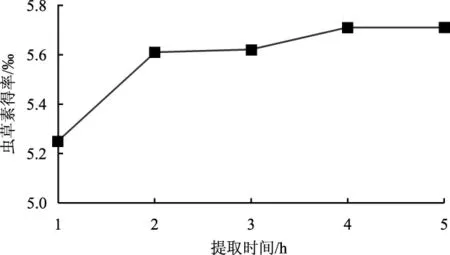
图5 提取时间对虫草素得率影响Fig.5 Effect of temperature on the yield of cordycepin
由图5可知,在提取时间小于2 h时限内,虫草素得率随着时间的延长呈快速增加趋势,提取时间为2 h时,虫草素得率快速达到较高水平(5.611‰),然后随着提取时间的延长,虫草素得率呈缓慢增加趋势,提取时间为4 h时虫草素得率达到极值(5.700‰),虫草素得率与提取2 h时虫草素得率相近,提高幅度较小,考虑到实际生产中能耗成本及提取工作效率,选择虫草素最佳提取时间为2 h。
2.2.3 不同提取温度对虫草素得率的影响
不同提取温度对虫草素得率的影响见图6。
吊脚楼不仅凭借着大自然得天独厚的条件和清秀古朴的造型使人眼前一亮;更因各族人民多少年来的辛勤坚韧以及聪明才智而兼具统一、均衡、对称、几何、线条、尺度、逻辑等简洁、严谨有序的数学之美,使人心驰神往。
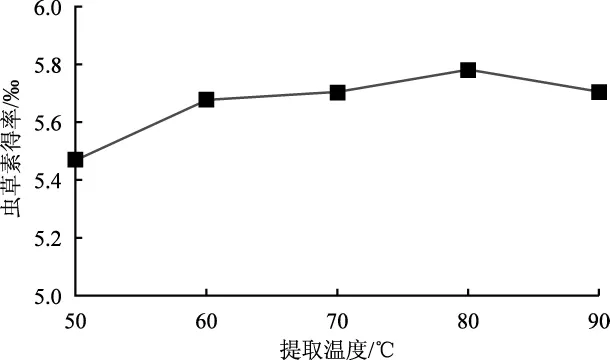
图6 温度对虫草素浓度影响Fig.6 Effect of extraction time on the yield of cordycepin
由图6可知,50℃~80℃时,虫草素得率随着提取温度的升高而增加,80℃时得率达到最大值(5.781‰),后随着温度的升高虫草素得率略有下降。原因可能是由于热能的增加增大溶剂对物料的破坏力,进而促进了虫草素的溶出速率,但随着温度的升高,其他物质的溶出速率增大,增加了溶液的粘稠度,影响了虫草素提取效率。故虫草素提取温度选择80℃较为合适。
2.2.4 不同料液比对虫草素提取浓度的影响
不同料液比对虫草素提取浓度的影响见图7。
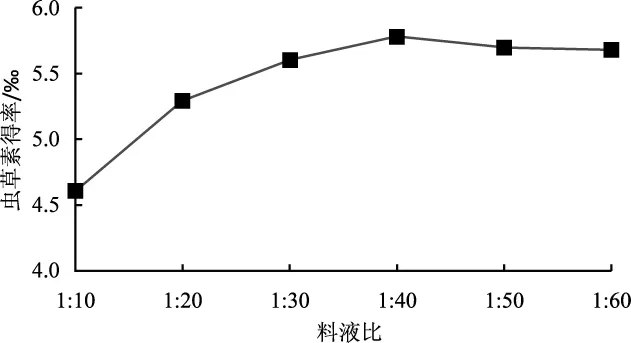
图7 料液比对虫草素浓度影响Fig.7 Effect of solid-to-solvent ratio on the yield of cordycepin
由图7可知,不同料液比对虫草素得率的影响较明显,呈先增加后下降趋势,其中料液比为1∶40时虫草素得率最高(5.779‰);后随着液料比继续增大,虫草素得率随之下降。因此,提取的液料比选择1∶40较为合适。
2.3 响应面试验结果与分析
2.3.1 响应面试验结果与回归方程拟合
结合单因素试验结果,利用响应面 Box-Behnken模型试验设计,选择提取温度(A)、提取时间(B)、乙醇体积分数(C)、提取液料比(D)为自变量,以虫草素得率为因变量,在4因素3水平上进行27个试验点的优化试验,试验因素与水平见表1,各因素编码水平及结果见表2。
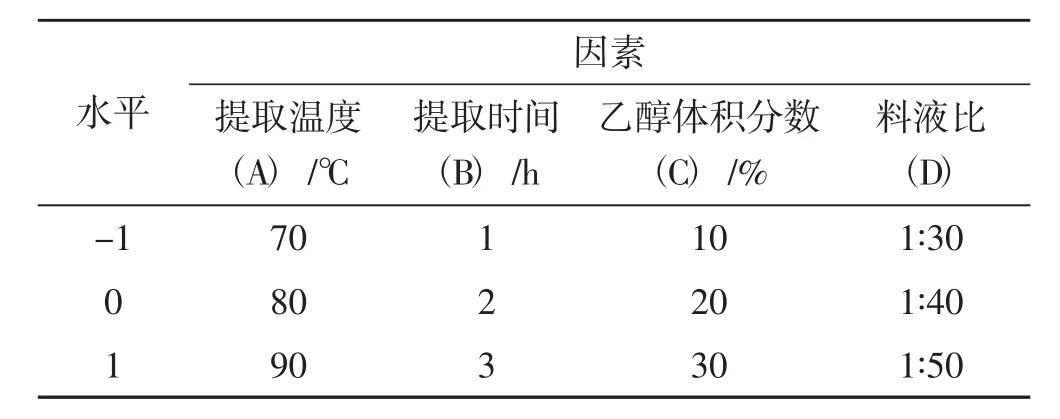
表1 响应面试验因素与水平Tab.1 Design factors and level of response surface test
以表2虫草素得率为响应值(Y),获得的二次多元回归方程为:Y=3.862+0.011A+0.217B+0.021C+0.051D+9.500×10-4AB+3.425×10-4AC+5.250×10-5AD-2.750×10-4BC+1.375×10-3BD-4.725×10-4CD-1.104×10-4A2-0.079B2-6.642×10-4C2-5.892×10-4D2。
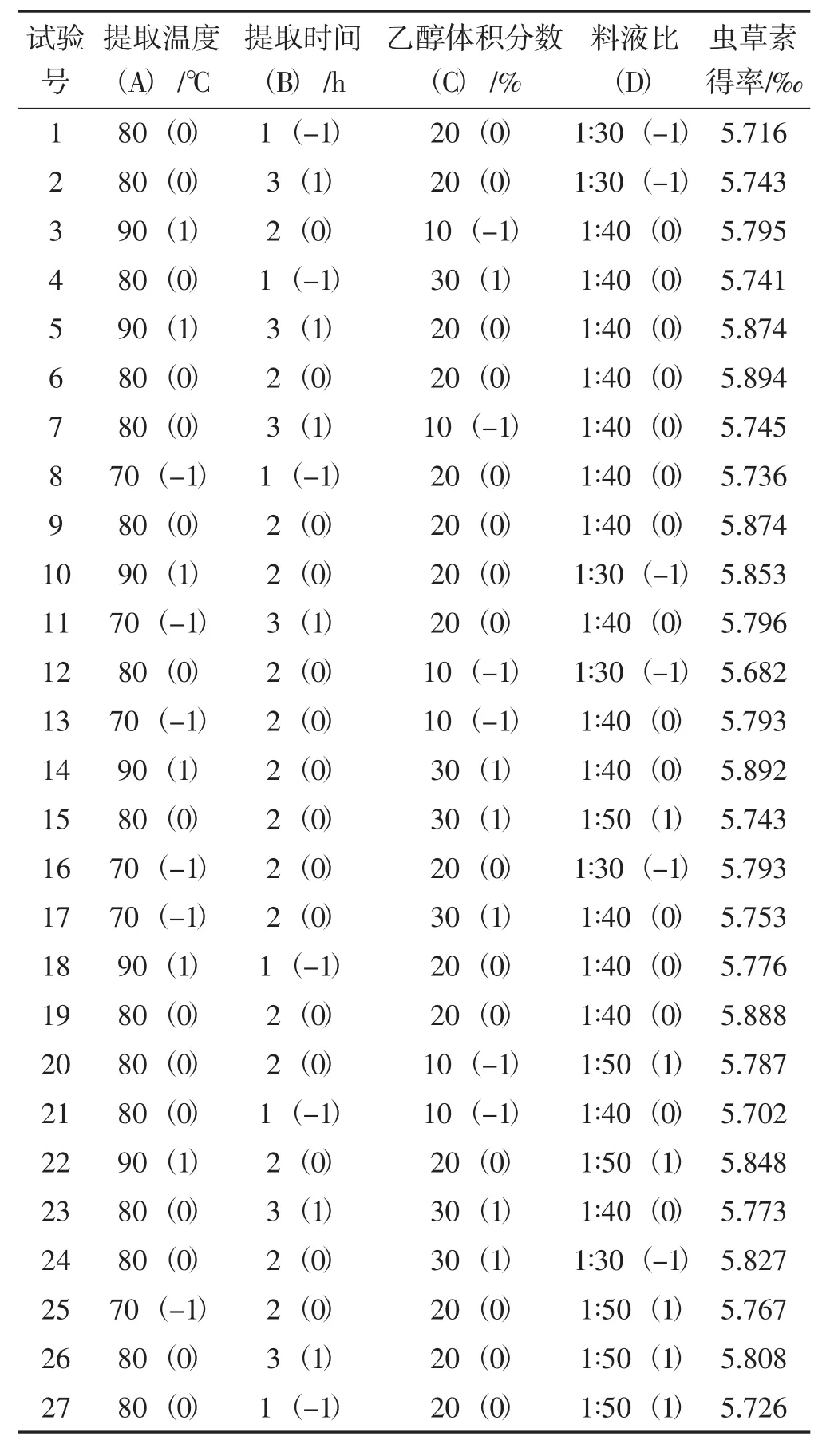
表2 响应面试验设计及结果Tab.2 Experimental design and results with response variables
2.3.2 模型方差及可信度分析
回归方程模型方差分析结果见表3。

表3 回归模型模型方差及可信度分析Tab.3 Analysis on variance and reliability of regression model
由表3可知,此模型达到极显著水平(P<0.000 1),模型回归显著可靠,且失拟项P值为0.319 6(P>0.05) 不显著,说明在试验过程中未知因素对试验结果影响较小;模型调整决定系数R2Adj=0.936 6,表明在虫草素回流水浴提取工艺中,约有93.66%的变异分布在所研究的4个因素中;相关系数R2=0.970 8,表明该方程较好的反应了虫草素得率与提取温度、提取时间、乙醇体积分数、料液比的关系,虫草素得率的实际值与预测值之间具有较好的拟合相关性。因此,可以利用该回归方程确定最佳提取工艺条件。
一次性显著性检验,各因素对虫草素得率的影响大小依次为:提取温度>提取时间>乙醇体积分数>料液比;二次项中B2、C2、D2显著性水平为极显著(P<0.01),A2不显著(P>0.05);交互项中AC、CD的交互作用(P<0.01)对虫草素得率的影响呈极显著的正相关,AD、BC、BD交互项对虫草素得率的的影响不显著(P>0.05)。
2.3.3 响应面分析
响应面曲面坡度和等高线形状能直观反应各试验因素及两两因素的交互作用对响应值虫草素得率的影响,其统计结果见图9、图10。

图9 因素CD和因素AC交互作用对虫草素提取浓度影响的响应面图及等高线Fig.9 Response surface diagram and contours of the interaction of parameters CD and AC on the extraction concentration of cordycepin
由图9、图10可以看出,各因素间的交互作用所形成的响应面均为开口向下的凸形曲面,虫草素的得率由四周向内逐渐增大,中心位置曲面最高处达到最大值,说明该模型具有极值。5种交互作用对虫草素得率的影响程度不尽相同,相比而言,乙醇体积分数与料液比(CD)、温度与乙醇体积分数(AC)、提取温度与时间(AB)、提取温度与料液比(AD)交互作用的响应面坡度陡峭,等高线呈典型的椭圆形及鞍形,对虫草素提取浓度的影响显著;提取时间与料液比(BD)、提取时间与乙醇体积分数(BC)交互作用的响应面坡度较陡,等高线为圆形,对虫草素提取得率影响不显著。
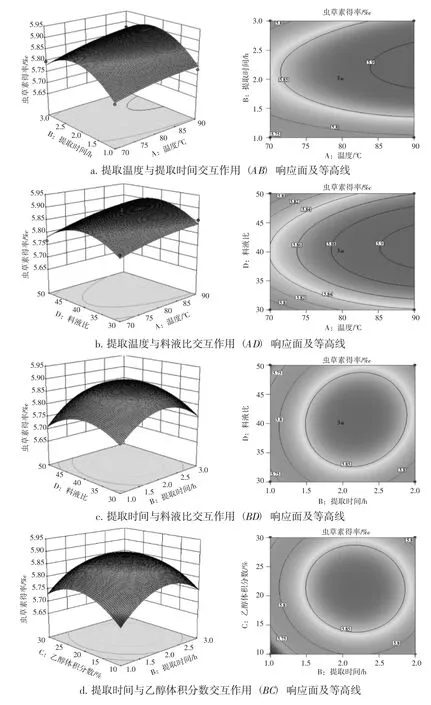
图10 因素AB、AD、BD、BC交互作用对虫草素提取浓度影响的响应面图及等高线Fig.10 Response surface diagram and contours of the interaction of parameters AB,AD,BD,BC on the extraction concentration of cordycepin
通过分析及预测,获得虫草素最优提取工艺条件及响应值的极值,即在提取温度90℃、提取时间2.23 h、乙醇体积分数24.11%、料液比1∶40时,虫草素得率最大预测值为5.922‰。考虑到生产实际中可操作性,对技术参数进行了修正,确定优化的提取工艺为:提取温度90℃、提取时间2 h、乙醇体积分数25%、料液比1∶40。
2.3.4 优化条件下的验证试验
为检验模型预测的准确性,在最佳提取条件下,进行3次平行提取验证试验,虫草素得率分别为5.910‰、5.917‰、5.928‰,平均值为5.918‰,与理论预测值相近(5.922‰),误差较小,表明优化工艺合理、可靠,可以用来指导蛹虫草子实体中虫草素的提取。
3 结论
目前,虫草素的提取方法主要有浸提法、回流水浴提取法、超声波法、超临界萃取等,其中回流提取方法相对于超声提取、超临界提取等常用提取方法具有操作简单、溶剂用量少、设备成本低、稳定性好和易于工业化生产等优点,且提取溶剂的乙醇可回收循环使用,在规模化生产中具有较高的实用价值[9-10]。试验以回流水浴为提取方法,通过单因素试验探索了影响虫草素得率的主要因素,并应用响应面法进行了蛹虫草子实体中虫草素提取工艺参数的优化,确定优化的提取工艺为:提取温度90℃、提取时间2 h、乙醇体积分数25%、料液比1∶40。在该工艺条件下,蛹虫草子实体中虫草素的得率与与理论预测值相近,工艺合理、可靠,为蛹虫草子实体中虫草素的高效提取及产品研发提供科学依据。

