基于网络药理学探讨山药治疗2型糖尿病的有效成分及作用机制
杨丽宁 向蓉 王艺臻 张红梅
甘肃省第二人民医院,甘肃 兰州730000
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种常见的慢性代谢性疾病,其特点主要是血糖升高和代谢紊乱等,以及由此导致的全身组织、器官损害,严重危害人类的健康。山药是薯蓣科植物薯蓣(Dioscorea opposite Thunb.)的干燥根茎,其性平、气微、味淡、微酸,被列入我国传统的药食同源中药目录。中医理论认为,山药具有固肾涩精、补益脾胃、生津益肺之功效[1]。现代药理研究表明,山药具有调节血糖、保护胰岛功能、降血脂、增强免疫力等多种药理活性[2]。本研究通过网络药理学方法,挖掘山药治疗T2DM的主要成分及其作用靶点和通路,旨在为天然降血糖产品的研发提供理论依据。
1 方法
1.1 山药活性成分的获取和筛选 通过TCMSP数据库检索山药的活性成分。以药物口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)为筛选条件,设定OB≥30%、DL≥0.18的成分为有效活性成分。
1.2 山药活性成分的作用靶点及T2DM作用靶点的获取 通过TCMSP数据库查询山药有效活性成分的作用靶点,利用UniProt数据库对活性成分靶基因的名称进行标准化处理。在GeneCards数据库中以“type 2 diabetes mellitus”为搜索词,查询T2DM相关的作用靶点。
1.3 山药治疗T2DM潜在靶点的获取 通过Venny2.1.0在线软件获得山药有效活性成分与T2DM共同作用靶点,将结果导入Cytoscape3.7.2软件,构建药物活性成分-共同靶点网络图,并对其进行网络拓扑结构分析。
1.4 蛋白质相互作用(PPI)网络分析 将共同靶点导入STRING平台,物种选择“Homo sapiens”,结合分值设定为0.9,构建山药治疗T2DM的PPI网络。将该网络数据导入Cytoscape3.7.2软件中进行拓扑结构分析,筛选出山药治疗T2DM的核心靶点。
1.5 生物通路富集分析 采用基因注释工具DAVID 6.8对PPI网络筛选出的关键靶点进行KEGG通路富集分析,预测山药治疗T2DM的分子机制。
2 结果
2.1 山药有效活性成分及作用靶点的获取 通过TCMSP数据库查询到71种山药已知成分,以OB≥30%,DL≥0.18为筛选条件,得到16个有效活性成分,144个作用靶点;经Uniprot数据库对靶基因的名称进行标准化处理,去除数据库中没有预测靶点的活性成分并排除重复后,最终得到12个化合物、72个靶点。见表1。

表1 山药的活性成分
2.2 山药治疗2型糖尿病潜在靶点的获取 通过检索GeneCards数据库获得T2DM靶点基因9948个,设定Score大于中位数的靶点为T2DM的潜在靶点,最终得到T2DM作用靶点1986个,与山药有效活性成分靶点取交集后,得到41个共同靶基因。见图1。
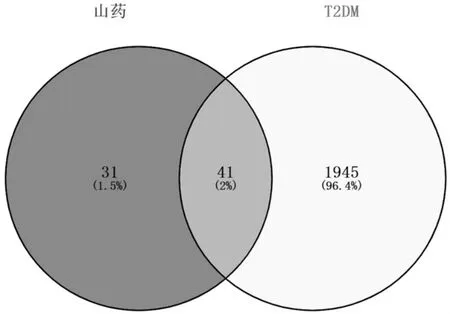
图1 山药—T2DM共同靶基因的韦恩图
2.3 “药物活性成分-共同靶点”网络图的构建 将41个交集靶点数据导入Cytoscape3.7.2软件,构建“药物活性成分-共同靶点”网络图。见图2。度值较高的化合物有薯蓣皂苷元(diosgenin)、海风藤酮(Kadsurenone)等,这些化合物可能是山药治疗T2DM的关键化合物。
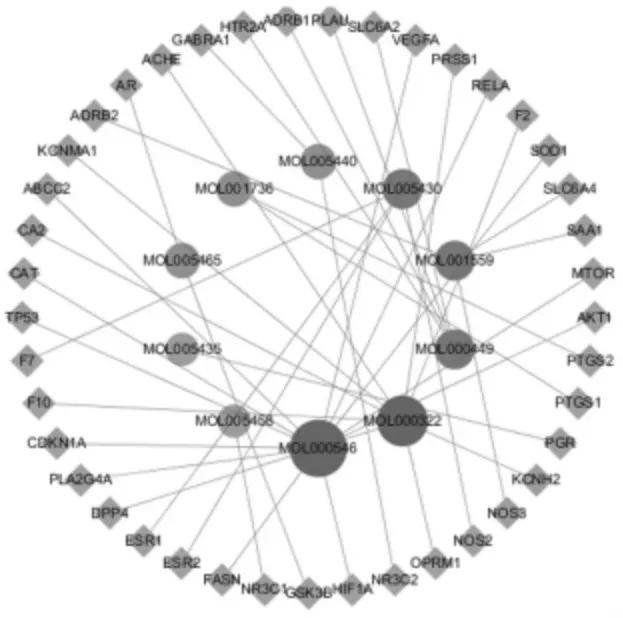
图2 山药治疗T2DM的“药物活性成分-共同靶点”网络图
2.4 PPI网络的构建与分析 将得到的41个交集靶点导入STRING平台构建PPI网络图,选取最低相互作用阈值大于0.9的靶点,隐藏游离节点,将结果导入Cytoscape3.7.2软件,得到度值排名前20的靶点,见图3。进一步筛选PPI网络中自由度、介数、中心度数均大于平均数的核心靶点蛋白有:AKT1、NR3C1、RELA、NOS2、SAA1。推测这些靶点可能是山药治疗T2DM的关键靶点。见图4。
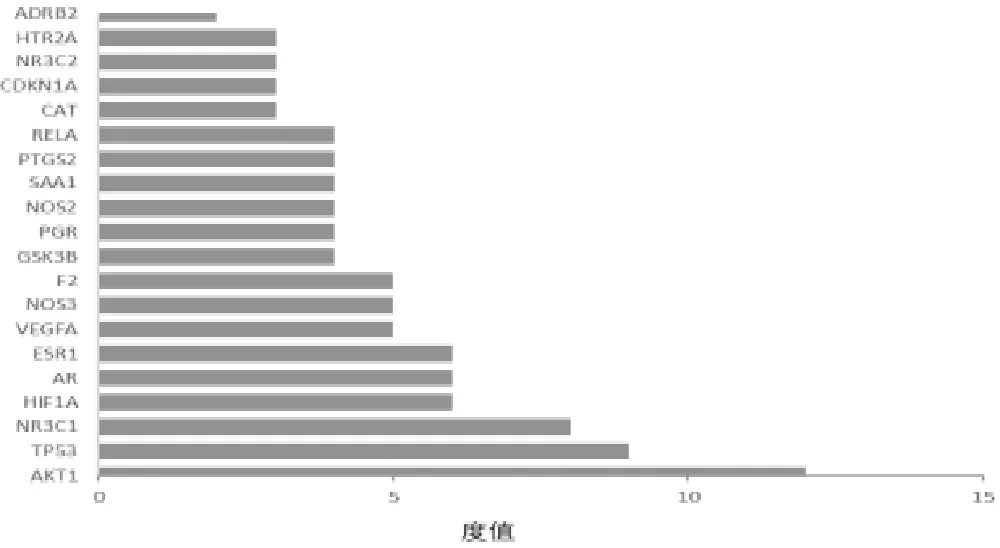
图3 度值排名前20的靶点
2.5 GO富集分析 将41个交集靶点导入DAVID 6.8数据库进行GO富集分析,得到具有显著意义的46个生物过程(P<0.05,FDR<0.05),其中属于BP的20个,主要包括肽基谷氨酸羧化(peptidyl-glutamic acid carboxylation)、一氧化氮生物合成过程的正调控(positive regulation of nitric oxide biosynthetic process)、对热的反应(response to heat)、细胞对缺氧的反应(cellular response to hypoxia)、对雌二醇的反应(response to estradiol)等。属于CC的6个,包括突触后、小窝、蛋白质复合物、细胞表面、质膜、胞质溶胶。属于MF的20个,主要包括转录激活子活性,RNA聚合酶Ⅱ核心启动子近端区域序列特异性结合、酶结合、血红素结合、类固醇激素受体活性、类固醇结合等。结果如图5所示。
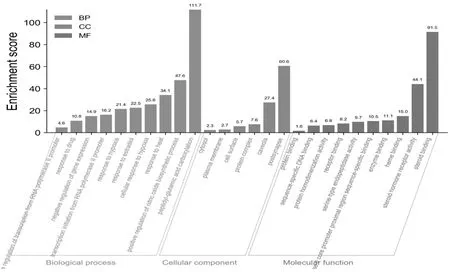
图5 共同靶点的GO富集分析图
2.6 KEGG通路富集分析 KEGG富集分析结果显示,具有显著意义的通路共21条(P<0.05,FDR<0.05),其中与T2DM相关度较高的通路主要包括肿瘤、炎症、胰岛素抵抗等。见图6。
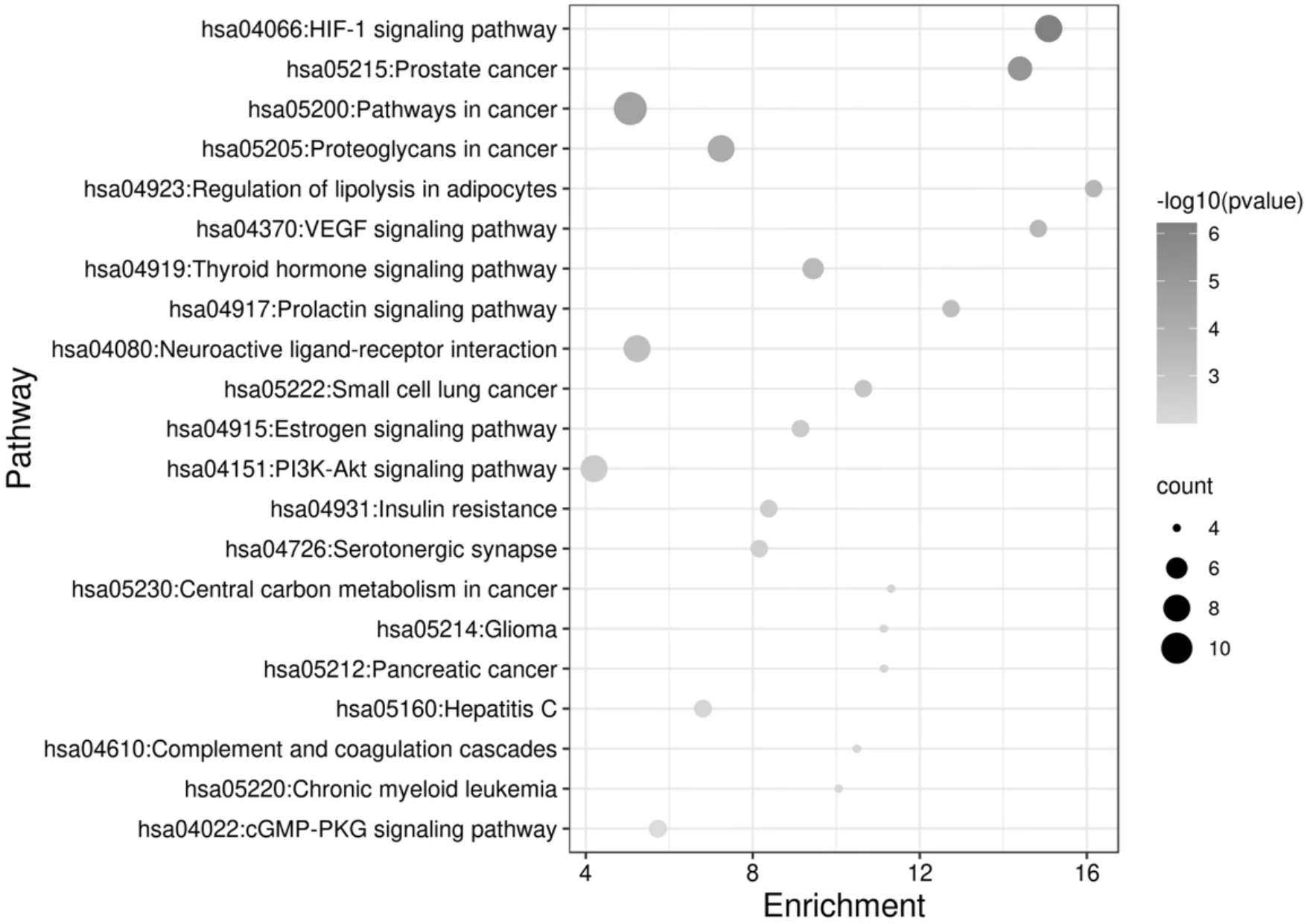
图6 KEGG富集分析气泡图
3 讨论
本研究通过网络药理学方法分析探讨山药治疗T2DM的分子机制。通过TCMSP数据库筛选出12个山药有效活性成分,对应72个靶点,与T2DM作用靶点进行维恩分析,得到41个共同靶点,通过构建“药物活性成分-共同靶点”网络图,预测山药的关键活性成分可能为薯蓣皂苷元、海风藤酮等。薯蓣皂苷元是一种具有非常高生物活性的天然甾体皂甙元,其治疗糖尿病及其并发症的研究已被广泛报道。研究表明,薯蓣皂苷元可以改善葡萄糖耐量和血脂水平,减少IL-1β,IL-6和TNF-α的产生,还能有效调节细胞凋亡、炎症和氧化应激的相关靶标和途径,从而改善糖尿病及其并发症[3-4]。海风藤酮是一种木脂素类化合物,具有较强拮抗血小板活化因子的活性、清除氧自由基、保护细胞膜免受活性氧自由基损伤等药理活性[5]。
根据PPI网络图分析可得,山药治疗T2DM的核心靶点主要为:AKT1、NR3C1、RELA、NOS2、SAA1。其中AKT1是一种丝氨酸/苏氨酸蛋白激酶,又称蛋白激酶B,可以调控胰岛素PI3K-AKT信号通路,从而调控葡萄糖和脂质代谢[6]。血清皮质酮和糖皮质激素受体基因(NR3C1)多态性与人类血糖异常相关[7]。RELA是体内重要的致炎因子,可调控细胞凋亡及炎症应答反应。诱导型一氧化氮合酶(NOS2)基因在T2DM易感性中起重要作用,其多态性被认为可能是糖尿病肾病的遗传危险因素[8]。血清淀粉样蛋白A(SAA)是一种急性期蛋白复合物,具有载脂蛋白特性,由几种丰富的同工型组成。研究表明,2型糖尿病初发或明显肾病患者SAA升高,且SAA与胆固醇转运蛋白,B类I清除剂受体(SR-BI)介导的胆固醇向血清外排有关[9]。GO功能富集分析显示,山药治疗T2DM涉及到肽基谷氨酸羧化、一氧化氮生物合成、对热的反应、对缺氧的反应等生物过程,有突触后、小窝、蛋白质复合物等细胞组分参与,可能通过结合酶、蛋白质、受体等物质发挥抗T2DM的作用。
KEGG信号通路富集分析发现,山药活性成分治疗T2DM的主要信号通路有:缺氧诱导因子1信号通路、癌症途径、调节脂肪细胞中的脂肪分解、血管内皮生长因子信号通路、PI3K-Akt信号通路和胰岛素抵抗,其中HIF-1信号通路是富集到的最显著的信号通路,该通路可能是山药治疗糖尿病的重要机制之一。HIF-1信号通路是机体低氧应激反应时的主要靶点。研究表明,抑制糖尿病小鼠HIF-1α的表达,能抑制RhoA/ROCK信号转导通路的激活,降低血清MDA表达、促进SOD的释放,从而降低糖尿病小鼠的血糖水平[10]。癌症途径主要与癌症疾病相关,与该通路相关的靶基因有11个,提示癌症可能与T2DM存在某些共同的靶基因。调节脂肪细胞中的脂肪分解、胰岛素抵抗这些通路都直接与糖脂代谢有关。VEGF是内皮细胞特异性蛋白质,具有强大的调控血管形成能力,在糖尿病视网膜病变的发病过程中起着至关重要的作用[11-12]。PI3K-Akt信号通路是一条经典的胰岛素代谢通路,同时在炎症反应中也有很大作用[13]。山药还可调节其他多条通路,说明其可通过多靶点,多途径发挥治疗T2DM的作用。
综上所述,本研究通过网络药理学方法对山药治疗T2DM的有效成分、关键靶点、显著信号通路进行研究,发现其主要活性成分一方面可直接调节糖脂代谢,对T2DM起到治疗作用,另一方面还可以调控细胞凋亡、调节炎症反应等,间接发挥治疗作用。本研究为天然药食同源中药产品的开发提供了理论依据。

