益生菌对体外循环致大鼠肺损伤影响研究
初 奇,李俞羲,曹惠鹃,孙莹杰,刁玉刚,张铁铮
1.锦州医科大学 北部战区总医院 研究生培养基地,辽宁 沈阳110016;2.北部战区总医院 麻醉科,辽宁 沈阳 110016
肺损伤是体外循环(cardiopulmonary bypass,CPB)心脏手术后常见的并发症,严重者可出现成人呼吸窘迫综合征[1-2]。CPB过程中,肠道和肺是炎性因子的主要释放器官及靶器官。肠道是全身炎性反应的“始动器官”和“原动力”,肺是全身炎性反应过程中最早出现功能障碍的器官之一[3]。而肠源性细菌、内毒素移位是多器官功能障碍综合征或急性呼吸窘迫综合征的始动因素。有研究表明,益生菌能够降低小儿急性肺损伤血清炎性因子水平并减轻肺损伤程度[4]。本研究通过建立大鼠CPB肺损伤模型,旨在探讨益生菌对CPB所致肺损伤的影响,为临床减轻CPB所致肺损伤提供参考。现报道如下。
1 材料与方法
1.1 实验动物及分组 选取30只清洁级健康雄性SD大鼠为研究对象,12周龄,体质量320~420 g,由北部战区总医院实验动物科提供。采用完全随机数字表法将大鼠分为假手术组(S组)、CPB组(C组),益生菌组(P组),每组各10只。本研究对大鼠的各项处置均符合动物伦理学标准。
1.2 研究方法 动物饲养环境如下:安静,空气清新,温湿度适宜(温度18~25℃,相对湿度55%~60%),12 h光暗循环。每天更换垫料,饲养期间动物可自由饮食和饮水。CPB开始前7 d,P组每日清晨用益生菌(丽珠医药集团,由双歧杆菌、乳酸杆菌和嗜热链球菌组成,每片含活菌数5×107CFU)2 ml灌胃,S组与C组用生理盐水2 ml灌胃;第8天C组和P组行动静脉置管并进行CPB转流60 min,S组仅置管不转流。
1.3 模型制备腹腔注射 2%戊巴比妥钠30 mg/kg对大鼠进行麻醉,气管插管(16 G套管针)成功后连接小动物呼吸机(江西省特力麻醉呼吸设备公司,TKR-200C型)行机械通气,潮气量3 ml/100 g,通气频率60次/min,吸呼比1.0∶1.5,同时监测大鼠的体温、心电及血氧饱和度。经左股静脉穿刺置管(22 G套管针),建立静脉补液通路;经尾动脉穿刺置24 G套管针,实时测量动脉压;右颈静脉穿刺置管,并将导管尖端置于心房(18 G,多侧孔以便引流);右股动脉置管22 G套管针用于心肺转流。置管后立即股经静脉给予肝素5 mg/kg,活化凝血时间值达到400~500 s行CPB。CPB环路由贮血器、BT00-300M型恒流蠕动泵(保定兰格恒流泵有限公司)、微型膜氧合器(广东科威医疗器械有限公司)及连接管道组成。CPB采用无血预充液16 ml,由乳酸钠林格液7 ml、琥珀酰明胶7 ml、15%甘露醇1 ml和5%碳酸氢钠1 ml组成。转流期间根据血气情况调节内环境,维持平均动脉压>60 mmHg(1 mmHg=0.133 kPa),pH值7.35~7.45,动脉二氧化碳分压35~45 mmHg,碱剩余-3~3 mmol/L。转流达到1 h后,缓慢减小转流量直至停止,启动呼吸机,重新恢复机械通气。停机前经股静脉注射1∶1鱼精蛋白中和多余肝素,依动脉血气结果适量补充钙和钾,根据情况给予去甲肾上腺素维持血压稳定。实验过程中维持大鼠体温在35.5℃~36.5℃。CPB结束后2h生命体征平稳视为模型建立成功[5]。
1.4 标本采集及检测指标 CPB结束2 h后抽取大鼠股动脉血进行血气分析。脊髓脱臼法处死大鼠后,抽取门静脉血1ml,2 500 r/min离心15 min,测定血浆二胺氧化酶(diamine oxidase,DAO)、D-乳酸、内毒素、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin 6,IL-6)水平。无菌条件下取腔静脉血约100 μl,接种于血平皿培养基上;取肝、肺、肾组织、肠系膜淋巴结0.1~0.2 g,放入盛有1 ml生理盐水的无菌研磨管中研碎成悬液,取20 μl接种于培养基上培养。24 h后由检验科专业技师应用全自动生化反应仪器(法国梅里埃公司,VITEK-2 COMPACT 60型)鉴定有无细菌生长及细菌种类,计算细菌易位发生率。取0.5 g右上肺叶组织,置于天平记录精确重量,记为湿重,然后放入恒温干燥箱,72 h后称重,记为干重,计算两者的比值,用于肺水肿评估。取左肺,经甲醛固定,石蜡包埋,HE染色等步骤,观察病理学变化并进行肺损伤评分[6]。
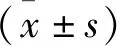
2 结果
2.1 各组大鼠血液指标比较 C组与P组大鼠D-乳酸、内毒素、TNF-α、IL-6、DAO均显著高于S组,且C组高于P组,差异均有统计学意义(P<0.05)。见表1。
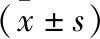
表1 各组大鼠血浆指标比较
2.2 各组大鼠细菌易位发生率比较 检测各组大鼠50个部位,共检出大肠杆菌、肠球菌、棒状杆菌及变形杆菌4种细菌53株,均属肠道常驻菌。S组、C组和P组细菌易位发生率分别为6%(3/50)、66%(33/50)、34%(17/50)。C组与P组细菌易位发生率高于S组,且C组高于P组,差异均有统计学意义(P<0.05)。
2.3 各组大鼠肺损伤病理表现 S组大鼠肺组织结构清晰完整,未见明显异常;C组大鼠部分肺泡壁断裂、肺泡腔塌陷,可见炎性细胞、红细胞和水肿液渗出;P组大鼠肺泡间隔增宽,肺泡毛细血管扩张,少量炎性细胞及红细胞渗出。见图1。

图1 各组大鼠肺损伤病理表现(a.S组;b.C组;c.P组;HE×200)
2.4 各组大鼠肺功能指标比较 C组、P组大鼠肺损伤评分、湿/干重比值、呼吸指数明显高于S组,且C组高于P组,差异有统计学意义(P<0.05)。C组、P组大鼠氧合指数明显低于S组,且C组低于P组,差异有统计学意义(P<0.05)。见表2。
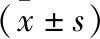
表2 各组大鼠血气指标及肺功能指标比较
3 讨论
CPB所致肺损伤是心脏手术常见的并发症之一[7]。CPB过程中,全身炎性反应是激活的补体系统、内毒素血症和炎性因子共同作用的结果。CPB期间,腹腔脏器较大脑等重要脏器更早、更显著地出现血流量减少,处于低灌注、低氧状态,导致肠道屏障功能损伤[8]。肠黏膜屏障功能受损是全身炎性反应综合征、多器官功能障碍综合征的重要诱因。而肺是全身炎性反应过程中最早出现功能障碍的器官之一[9]。有研究表明,口服益生菌可降低老年肋骨骨折患者肺炎发生率,改善肺功能,且无明显不良反应[10]。另有研究表明,口服益生菌通过增加体液免疫和细胞免疫,可增加小鼠抵抗流感病毒的能力[11]。本研究将益生菌用于CPB大鼠,观察其对CPB大鼠肺损伤的影响。
益生菌是对健康有益的活菌补充剂,利用益生菌的内源性防御屏障和免疫性防御屏障作用拮抗致病菌来保护肠黏膜屏障,降低内毒素浓度、减少菌群易位和脂质过氧化等[12]。DAO是哺乳动物肠黏膜上层绒毛细胞胞质中具有高度活性的细胞内酶。DAO在外周血中活性稳定,是反映黏膜上皮细胞成熟度和完整性的血浆标志物[13]。当肠黏膜上皮细胞受到损伤后,DAO释放入血液,导致血浆DAO水平升高。D-乳酸是胃肠道固有细菌的产物,正常情况下很少被机体吸收,在肠黏膜损害和通透性增加后可入血液。因此,血液中D-乳酸水平可以反映肠黏膜损害状况和通透性的变化程度[14]。本研究结果表明,预先给予大鼠服用益生菌,可降低血浆DAO活性和D-乳酸水平,减少CPB对肠黏膜屏障的破坏,降低肠黏膜通透性。本研究结果表明,CPB可使大鼠血浆内毒素水平及远隔脏器细菌易位发生率显著升高,而预先给予益生菌可显著降低血浆内毒素水平及肠道菌常驻菌的易位发生率。本研究结果还表明,预先给予益生菌可降低CPB诱发的血浆TNF-α和IL-6水平升高,在一定程度上减轻CPB引起的全身炎性反应,减轻CPB致大鼠肺损伤程度,表现为氧合指数升高,呼吸指数下降,肺组织含水量下降,肺泡、肺泡腔和肺泡间隔的病理学改变均明显减轻。
综上所述,益生菌可在一定程度上改善CPB后大鼠肠屏障功能,减轻CPB所致全身炎性反应,进而减轻CPB所致大鼠肺损伤,起到保护肺组织、改善肺功能的作用。

