基于一类混合配位点有机配体合成的3个配位聚合物
王晓芳
(攀枝花学院 钒钛学院国家钒钛检测重点实验室,四川 攀枝花617000)
配位聚合物结构和拓扑类型复杂多样,在许多领域存在着巨大价值[1-3].由于配体在配位聚合物所起的关键性作用,不同的O-或N-供体的有机配体被设计出来[4].O-供体,主要来源于有机羧酸类配体,其中值得注意的是含有间苯二甲酸片段的配体被广泛使用[5].2014年He等[6]总结了诸多由含间苯二甲酸片段的有机配体合成的多孔配位聚合物材料的优秀成果,并指出该类有机配体对获得材料的功能性至关重要.N-供体主要来源于吡啶、咪唑、三唑、四唑等基团,特别是含有5-四唑基类有机配体具有较强的连接能力和较好的结构稳定性[7-9].
有时仅含一种O-或N-供体配体不能够满足某些金属有机框架结构和功能特性的需求,因此把含不同供体的有机片段结合在一个配体中将会是一种有效的策略.这会使配体通过不同的配位模式与金属中心配位,会更有助于获得预想不到的结构,为构建具有更高复杂性和更多功能性的新结构提供机会.随着研究的深入,越来越多的混合供体的配体被用于构建功能性较强的配位聚合物材料中,关于含O-和N-混合配位点的有机配体的综述参见文献[10].
综上所述,一个配体中同时含有间苯二甲酸和四氮唑有机片段可以与金属中心有非常丰富的配位方式,有利于合成出理想的配位聚合物材料.虽然关于这类配体的研究相对有限,但一些颇具特色的成果已经被报道[11-12].
基于以上原因,选用目前较少使用的有机配体5-四氮唑基-间苯二甲酸(H3TZI)和(5-(4-(1H-四唑基)苯基)间苯二甲酸(H3TZPI)与不同金属中心配位,合成得到 3个配位聚合物([Eu(TZI)(H2O)5]·2H2O(1)、[Tb(TZI)(H2O)4]·5H2O(2)和[Cd(H2TZPI)2(H2O)4]·H2O(3)),其中化合物1和2具有相似的1D双链结构,而化合物3具有0D结构,通过非共价相互作用进一步形成3D超分子结构.对3个化合物的热稳定性和荧光性质进行了研究.同时,对该类有机配体的配位方式进行总结和讨论.
1 实验部分
1.1 实验药品和仪器该实验中的所用都是分析纯化学试剂,未进行进一步纯化.
本实验中要使用的仪器如表1所示.
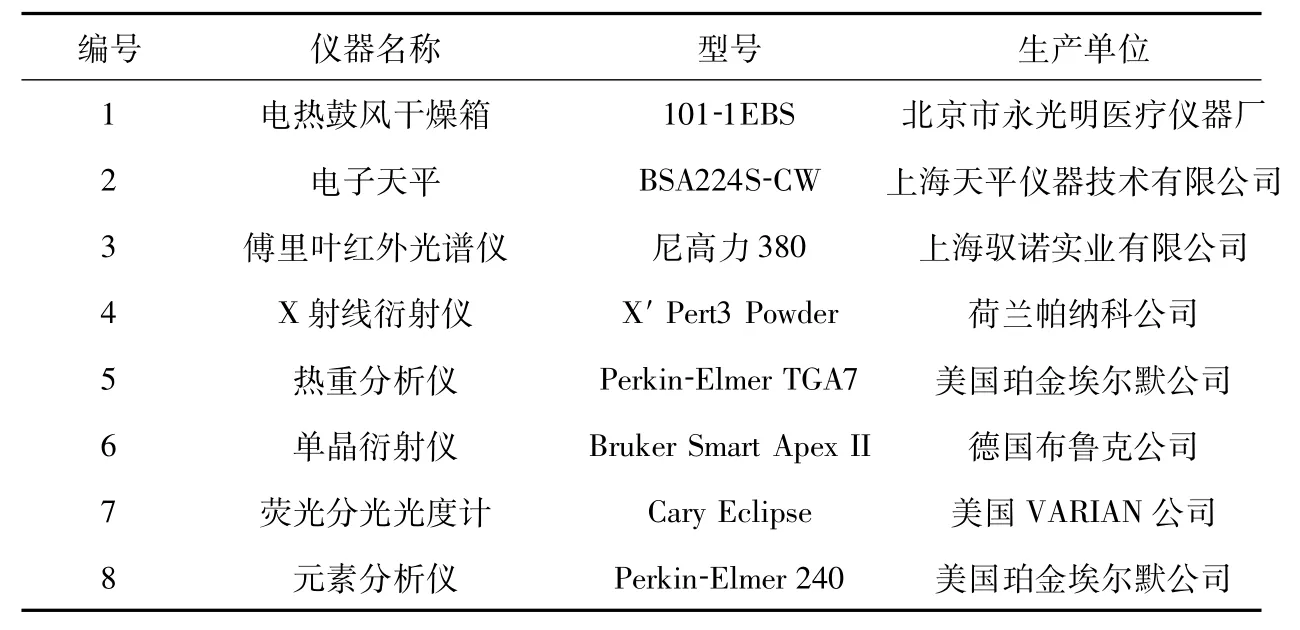
表1 实验仪器Tab.1 The experimental instruments
1.2 化合物的合成
1.2.1 化合物1和2的合成 化合物1和2的合成方法 相 似.将Eu(NO3)3/Tb(NO3)3(0.08 mmol,0.03 g),H3TZI(0.04 mmol,0.01 g),H2O 6 mL,乙醇2 mL,混合后用2 mol/L HNO3调节pH=5,然后装入到25 mL带有聚四氟乙烯内衬的不锈钢反应釜中,在150℃加热下反应72 h,得到无色块状晶体,过滤,用蒸馏水洗净并在室温下干燥.
1.2.2 化合物3的合成 在室温下,将3滴CdCl2·2.5H2O(0.1 mol/L)水溶液、3滴H3TZPI(0.05 mol/L)的N,N-二甲基甲酰胺溶液、EtOH(1.5 mL)和H2O(0.5 mL)混合均匀,在空气中缓慢挥发,约14 d获得无色棒状晶体.
化合物1~3的合成及表征参数见表2.
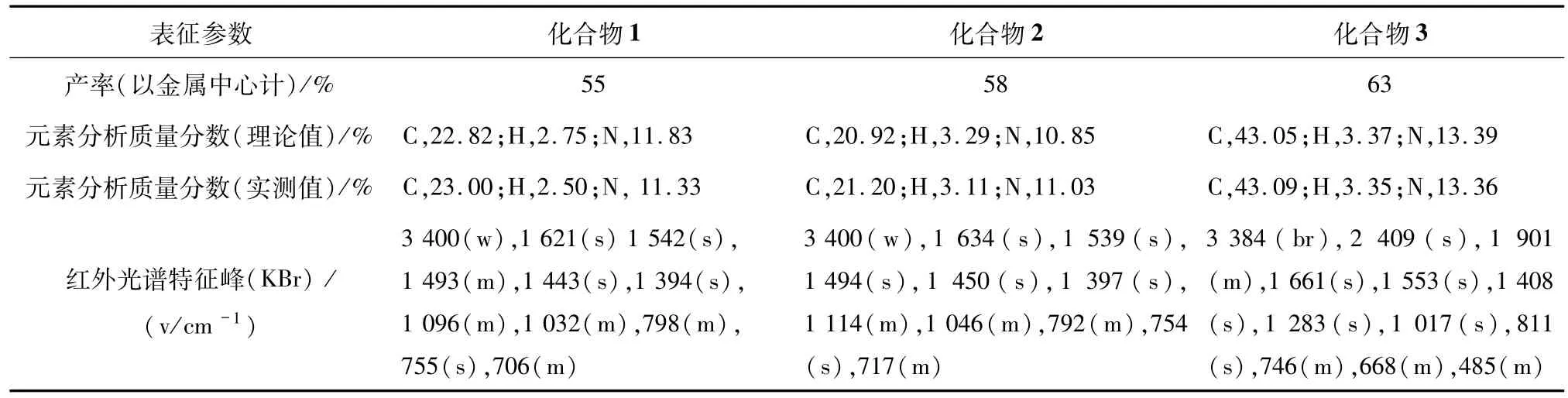
表2 化合物1~3的合成及表征参数Tab.2 Synthesis and characterization parameters of the title complexes 1-3
1.3 晶体结构分析经X射线单晶衍射仪收集数据,采用SHELXS-97程序分析,基于F2的全矩阵最小二乘技术进行对各向异性修正[13-15].所有非氢原子均为各向异性精修,有机配体以理论加氢方式加氢.对于化合物3,由于晶体结构中具有的无序性,OW2紊乱且占据2个位点,总占有率为1.化合物的结构测定的晶体数据见表3,其键长和角度数据列于表4和表5.
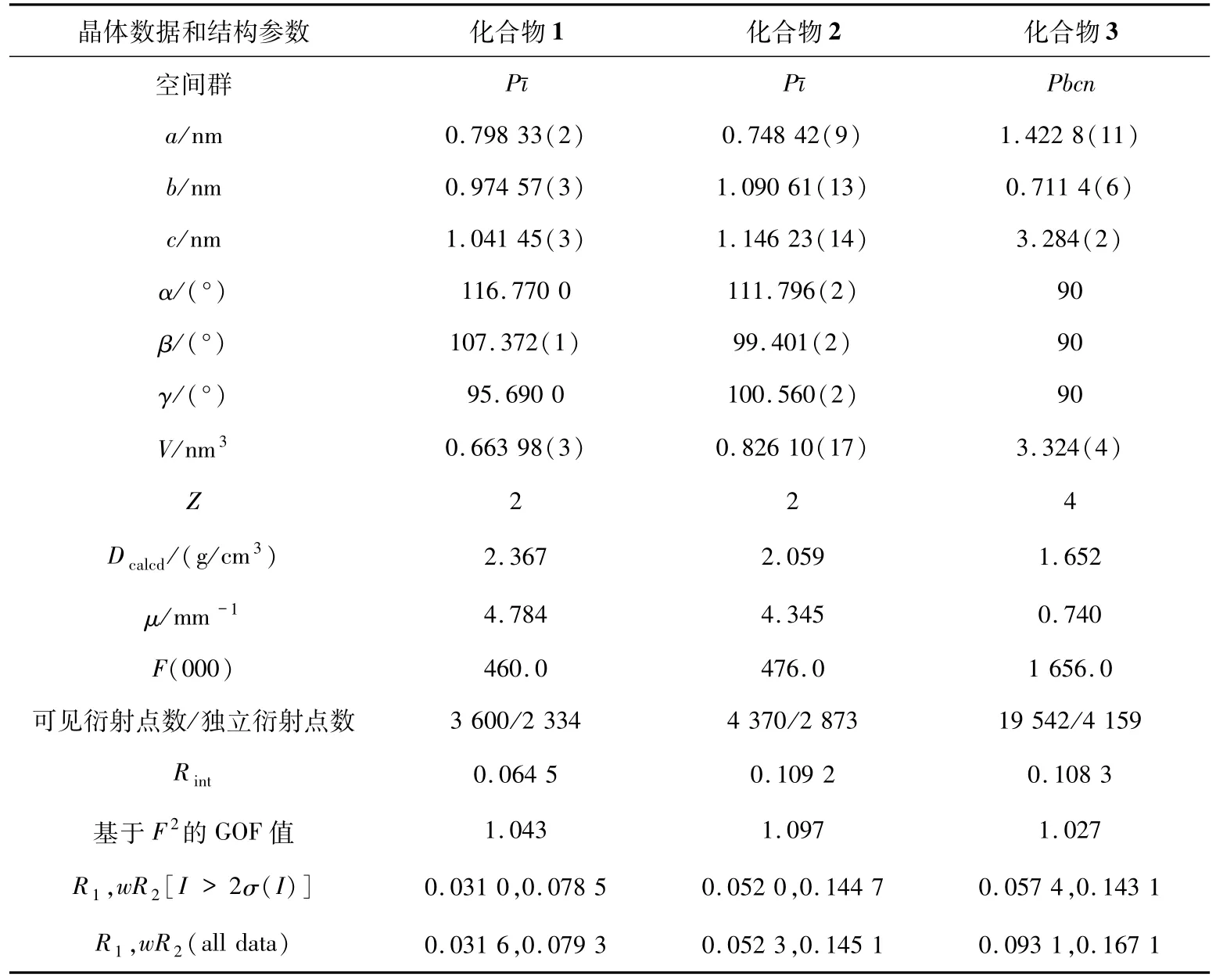
表3 (续)
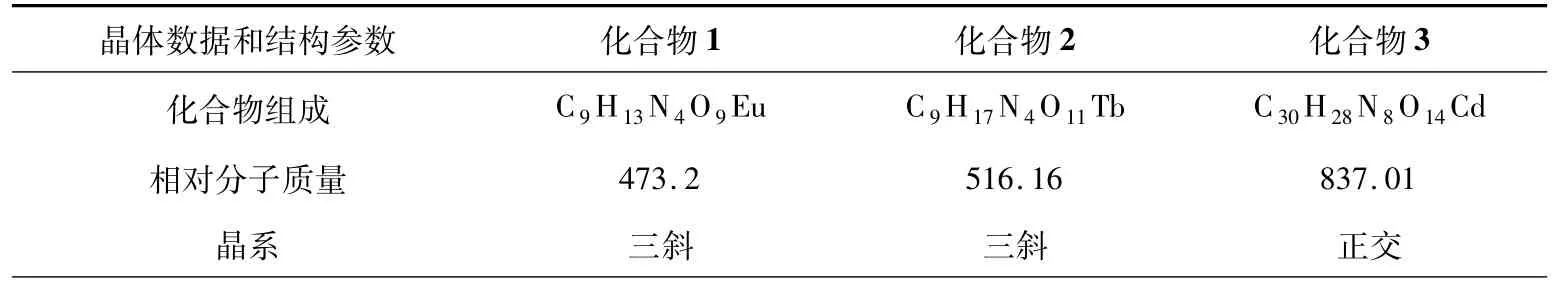
表3 化合物1~3的晶体数据和结构参数Tab.3 Crystal data and structure refinement of the title complexes 1-3
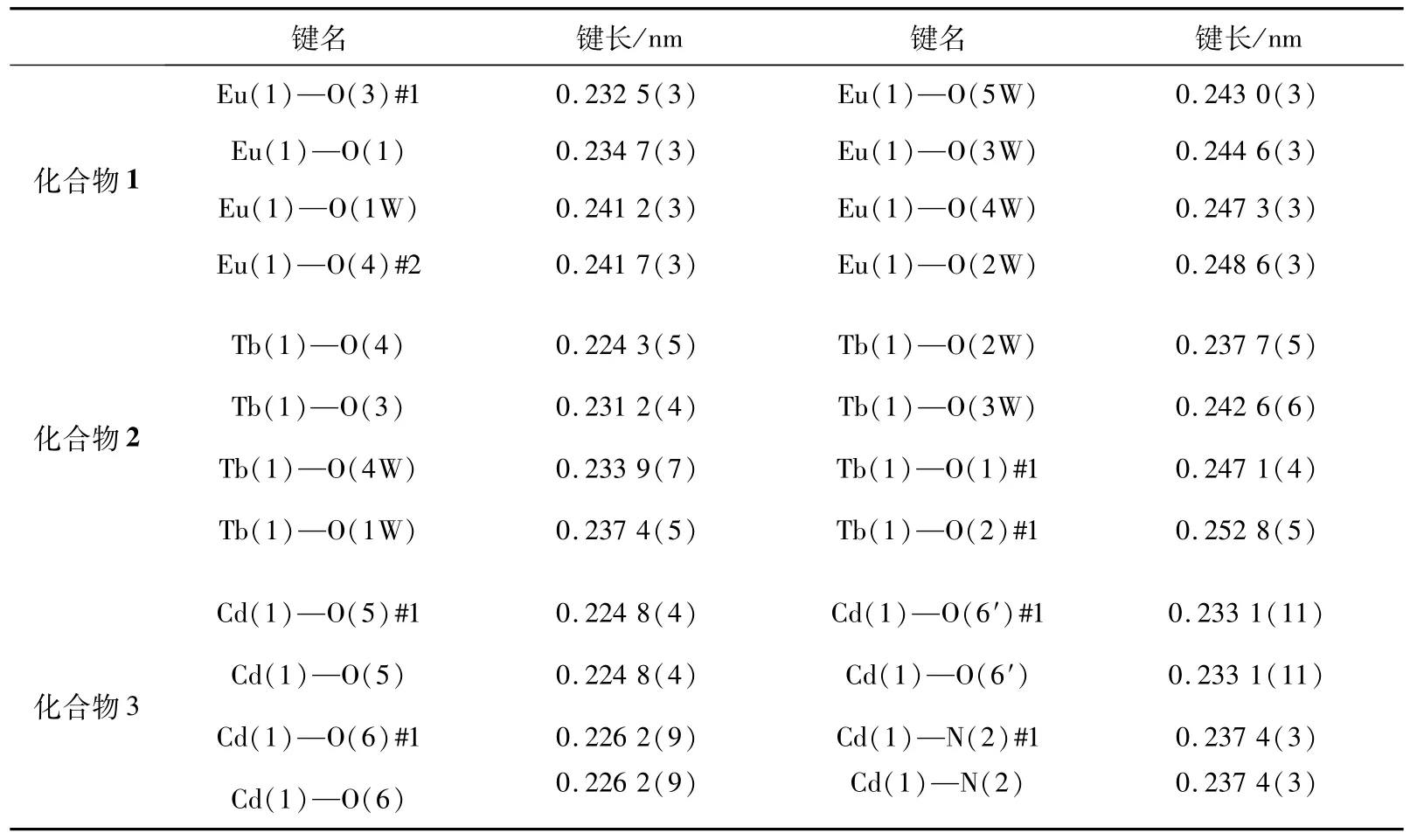
表4 化合物1~3的部分键长Tab.4 Selected bond lengths(nm)for 1-3
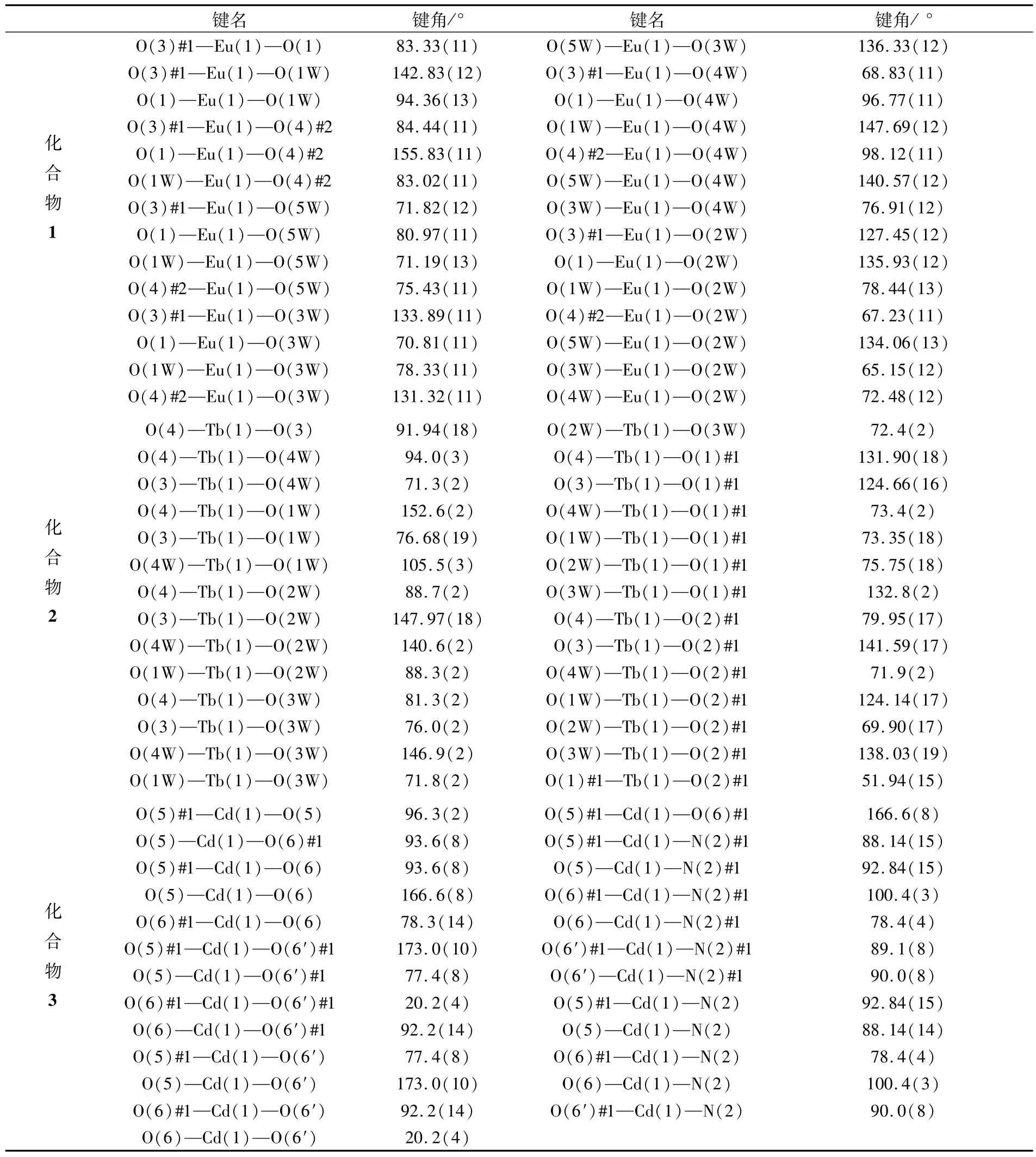
表5 化合物1~3的部分键角Tab.5 Selected bond angles for 1-3
2 结果与讨论
2.1 化合物1的晶体结构描述化合物1结晶于三斜晶系,Pī空间群,其不对称单元包含一个Eu3+离子,一个TZI3-配体,5个终端配位水分子.该结构中,配体连接3个金属中心,配位方式可以描述为 μ3-η1:η1:η0:η1:η0:η0:η0:η0(图1(a)).金属中心是八配位,呈扭曲的双帽三棱柱的配位几何构型(图1(b)),与来自于3个TZI3-配体的3个羧基氧原子、5个端基水氧配位(Eu—O键长范围为从0.232 5(3)到0.248 6(3)nm(表4)).配体连接金属中心形成双核基本单元(图1(c)),这些基本单元通过配体连接形成1D的双链结构(图1(d)).可以发现,四氮唑完全没有参与配位,四氮唑以指向双链内部的形式空在骨架中.
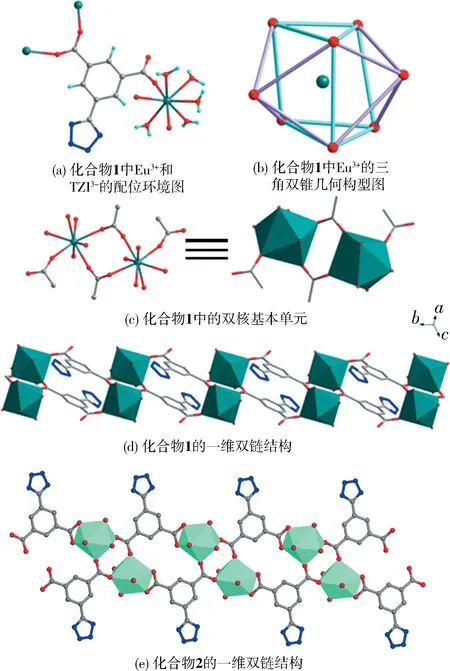
图1 化合物1和2的结构展示图Fig.1 Structure diagram of complexes 1 and 2
2.2 化合物2的晶体结构描述化合物2与化合物1的结构相似,形成相似的双核基本单元及一维双链结构.Tb—O键长范围为从0.224 3(5)到0.252 8(5)nm(表4)).结构中四氮唑完全没有参与配位,但是与化合物1不同的是,在化合物2中,四氮唑以背离双链内部的形式空在骨架中(图1(e)).
2.3 化合物3的晶体结构描述化合物3结晶于正交晶系,Pbcn空间群.其不对称单元中含有一个Cd2+离子,一个独立的H2TZPI-阴离子和2个端基配位水分子,见图2(a).金属中心Cd2+为八配位,周围连接着6个O原子和2个N原子(即CdN2O6结构单元),呈扭曲的八面体配位几何构型.其中N2和N2#1(Cd—N=0.237 4(3)nm)来自于四唑基团,6个氧原子来自于6个配位水分子(Cd—O=0.224 8(4)-0.233 1(11)nm).Cd2+连接两个有机配体形成如图2b所示的零维结构.相邻的结构片段通过分子间氢键相互作用(O(4)—H(4)…N(1),0.272 8(5)nm,N(4)—H(4A)…O(2),0.266 4(5)nm,C(13)—H(13)…O(4),0.316 3(6)nm),进一步形成3D超分子骨架,见图2(c).
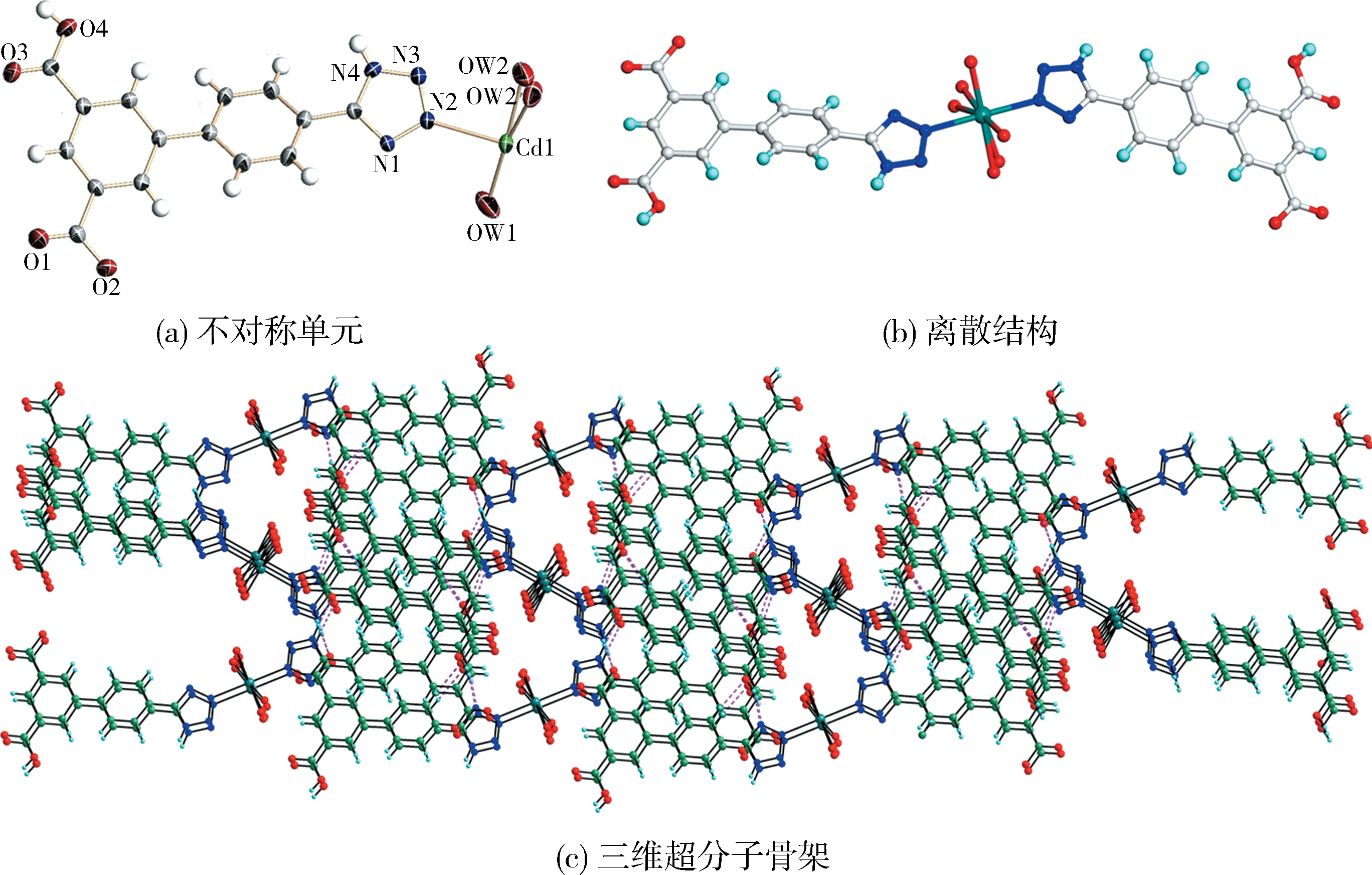
图2 化合物3的结构展示图Fig.2 The structure of complex 3
2.4 化合物1~3的热稳定性分析化合物1~3的热稳定性分析结果如图3.
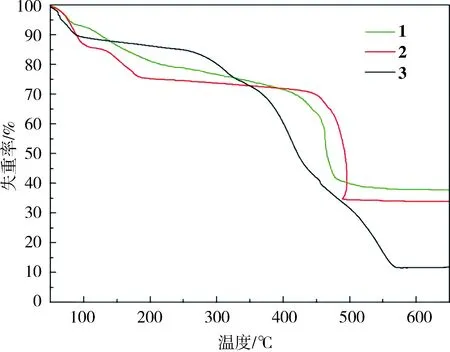
图3 化合物1~3的热重分析图Fig.3 Thermogravimetric analysis curves of 1-3
化合物1在120℃之前失重6.94%,归属于2个客体水分子失重(理论值:7.10%),120~240℃失重19.31%,可归属于配位水分子的移除(理论值:17.67%),240℃之后骨架逐渐坍塌,最后残余34.73%对应于EuO3/2(理论值:34.56%).
化合物2的失重可分为3个阶段,第一阶段从120℃之前失重14.81%,归属于5个客体水分子(理论值:14.85%),第二阶段为120~200℃失重12.13%,可归属于4个配位水分子的移除(理论值:11.88%),第三阶段为200℃之后骨架逐渐坍塌,最后残余32.43%对应于TbO3/2(理论值:30.27%).
化合物3在100℃之前第一次失重约11.16%,归因于失去的配位水分子造成的失重(理论值:11.00%).第二步是在255~550℃范围,骨架完全坍塌,(计算值:75.10%,理论值:75.28%),最终的残余物应为CdO,残留量为13.74%(计算值:15.68%).
2.5 PXRD分析化合物1~3的PXRD表明合成的晶体材料与理论的纯单晶体是相同的,如图4所示.
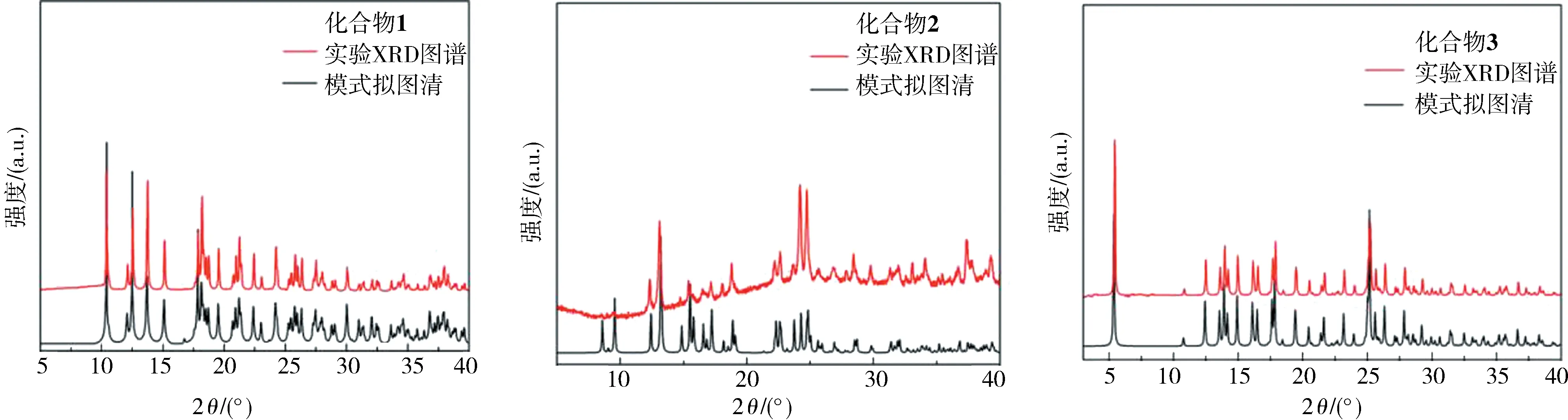
图4 化合物1~3的实测PXRD图和模拟PXRD图Fig.4 The PXRD patterns of 1-3
2.6 发光特性化合物1~3的固体荧光光谱是在室温条件下测定的,其发射光谱如图5所示.
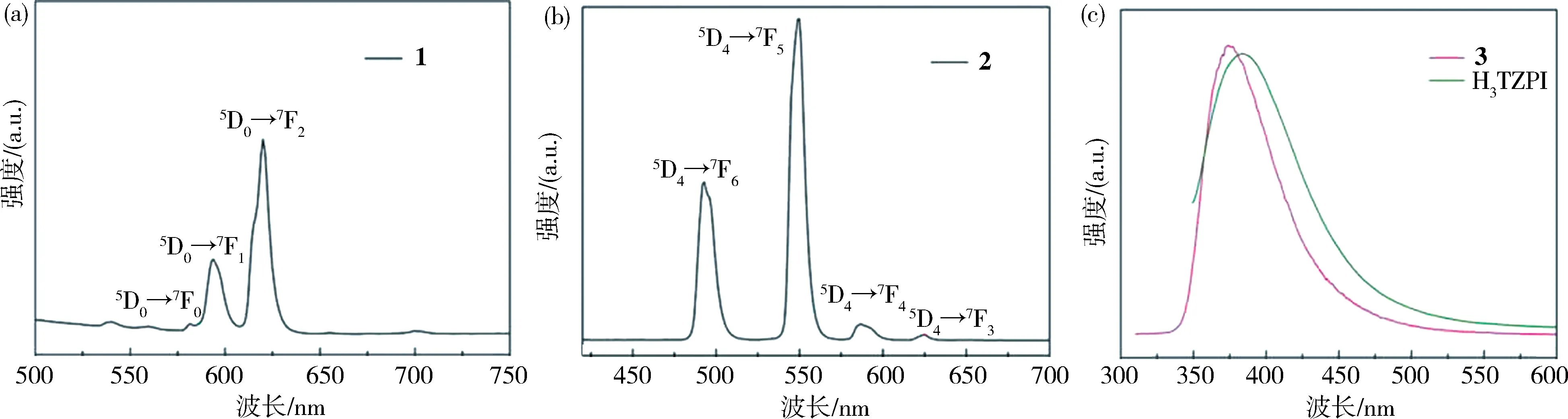
图5 化合物1~3和H 3 TZPI配体的固态发射光谱Fig.5 The solid-state emission spectra of 1-3 and the H 3 TZPI ligand
在395 nm的激发波长下,化合物1的发射峰是在580、593和620 nm处,可以归属为Eu3+离子的5D0→7F0、5D0→7F1和5D0→7F2的电子跃迁.其中,5D0→7F2的电子跃迁的发射强度要比5D0→7F1的更强一些,这表明Eu3+离子具有低的对称性和未处于反演对称中心,与该结构的单晶结构分析是一致的,5D0→7F0出现的发光强度同样支持此结论.另外,在620 nm处出现的最强发射峰说明化合物1发出强的红光.
在395nm的激发波长下,化合物2的发射峰是在493、550、587和625 nm处,可以归属为Tb3+离子的5D4→7F6,5D4→7F5,5D4→7F4和5D4→7F3电子跃迁.该化合物的光谱是由550 nm波长处的5D4→7F5能级跃迁决定,输出的是强烈的绿光.
化合物3在激发波长λex=277 nm下的最大发射峰为λmax=374 nm.配体H3TZPI在激发波长λex=328 nm的最大发射峰为λmax=385 nm,这可能是由于的π*→π或π*→n跃迁.自由配体的最大发射峰和化合物3的最大发射峰相比,化合物3的发射带相对于H3TZPI发生了蓝移.由于具有d10构型的Cd2+离子难以氧化或还原,所以该配合物的发射既不是金属对配体电荷转移(MLCT)也不是配体对金属转移(LMCT),而是由金属-配体相互作用和羧基配体的去质子化作用引起的[14].
2.7 H 3 TZPI配体的配位方式总结与讨论H3TZPI是同时含有间苯二甲酸片段和四氮唑片段的混合配位点的双官能团有机配体,据我们所知目前对此配体的研究还比较有限.利用此配体与不同的过渡金属中心配位,获得了一系列具有不同结构特征的配位聚合物.由于该配体具有双官能及配位点丰富等特点,使得该配体在不同结构中展现出了多种配位模式.基于以往的报道以及我们前期的工作,该配体已发现的配位方式有6种 (图6),分别连接1、2、3、6个金属中心.
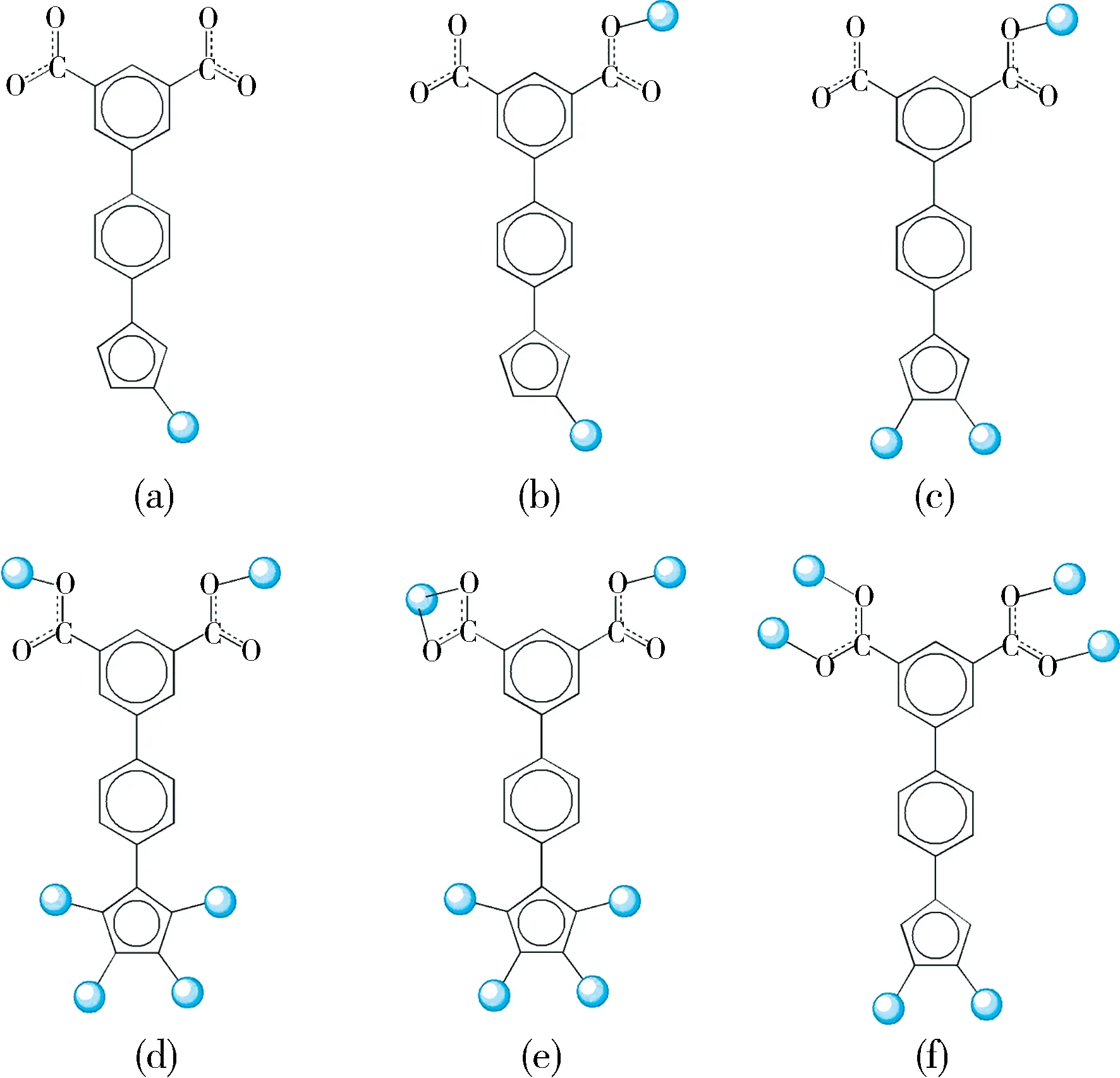
图6 已发现的配体H 3 TZPI的配位方式Fig.6 The reported coordination modes of H 3 TZPI
其中图6(a)的配位方式
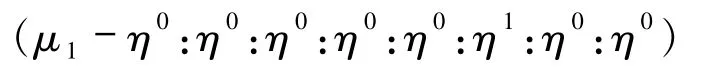
为化合物3中结构所采用,配体仅连接了一个Cd(II)金属中心,形成的是0D片段的主体骨架;图6(b)的配位方式为
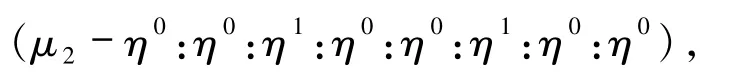
配体连接两个Cd(II)金属中心,形成的是1D双链结构的主体骨架[16];配体连接3个Cu(II)金属中心以图6(c)的配位方式
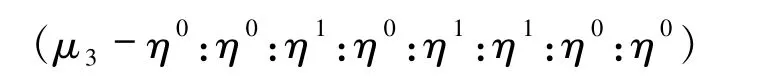
配位,形成含有六边形孔道的2D层[17];配体以图6(d)(μ6- η0:η1:η1:η0:η1:η1:η1:η1)、图6(e)(μ6-η1:η1:η1:η0:η1:η1:η1:η1)的配位方式分别连接六个Zn(II)、Cd(II)金属中心,形成5-连接的(46·64)、(44·66)拓扑结构[18-19];图6(f)的配位方式
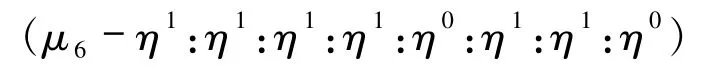
使配体连接6个Cu(II)金属中心形成的骨架为经典的(3,24)-连接rht拓扑网络结构[20].
值得注意的是,目前该配体与金属中心Cd(II)配位共得到了3个化合物,分别连接了1、2、6个金属中心,对应得到的结构分别为零维片段、一维双链以及三维(44·66)拓扑结构.
明显地,配体越少的配位点参与配位,得到的结构相对越简单,说明要想得到结构复杂的、高维度的理想结构,选择尽量多的配位点的配体虽不是充分条件,但是是必要的前提.
3 结论
通过使用一类混合配位点有机配体(5-四氮唑基-间苯二甲酸(H3TZI)和(5-(4-(1H-四唑基)苯基)间苯二甲酸(H3TZPI))与不同金属中心配位,合成得到3个配位聚合物:
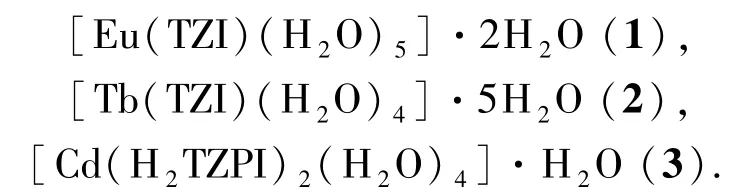
其中化合物1和2具有相似的1D双链结构,而化合物3具有0D结构,但通过非共价相互作用形成了3D超分子结构.对3个化合物的热稳定性和荧光性质进行了研究.同时,基于以往的报道和我们之前的研究结果,对配体H3TZPI的配位方式及其参与形成的结构进行了总结讨论.理论上,该类配体仍具有许多的配位方式有待探索.虽然遗憾的是,得到的化合物1~3并非理想的结构和功能材料,但可以预期的是,利用该类配体的结构优势,将会合成更多具有丰富结构及显著特性的材料.因此,接下来关于该类有机配体的研究将会继续.
致谢攀枝花学院校级项目(2017YB008)对本文给予了资助,谨致谢意.

