姜黄素改善非酒精性脂肪性肝病的研究进展
孙秋爽,郭雅婷,庄玉,黄芳,邱志霞
(1.中国药科大学中药学院,江苏 南京 211198;2.中国药科大学药学院,江苏 南京 211198)
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是目前最为常见的慢性、非传染性肝病之一,影响着全球近四分之一的成年人口;此外,NAFLD在青少年及儿童中的流行率也日益提高,因此NAFLD是一个全球性的公共健康问题[1]。近年来,随着肥胖和2型糖尿病(Type 2 diabetes,T2DM)等代谢综合征的发生发展,NAFLD的患病率和发病率也逐年升高[2-3]。NAFLD已成为过去几十年来美国肝脏移植最普遍的病因之一,也是我国第一大慢性肝病,发病率已达到15%~20%[4]。按照疾病程度及病变肝组织是否伴有炎症反应和纤维化,NAFLD又分为单纯性非酒精性脂肪肝(Nonalcoholic fatty liver,NAFL)和非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)以及NASH相关的肝硬化等[5]。大量研究表明,NAFLD可以由最初的脂肪变性,逐渐演变为NASH、肝硬化,最终可能发展到肝癌[6]。由于NAFLD的发病机制较为复杂,且在较多的肝硬化以及肝癌患者的疾病进程中往往被忽略,因此NAFLD的临床早期干预意义重大。虽然已经有许多药物处于不同的临床研究阶段,但目前尚没有临床特效药物,现有的治疗方案主要是调控糖脂代谢[7-8],如使用胰岛素增敏剂,他汀类、贝特类等降脂药物来缓解NAFLD的相关病症。但上述药物在使用过程中,患者往往会出现耐受不良或者其他安全问题:如胰岛素增敏剂使用期间多会伴随患者体质量增加以及贫血等副作用;他汀类药物长期使用时,很多患者会出现他汀不耐受以及横纹肌溶解等肌毒性问题。因此,开发有效性、耐受性以及安全性均优的治疗NAFLD的药物已成为该领域的研究热点和难点。
中药活性成分具有多靶点、多通路、低选择性等特点,在干预和治疗NAFLD等具有复杂病理机制的代谢性疾病上具有耐受性、安全性和有效性等方面的潜在优势[9],如研究较多的水飞蓟宾、姜黄素、白藜芦醇等。其中,姜黄素作为一种从姜黄根中提取的天然多酚化合物,毒性低,被广泛应用于食品添加剂、食品色素和医药领域等[10],在许多国家尤其是亚洲国家已经有着数百年的应用历史。在我国传统医学中,姜黄具有散瘀、止痛等功效[11];现代研究表明,姜黄素是姜黄中的主要活性成分,多项研究发现其具有抗炎、抗氧化、抗病毒、降糖、降脂、抗肿瘤和清除氧自由基等多种药理作用[12]。近年来发现姜黄素可以改善肝脏脂肪堆积、抗肝纤维化等,其在治疗肝脏疾病方面表现出良好的应用前景,已被推荐用于胰岛素抵抗、肥胖、糖尿病等多种与糖脂代谢紊乱相关疾病的干预和治疗[13-14]。目前,已经有多项临床试验证实姜黄素可缓解NAFLD患者的症状[15-16]。在一项NAFLD患者的临床研究中,102名受试者随机接受安慰剂或1 000 mg/d的姜黄素,持续8周,结果发现姜黄素显著改善NAFLD患者的肝脏脂肪变性,且没有耐受不良等安全性问题[17]。因此,越来越多的研究关注姜黄素对NAFLD的预防和治疗。由于NAFLD发病机制复杂,姜黄素又有众多的分子靶标[18],其对NAFLD作用机制并不十分明确,大多都还处在探究中。本综述就姜黄素治疗NAFLD的药理作用及相关机制进行归纳总结,为其临床上对NAFLD的可能应用提供必要的理论依据和数据支撑。
如图1所示:①内脏脂肪组织脂解产生游离脂肪酸(Free fatty acid,FFAs)经过肝脏上的脂肪酸转运体转运入肝脏中,通过酯化反应合成甘油三酯;②血浆和线粒体内的柠檬酸在胞浆ATP-柠檬酸裂解酶的作用下生成乙酰辅酶A,在肝脏内经过乙酰辅酶A羧化酶(Acetyl-coA carboxylase,ACC)和脂肪酸合成酶(Fatty acid synthase,FAS)等的作用下生成甘油三酯;③肝脏内的甘油三酯经过肉碱棕榈酰转移酶1(Carnitine palmitoyltransferase 1,CPT-1)的作用转入线粒体进行氧化供能;④肝脏内的甘油三酯以极低密度脂蛋白(Very low-density lipoprotein,VLDL)的形式分泌进入循环系统[19-20]。姜黄素可以通过抑制肝脏上脂肪酸转运体的表达和降低肝脏内柠檬酸的含量从而减少肝脏内甘油三酯的蓄积及其导致的炎症浸润,并且可以进一步抑制肝脏内肝星状细胞的激活及维持细胞外基质的平衡,最终改善NAFLD。
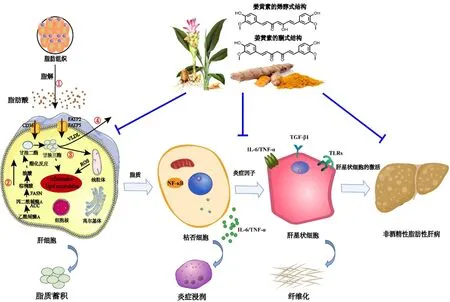
图1 姜黄素调控脂质代谢、抗炎、抗纤维化等改善NAFLD
1 调控脂质代谢改善NAFLD
肝脏是脂质代谢的主要场所,负责调控脂质获取和处置之间的稳态平衡。除外源性食物,血液中的FFAs摄取入肝脏和肝内脂质从头合成是肝内脂质的主要来源;肝脏内的脂质处置则主要通过CPT-1的作用转入线粒体进行氧化供能,或通过VLDL进入血液循环[21]。当肝脏内的脂质来源大于利用时,脂质的动态平衡被打破,且随患者病理进程比重增加,最终造成脂质在肝脏的异常堆积[22]。当肝脏内脂质异常堆积达5%及以上即引起脂肪变性,这是NAFLD的主要特性;而脂肪变性是NASH发展的必要环境,并不断引起肝脏炎症、纤维化,直至肝硬化甚至肝癌[22-23]。Wei等[24]报道了一项临床上的随机对照试验,检验了姜黄素对NAFLD中代谢参数的影响。与安慰剂相比,姜黄素干预后可以显著降低血浆低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)、甘油三酯、空腹血糖和体质量等水平。Jang等[25]研究发现,姜黄素可以降低高脂喂养仓鼠的血液循环中和肝脏内脂质水平。因此,姜黄素在改善NAFLD等代谢性疾病上是有很大优势的,其可以在抑制肝脏内脂质合成、降低脂质摄取、减少脂质异位转移和促进脂肪酸氧化等多个层次调控脂质平衡。
1.1 抑制脂质从头合成
脂质从头合成是一个主要发生在肝胞浆液内的、复杂且高度协调的酶促反应:胞浆内柠檬酸在ATP-柠檬酸裂解酶(ATP-dependent citrate lyase,ACLY)作用下生成乙酰辅酶A,其后经由ACC催化生成丙二酰辅酶A,继而在FAS作用下催化合成脂肪酸[26]。在NAFLD状态下,肝内ACC和FAS等脂肪酸合成和其相关酶系表达增加,脂质从头合成可贡献多达25%的肝脏脂肪储备,是肝脏内脂质异常堆积的重要来源[23]。研究发现,姜黄素通过抑制脂质从头合成过程的3个关键酶ACLY、ACC和FAS的基因表达(抑制程度分别为95%、50%和77%)来改善高果糖诱导的高脂血症和肝脏脂肪变性[27]。此外,姜黄素通过调节ACC、超氧化物歧化酶1(Superoxide dismutase,SOD1)等蛋白表达来缓解Wistar大鼠NASH的进程[28]。有研究发现,姜黄素激活高脂喂养小鼠肝脏AMP依赖的蛋白激酶[Adenosine 5'-monophosphate(AMP)-activated protein kinase,AMPK]后可以调控胆固醇调节元件结合蛋白(Sterol-regulatory element binding protein,SREBP)和ACC磷酸化来抑制脂肪酸和胆固醇合成,以此减少肝脏脂质堆积、改善胰岛素抵抗、脂肪性纤维化[29]。本课题组的研究也发现,姜黄素可以在蛋白和基因水平上调控ACLY、ACC和FAS三者的表达;并可直接影响ACLY的代谢功能,从而减少肝脏内的间接碳源-柠檬酸的通量,降低细胞内的乙酰辅酶A这一直接碳源,在源头上抑制肝脏内脂质合成,改善肝内的脂肪异常堆积。
另外,由于胞质乙酰辅酶A主要来源于柠檬酸,而柠檬酸的供应直接决定着乙酰辅酶A的通量[30-31]。在肝脏中,胞质内的柠檬酸主要来源有3种,一是线粒体内三羧酸循环来源的柠檬酸经线粒体膜上的柠檬酸转运体(SLC25A1)转运;二是质膜柠檬酸转运蛋白(SLC13A5)从循环系统摄取;三是来源于谷氨酰胺分解中α-酮戊二酸的羧化反应[32]。不断有研究发现,SLC13A5的表达在肥胖或NAFLD患者、高脂喂养的恒河猴和NAFLD模型小鼠的肝脏中显著上调[33]。本课题组研究也发现姜黄素通过抑制SLC13A5转运活性、调控其蛋白表达可改善NAFLD模型小鼠的肝脏脂质堆积、脂肪变性与胰岛素抵抗[34]。然而,姜黄素如何调控SLC13A5的表达来改善NAFLD还有待进一步研究。
1.2 降低脂质摄取
白色脂肪脂解释放的FFAs经循环系统运输至肝脏[35]。但由于FFAs被动转运效率较低,需要经肝质膜上的脂肪酸转运体摄取进入肝细胞,包括脂肪酸移位酶(Fatty acid translocase,FAT/CD36)、脂肪酸转运蛋白(Fatty acid transport protein,FATPs,主要是FATP2/5)、脂肪酸结合蛋白1(Fatty acid binding protein 1,FABP1)等[36-38]。Wilson等[39]发现在FFAs升高的情况下,CD36通过调节肝细胞对脂肪酸的摄取参与NAFLD的发生和发展。在肥胖患者体内,FFAs和FATPs的增加与肝脏脂肪变性、纤维化和肝损害密切相关[40];而特异性敲除小鼠肝脏的FATP2/5可显著抑制FFAs的摄取,从而显著改善高脂喂养导致的肝脏脂肪变性[41-42]。肝脏的FABP调控肝星状细胞的激活并改善NAFLD[43],因此可以作为潜在的治疗靶点[44]。Mun等[45]发现姜黄水提物可以显著降低高脂饮食诱导的NAFLD小鼠肝脏上CD36、FATP2/5、FABP1等脂肪转运体的表达,从而改善肝脏的脂质蓄积。也有报道指出,姜黄素的聚乙二醇衍生物也可以通过激活cAMP反应元件结合蛋白(cAMP Response element binding protein,CREB)来抑制CD36的表达,进而减弱高脂饮食诱导的肝脂肪变性[46]。姜黄素可增强过氧化物酶体增殖物激活受体(Peroxisome proliferators-activated receptors,PPARs)和肝X受体α(Liver X receptor α,LXRα)的表达,一方面通过降低SREBP1激活来减弱ACC、FAS等脂质合成相关酶的表达,另一方面可以促进脂肪酸氧化,减少脂质堆积;姜黄素也可以直接调控SREBP1改善脂质堆积和提高胰岛素敏感性[47]。本课题组研究也发现,姜黄素在体内外均可显著下调多个肝脏脂肪酸转运体的蛋白和基因表达;同时姜黄素也降低了肝脏对FFAs(以棕榈酸为代表)的摄取,从而降低肝脏内的脂质异常积累。同样,其调控脂肪酸转运体以改善NAFLD的具体机制仍有待进行深入研究。
1.3 降低脂质异位转移
白色脂肪组织作为一个重要的内分泌组织,参与机体能量调控和代谢稳态,在代谢紊乱性疾病如NAFLD、胰岛素抵抗、2型糖尿病、血脂功能紊乱等的发生、发展过程中起到非常关键的作用[48]。在肥胖、NAFLD状态下,白色脂肪组织内脂肪(主要是甘油三酯)迅速脂解,释放大量的FFAs入血液并随血液循环进入肝脏[49]。脂肪脂解诱导的肝脏脂质沉积可诱发肝脏胰岛素抵抗,这说明脂肪功能障碍与肝脏胰岛素抵抗之间有明显的相关性,而胰岛素抵抗也是NAFLD的一个重要诱因和主要的临床表现。有研究发现,姜黄素通过阻断脂肪组织内PKA/HSL脂解信号通路改善内质网应激,从而降低脂肪脂解来减少甘油和FFAs的释放,进而减少FFAs进入肝脏[50]。本课题组的研究指出,姜黄素可通过抑制AMPK介导的mTOR通路缓解脂肪缺氧、降低低氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)相关的脂肪组织纤维化,进而改善脂肪脂解等功能[51]。因此,姜黄素通过干预脂肪组织功能以降低FFAs的异位转移入肝脏来缓解肥胖、NAFLD等疾病是一个值得深入研究的方向。
1.4 促进脂肪酸的处置利用
在肝脏中,脂肪酸的去路主要包括进行氧化代谢,或以VLDL的形式分泌入血,或以肝脂滴的形式储存等,但这些处置过程并不会区分脂肪酸的来源。肝脏内脂肪的氧化是由PPARα调控的线粒体和过氧化物酶体脂肪酸β-氧化系统以及微粒体ω-氧化系统组成的[52-54]。肝脏内CPT-1和CPT-2作为限速步骤决定了脂肪酸的β-氧化程度,而通常认为CPT-1和CPT-2功能异常与肝脏脂肪异常积聚有关,并且与NAFLD或脂肪代谢相关疾病的病理过程密切有关[55]。因此,促进脂肪酸氧化利用可能是缓解肝脏脂质沉积的一种非常有前景的研发和治疗策略。有研究者发现中药中一些生物活性成分在缓解脂质代谢方面有诸多的潜在益处,如黄芩苷、姜黄素等均可显著激活或上调肝脏CPT,以减少脂质积累,从而进一步改善饮食诱导的肥胖和肝脏脂肪变性[29]。同时,姜黄素也可以上调脂肪组织内的CPT,以促进脂质氧化而减少脂肪酸酯化,进而降低机体脂肪和预防体质量增加[56]。另外,也有研究发现,姜黄素可以通过上调PPARα的基因表达促进脂肪酸的氧化,从而减少脂肪蓄积[57]。
2 缓解炎性反应改善NAFLD
肝脏中甘油三酯等脂质过度蓄积引起的脂肪变性是NAFLD/NASH病理进程的必要条件[58]。肝脏炎症的诱因既可来自肝脏内部,也可来自肝脏外部,这2种途径均会诱发从NAFL向NASH的转变[59]。外周脂肪组织功能障碍和肝脏炎症反应在NASH发展过程中起着基础性作用[59]。脂肪组织脂解而增加循环系统内FFAs可诱导肝脏脂毒性和细胞凋亡,进一步加剧肝脏炎症;同时M1巨噬细胞的浸润增加会导致脂肪因子紊乱(低脂联素、高瘦素和TNF-α水平),其分泌趋化因子和细胞因子会诱导肝脏炎症和胰岛素抵抗。肝脏内脂质异常蓄积通过激活Kupffer细胞、肝星状细胞释放TNF-α、IL-6、IL-1β等趋化因子和细胞因子(或上调表达),不断引起并加剧肝脏的炎症反应[60]。因此,聚焦肝内炎症反应,减少外周脂肪组织细胞因子和趋化因子的释放是防治NAFLD/NASH进行性发展的重要策略。
姜黄素已被大量的体内外研究证实可以与多种炎症分子靶点相互作用,其可能通过抑制环氧化酶-2(COX-2)、脂氧合酶(LOX)、诱导型一氧化氮合酶(iNOS)以及NF-κB、STAT3等信号通路,参与调控机体多种炎性反应,如炎症性肠病、关节炎、胰腺炎和NASH等[12,61]。姜黄素可以通过下调NAFLD肝细胞内多条炎性反应信号通路相关因子的活性和基因、蛋白表达,降低多种趋化因子和炎性因子的释放,以此减弱炎性细胞(比如Kupffer细胞和肝星状细胞)的增殖和活化[13,62]。此外,姜黄素具有良好的抗氧化活性,可以多方面地清除肝内过多的活性氧自由基(比如ROS)并上调SOD活性,降低丙二醛(MAD)水平,以下调氧化应激水平,进而改善炎性反应[63]。因此,姜黄素可能是改善NAFLD的潜在治疗药物。
研究表明,在高脂饮食喂养的NAFLD大鼠肝脏内TNF-α和IL-6的表达均显著高于正常组。IL-6的过度分泌和IL-6受体信号通路的持续激活对肝脏有害,可诱发肝脏炎症并最终可能导致肝脏肿瘤的发生[64]。TNF-α可以由肝细胞、Kupffer细胞分泌或由外周脂肪组织分泌,是NAFL向NASH进行性发展的关键因素[65]。有趣的是,姜黄素可以降低肝脏内促炎因子IL-6、IL-1β、TNF-α的表达,同时增强抗炎因子IL-10的表达,以此缓解肝脏炎症。Afrin和Leclercq等[66-67]发现姜黄素也可以降低NASH小鼠体内促炎因子IL-1β的表达,且NF-κB的转录表达也明显下降,以此延缓NASH进程。据研究报道,姜黄素可以上调SIRT1在胆碱蛋氨酸缺乏(MCD)诱导的NAFLD小鼠肝脏的表达,基于此调控SOD1的表达而发挥抗氧化作用改善内质网应激,从而减少脂肪在肝细胞内的沉积,改善脂肪性肝炎[68]。此外,HIF-1α作为一种转录因子能够诱导促炎因子的表达,加速细胞外基质的沉积,并加剧组织纤维化的产生[69-70]。课题组先前研究也发现,姜黄素能通过抑制HIF-1α来控制促炎细胞因子TNF-α和IL-6的基因表达,进而缓解高脂饮食小鼠脂肪组织的炎症反应[51]。
3 抗纤维化作用改善NAFLD
持续的炎性反应会诱使脂肪性肝纤维化的发生发展,而肝星状细胞的异常激活在肝纤维化发展过程中发挥至关重要的作用。激活的肝星状细胞在细胞外基质中沉积越来越多的Ⅰ型、Ⅲ型胶原和纤维连接蛋白,并且产生转化生长因子-β1(Transforming growth factor β1,TGF-β1)进一步活化肝星状细胞[71-73],进而诱导肝纤维化的发展。也有研究发现,CD36参与未活化的TGF-β1向活化的方向转化这一过程[74],刺激细胞外基质合成并抑制其降解,促进胶原沉积。目前,肝脏炎症促使肝纤维化已得到许多研究证实。大量研究表明,一部分NASH患者可以发展为进行性肝纤维化,这可能是肝细胞外基质合成和降解失衡的结果。
Lin等[75]发现姜黄素通过阻断胰岛素信号和减轻氧化应激,减弱胰岛素对肝星状细胞的激活作用。姜黄素通过抑制Ⅰ型胶原基因和其他与肝星状细胞激活相关的关键基因的表达,剂量依赖性地消除胰岛素诱导的肝星状细胞激活,缓解肝纤维化进程[75]。姜黄素也可以通过诱导谷氨酸-半胱氨酸连接酶基因的表达,从而降低胰岛素诱导的肝星状细胞激活,抑制谷胱甘肽的重新合成和胰岛素受体基因表达。这些结果均证明姜黄素可以通过干扰胰岛素信号、减轻氧化应激来抑制胰岛素对肝星状细胞的激活作用,进而降低细胞外基质胶原蛋白的产生,这也为姜黄素干预肝星状细胞活化以改善肝纤维化的机制提供了新的见解。另外,Tang等[76]发现姜黄素可能通过降低瘦素受体基因的表达及其下游中间体的磷酸化水平来中断瘦素信号转导,同时增强PPARγ活性,以减弱肝星状细胞的氧化应激并抑制其活化和增殖。本课题组研究发现,姜黄素可以通过AMPK介导的mTOR通路,抑制脂肪组织中Ⅰ型胶原Col1α、Ⅲ型胶原Col3α和Ⅵ型胶原Col6α基因表达,进而有效地改善高脂饮食诱导小鼠的脂肪组织纤维化,进一步证实姜黄素可以发挥良好的抗组织纤维化作用[51]。机制总结见表1。
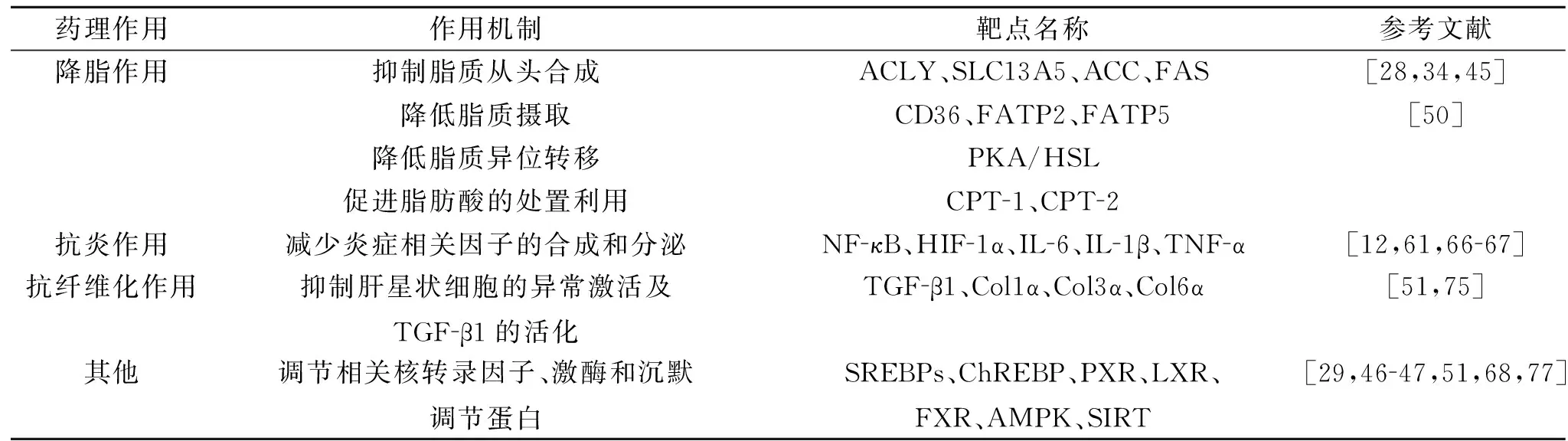
表1 姜黄素防治NAFLD的药理作用及机制
4 小结
综上所述,NAFLD的发病因素较多且机制复杂,发病率不断升高,近年来一直是学者们的研究热点和医药公司药物创新与研发的重点。作为一个具有多效性、多靶点的中药活性成分,姜黄素对NAFLD的防护和治疗已有大量研究和报道。姜黄素可以通过激活AMPK、抑制氧化应激和细胞凋亡等多种分子机制,体现其降脂、抗炎和抗纤维化等药理作用,进而改善甚至逆转NAFLD等脂质代谢紊乱相关疾病的复杂病理特征。因此,姜黄素有潜力成为预防和治疗NAFLD及其它代谢性疾病的有效药物,然而对其确切机制、临床疗效和安全性仍需进一步探索,这对推动中医药现代化发展具有巨大的现实意义。

