参附注射液对氧化应激血管内皮损伤及相关信号转导通路的影响
陈瑞娟,吴坚,田芳,孔祥清,芮庆林
(1.南京中医药大学附属医院/江苏省中医院,江苏 南京 210029;2.南京医科大学第一附属医院,江苏 南京 210029)
脓毒症是各种感染导致机体出现反应失调,进而引发多器官功能障碍乃至危及生命的常见急危重症,其发病率和死亡率都高,是现代急诊与重症医学领域的重要研究方向[1]。
血管内皮细胞是循环血液和血管之间的屏障,参与炎症、凝血、免疫反应、血管张力调节等重要生物过程,血管内皮损伤或功能障碍被认为是脓毒症发生发展的核心环节[2-3]。作为病原体及毒素攻击的主要靶标,内皮细胞被过度刺激后产生大量血管活性物质,可致内皮损伤乃至凋亡,引起器官功能障碍[4-5]。氧化应激与内皮损伤密切相关,疾病状态下活性氧(ROS)含量增加,氧化脂质生成丙二醛(MDA),后者进一步促进氧化应激导致恶性循环,严重破坏内皮功能。
参附注射液具有回阳救逆、益气固脱的功效,被广泛应用于脓毒症休克、失血性休克和心肺复苏的临床救治中,疗效确定[6-7]。氧化应激损伤是脓毒症、心脏骤停等多种疾病共存的病理基础[8-9]。既往研究显示参附注射液具有拮抗氧化应激内皮损伤的作用[10],但具体作用机制尚未完全明确。
本研究制备血管内皮细胞氧化应激损伤模型,观察参附注射液对血管内皮细胞ECV304氧化应激和凋亡的影响,并探讨可能涉及的信号转导通路,以期明确参附注射液保护血管内皮的作用机制。
1 材料
1.1 实验对象
血管内皮细胞ECV304购自中国科学院上海细胞生物学研究所。
1.2 主要试剂
参附注射液(批号:16110701002)购于华润三九雅安药业有限公司;H2O2、N-乙酰半胱氨酸(NAC)购于国药集团化学试剂有限公司;胎牛血清、1640培养基购于美国Gibco公司;噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒、二喹啉甲酸(BCA)蛋白定量检测试剂盒、DCFH-DA荧光探针ROS检测试剂盒购于南京建成生物工程有限公司;异硫氰酸荧光素酯(FITC)标记的Annexin V、碘化丙啶(PI)购于上海碧云天生物技术研究所;Hoechest33258,GAPDH、Cleaved Caspase-3(C-Caspase-3)、Bcl-2和Bax抗体购于美国Sigma公司;ERK和p-ERK单克隆一抗,辣根过氧化物酶标记的二抗购于美国Santa Cruz公司。
1.3 主要设备
SW-CJ-1F超净工作台(苏州净化集团安泰公司);Forma CO2培养箱(美国Thermo Scientific公司);超声波细胞裂解仪(苏州珀西瓦尔实验设备有限公司);多功能酶标仪(美国Thermo Fisher公司);ZE5流式细胞仪、Trans-Blot Turbo蛋白转印系统、电泳仪(美国Bio-Rad公司);化学发光及凝胶成像系统(英国Syngene公司)。
2 方法
2.1 血管内皮细胞ECV304的培养
将血管内皮细胞ECV304置于含10%胎牛血清的1640培养基中,在37 ℃、5%CO2饱和湿度的培养箱中培养,取对数期生长细胞用于实验。
2.2 细胞分组和处理
2.2.1 MTT实验 将培养的ECV304细胞分为对照组和H2O225、50、100、150、200、250、300 μmol/L组。H2O2作用3 h后检测细胞存活率,根据结果筛选出H2O2的最佳造模浓度。
将培养的ECV304细胞分为对照组和参附注射液5、10、15、20、30、40、60 μL/mL组。参附注射液干预12 h后检测细胞存活率,根据结果评估参附注射液的安全浓度范围。
将培养的ECV304细胞分为对照组,H2O2组和H2O2+参附注射液5、10、15、20、30、40、60 μL/mL组。H2O2作用3 h,根据前面的MTT结果选择造模浓度。参附注射液预孵12 h,根据结果筛选参附注射液的最佳干预浓度。
2.2.2 其余实验 将培养的ECV304细胞分成4组:①对照组;②H2O2组;③H2O2+参附注射液组;④H2O2+NAC组。参附注射液(根据MTT选择干预浓度)预处理12 h或NAC(500 μg/mL)预孵1 h后,加入H2O2(根据MTT选择造模浓度)作用于ECV304细胞3 h,然后进行各项检测。
2.3 检测方法
2.3.1 MTT检测 取对数生长期ECV304细胞,将细胞悬液调整为1×105mL-1接种于96孔板中,5%CO2,37 ℃环境培养24 h,暴露于不同浓度梯度的H2O2(0、25、50、100、150、200、250、300 μmol/L)中培养3 h或者不同浓度梯度的参附注射液(5、10、15、20、30、40、60 μL/mL)中培养12 h(每组设6个复孔)后,每孔加20 μL MTT(5 mg/mL),5%CO2,37 ℃环境孵育4 h,吸弃上清后每孔加150 μL DMSO振荡10 min,同时设置调零孔,在酶标仪490 nm处检测各孔吸光值。
将不同浓度梯度的参附注射液(5、10、15、20、30、40、60 μL/mL)预孵ECV304细胞12 h,按照筛选出的最佳H2O2浓度造模3 h,后续步骤同上检测各孔吸光值。
2.3.2 Hoechst染色 在6孔细胞培养板内放入洗净的盖玻片;收集对数生长期细胞,将细胞悬液调整为1×105mL-1接种于上述处理过的6孔培养板中,培养至50%~80%;实验组予以参附注射液(5 μL/mL)预处理12 h或NAC(500 μg/mL)预孵1 h后,加入300 μmol/L的H2O2作用于ECV304细胞3 h,吸弃上清,加0.5 mL 4%多聚甲醛固定10 min;吸弃固定液;磷酸缓冲盐溶液(PBS)洗2遍;加0.5 mL Hoechst33258染色液(5 mg/L)振荡5 min;再用PBS洗2遍;在载玻片上加1滴抗荧光淬灭封片液,将贴有细胞的盖玻片放在载玻片上,室温晾干,荧光显微镜观察拍摄相应照片。实验重复3次,取阳性细胞百分比的均值作为阳性细胞率值。
2.3.3 DCFH-DA荧光探针检测细胞内ROS含量 PBS洗涤细胞(1 000 r/min离心5 min)1次后收集并调整细胞浓度为1×106mL-1;用无血清培养液稀释DCFH-DA(1∶1 000),使终浓度为10 μmol/L;细胞收集后悬浮于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育20 min,每隔3~5 min颠倒混匀一下,使探针和细胞充分接触;用无血清细胞培养液洗涤细胞3次以充分去除未进入细胞内的DCFH-DA;流式细胞仪检测细胞内ROS含量。实验重复3次。
2.3.4 流式细胞术检测细胞凋亡 按Annexin V-FITC/PI细胞凋亡检测试剂盒说明书步骤,取100 μL单细胞悬液(含1×106个细胞),加入100 μL Binding buffer和5 μL FITC标记的Annexin V(20 μg/mL),室温下避光培养30 min,再加入50 μg/mL PI 5 μL,避光培养5 min,加入400 μL Annexin V binding solution,用流式细胞仪进行细胞的定量检测,同时以Annexin V-FITC+PI作为阴性对照,实验重复3次,分析软件Cell Quest检测细胞的平均荧光强度。
2.3.5 Western blot检测 按BCA法蛋白定量试剂盒说明书测定样本蛋白浓度。取100 μg样品,使用6%SDS-PAGE胶进行蛋白分离;通过电泳仪将分离后的蛋白电转至PVDF膜上。5%脱脂奶粉室温下封闭1 h,用含Tween20的Tris缓冲盐溶液(TBST)稀释一抗C-Caspase-3、ERK、p-ERK、Bcl-2、Bax和内参GAPDH。4 ℃过夜,TBST洗膜3次,加Tris缓冲盐溶液稀释的辣根过氧化物酶标记的二抗,37 ℃反应1 h,TBST溶液洗膜3次.用电化学发光剂进行显影定影,Gel-Pro软件分析各检测蛋白条带的吸光度,实验重复3次,得出灰度的平均值作为蛋白含量值。
2.4 统计学方法
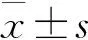
3 结果
3.1 各组MTT检测结果比较
随着H2O2的浓度递增,ECV304细胞的存活率逐步减少并呈线性关系(P<0.05,P<0.01);不同浓度梯度的参附注射液对ECV304细胞的存活率无显著影响;选择300 μmol/L H2O2制备ECV304细胞氧化应激模型,用不同浓度梯度参附注射液进行干预,5 μL/mL参附注射液的作用浓度最低且保护作用强。见图1。
注:与对照组相比,*P<0.05,**P<0.01;与H2O2组相比,图1 H2O2和H2O2+参附注射液对ECV304细胞存活率的影响
3.2 各组Hoechst染色结果比较
与对照组比较,H2O2组细胞凋亡增多(P<0.05);与H2O2组比较,参附注射液或NAC能减少H2O2诱导的细胞凋亡,差异有统计学意义(P<0.05)。见图2。

注:与对照组比较,**P<0.01;与H2O2组比较,图2 参附注射液对H2O2诱导ECV304细胞凋亡Hoechst染色和阳性细胞率的影响
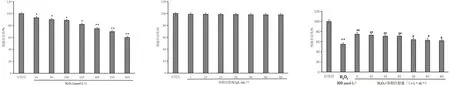
3.3 各组流式细胞检测结果比较
与对照组比较,H2O2组ECV304细胞凋亡显著增加(P<0.05);与H2O2组比较,参附注射液或NAC能减少H2O2诱导的ECV304细胞凋亡,差异有统计学意义(P<0.05)。见图3。

对照组 H2O2 H2O2+参附注射液 H2O2+NAC

注:与对照组比较,**P<0.01;与H2O2组比较,
3.4 各组细胞内ROS含量比较
与对照组相比,H2O2组细胞内ROS含量显著增加(P<0.05);与模型组相比,参附注射液或NAC能降低ROS的含量,差异有统计学意义(P<0.05)。见图4。
注:与对照组比较,**P<0.01;与H2O2组比较,
3.5 各组Western blot检测结果比较
与对照组比较,H2O2能够增加Cleaved Caspase-3、p-ERK的表达(P<0.05),降低Bcl-2/Bax比值(P<0.05);参附注射液或NAC能拮抗H2O2诱导的ERK磷酸化,上调Bcl-2/Bax,减少C-Caspase-3表达,差异有统计学意义(P<0.05)。见图5。

注:与对照组比较,**P<0.01;与H2O2组比较,
4 讨论
参附注射液源于传统中医古方参附汤,由人参、附子2味中药经现代生产工艺提取而成。参附汤是益气温阳的代表方,人参大补元气,附子大辛大热,两药相得益彰,具有温阳益气的作用。临床研究显示参附注射液可以改善脓毒症患者的预后和器官功能[11-12],基础实验表明参附注射液可拮抗H2O2诱导的内皮细胞凋亡[13],但具体作用机制尚不明确。
血管内皮与平滑肌细胞是炎症反应的靶细胞及效应细胞,其结构和功能异常在微循环障碍、脓毒症休克及多器官功能损伤中起着重要作用[14]。临床研究显示血管内皮细胞损伤与脓毒症休克患者的预后密切相关[15]。细胞凋亡是由基因控制的细胞自主有序的死亡,凋亡失调参与多种疾病的发生发展过程。内皮细胞凋亡可致微循环障碍进而引发多器官功能不全。本研究中MTT结果显示H2O2能诱导ECV304细胞死亡,且随着H2O2浓度递增,细胞的存活率逐渐减少,并与浓度呈线性关系。选择300 μmol/L H2O2制备氧化应激损伤模型,在不同浓度参附注射液干预下观察细胞存活率,发现5~60 μL/mL参附注射液对ECV304细胞具有显著保护作用(P<0.05,P<0.01),最终我们选择作用显著且浓度较低的5 μL/mL作为参附注射液的实验干预浓度,与既往的研究结果相近[13]。Hoechst染色和流式细胞仪检测结果皆显示参附注射液或ROS清除剂NAC能减少H2O2诱导的ECV304细胞凋亡,提示参附注射液可能通过减少氧化应激损伤保护血管内皮。
ROS是诱导细胞凋亡的重要因子,机制包括:①诱导线粒体通透性转换孔开放;②激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPKs)家族的JNK和P38诱导细胞凋亡;③通过JNK通路拮抗细胞凋亡;④激活促凋亡蛋白Bax,抑制抗凋亡蛋白Bcl-xl;⑤氧化NF-κB的P50亚基导致其与DNA的结合能力减弱,进而抗凋亡能力减弱[16]。本研究显示H2O2可增加ECV304细胞ROS的含量,参附注射液或NAC可降低H2O2诱导的ROS含量变化,提示参附注射液和NAC均具有抗氧化应激、减少ROS的作用。既往研究显示参附注射液能减少氧化应激水平,保护肾脏缺血再灌注损伤[17],同样提示参附注射液具有拮抗氧化应激损伤的作用。
凋亡是多基因严格控制的过程,其涉及的信号转导通路错综复杂,相互交织。Caspase家族为细胞凋亡的关键酶,其中Caspase-3是多种凋亡信号转导途径共同的终末执行分子。未激活的Caspase-3通常以酶原(32 kD)形式存在于细胞胞浆中,被激活后变成2个大亚基(17 kD)和2个小亚基(12 kD),剪切后的C-Caspase-3具有裂解胞浆胞核底物的活性,能够导致细胞凋亡。本研究结果显示,与对照组比较,H2O2组被激活的Caspase-3(C-Caspase-3)的表达增多,而参附注射液或NAC能拮抗H2O2诱导的C-Caspase-3表达增加,提示二者可通过减少Caspase-3的活化拮抗H2O2诱导的ECV304细胞凋亡。
Bcl-2和Bax同属于Bcl-2蛋白家族,Bcl-2属于膜整合蛋白,能阻止线粒体释放细胞色素C,进而抑制细胞凋亡、促进细胞存活,是细胞凋亡信号转导通路中重要的抗凋亡蛋白。Bax是促凋亡蛋白,它通过与Bcl-2形成同源或异源二聚体来调节细胞凋亡,当Bax-Bax形成同源二聚体时细胞发生凋亡,而Bax-Bcl-2形成异源二聚体时能抑制细胞凋亡,完成对细胞的调控[18]。本实验结果显示H2O2能增加ECV304细胞Bax的表达,减少Bcl-2的含量,降低Bcl-2/Bax比值。参附注射液或NAC能拮抗H2O2诱导的上述变化,提示二者可能通过调控Bcl-2/Bax比值参与H2O2诱导ECV304细胞凋亡的调节。
ERK属于MAPKs家族,是Ras/Raf/MEK/ERK信号通路的重要组成部分。ERK能够被磷酸化激活,进而介导胞浆和胞核间的信号传递,参与细胞的增殖、分化、凋亡和癌变等多种病理生理过程[19]。ERK信号通路对凋亡具有双向调节作用,细胞和疾病类型不同,ERK的作用不尽相同[20-21]。本实验结果显示,与对照组比较,H2O2刺激后p-ERK的表达增多,提示ERK通路参与H2O2诱导的ECV304细胞凋亡;参附注射液或NAC能减少H2O2诱导的ERK和Caspase-3的活化,提示参附注射液可能通过抑制ERK信号通路活化,拮抗氧化应激诱导的ECV304细胞凋亡。
综上所述,参附注射液可能通过减少ROS的产生,抑制ERK信号通路活化,进而调节Bcl-2/Bax比值,拮抗氧化应激诱导的ECV304细胞凋亡。中药方剂常表现为多靶点效应,后续研究可积极探讨参附注射液是否对靶器官具有直接的保护作用。

