慢性化脓性中耳炎的病原学、药敏试验及其毒力基因分析
陶兴罡,张志远
(1.南昌大学第一附属医院耳鼻咽喉科,南昌 330006; 2.复旦大学附属中山医院吴淞医院耳鼻咽喉科,上海 200940)
慢性化脓性中耳炎(chronic suppurative otitis media,CSOM)是一种较为常见的耳科疾病,临床上患者以耳痛、耳鸣、耳内长期反复间断或持续性流脓、鼓膜穿孔、伴有或不伴有听力下降为主要临床特点。国内外很多研究者[1-4]对CSOM分离出的致病菌类型进行了分析,各地区常见致病菌类型有所差异。随着抗生素的使用,CSOM的致病菌谱及药物敏感性也会随之变化。而关于CSOM的毒力基因研究少有文献报道。因此,本研究分析CSOM患者的细菌分型及药物敏感性,并对相关致病菌的毒力基因进行检测,观察病原菌谱和耐药性的变化,为临床合理治疗CSOM提供用药参考。
1 一般资料
选取2020年3月至2021年3月在复旦大学附属中山医院吴淞医院就诊的CSOM患者166例患者(179只患耳),男76例,女90例,年龄(49.31±12.44)岁,病程2个月~26年,平均21.2个月。
1.1 病例选取标准
1)纳入标准:①符合慢性化脓性中耳炎的诊断标准;②近期内(5 d)未使用过抗菌药物;③均为化脓性中耳炎活动期。
2)排除标准:①排除疾病,包括外耳道胆脂瘤、中耳胆脂瘤、中耳胆固醇肉芽肿、结核性中耳炎、中耳癌;②5 d内使用过抗生素,包括滴耳液、口服、肌肉、静脉。
1.2 研究方法
1.2.1 试剂与仪器
由上海伊华医学生物提供的血琼脂培养基、巧克力琼脂培养基、麦康凯琼脂培养基、念珠菌显色琼脂培养基、沙保弱琼脂培养基等,安图MS1000质谱仪、生物梅里埃公司的Vitec 2微生物鉴定药敏分析系统和Vitec Densichek比浊仪。北京六一仪器厂生产的DYY-6C电泳仪和DYCP-32B电泳槽用于蛋白电泳实验。
1.2.2 病原学和药敏试验
按照《全国临床检验操作规程》[5]中耳分泌物标本进行检验操作。用无菌棉签采集门诊或入院确诊患者中耳鼓室分泌物,置于无菌试管中立即送检,进行细菌和真菌培养,培养阳性菌株应用安图MS1000质谱仪进行质谱鉴定。
生物梅里埃公司的Vitec 2微生物鉴定药敏分析系统和Vitec Densichek比浊仪进行药敏试验,补充药敏试验采用K-B药敏纸片扩散法技术,药敏试验方案参考全国细菌耐药监测网技术方案(CARSS网,http://www.carss.cn),药敏试验执行标准为2020抗微生物药物敏感性试验执行标准CLSI M100-30(中国药师协会根据美国临床和实验室标准协会合法授权翻译印制)。
1.2.3 毒力基因测试
依据GenBank对外公布的毒力基因序列,采用Primer Premier 5引物软件,根据相关文献[6-8],设计金黄色葡萄球菌毒力基因SEA、SEB、TSST-1、HLα、HLβ、PLV和铜绿假单胞菌毒力基因ToxA、ExoT引物。菌株采用酶解法,提取DNA,PCR扩增后琼脂糖凝胶电泳,成像观察。毒力基因引物序列,由上海生工生物工程股份有限公司合成,详见表1。

表1 基因引物序列
1.3 数据处理
采用Excel 2010录入数据,应用SPSS 20.0软件对数据进行处理。
2 结果
2.1 致病菌种类分布
166例患者(179只患耳)的中耳分泌物标本中,132例患者(143只患耳)培养出致病菌,检出率为79.89%(143/179)。共培养出167株致病菌,其中24例患耳存在2种致病菌混合感染。
167株致病菌中,革兰阳性菌81株(占48.50%),其中金黄色葡萄球菌50株(占29.94%),凝固酶阴性葡萄球菌19株(占11.38%);革兰阴性菌22株(占13.17%),其中铜绿假单胞菌12株(占7.19%);真菌64株(占38.55%),其中丝状真菌44株(占26.35%)。见表2。

表2 致病菌分布及各自比例

表2(续)
2.2 致病菌药敏试验分析
对50株金黄色葡萄球菌和12株铜绿假单胞菌进行耐药分析。真菌未做药敏试验。
金黄色葡萄球菌对青霉素G的耐药率最高为90.00%。耐药率超30%的还有红霉素(32.00%)和氨苄西林(30.00%),见图1。铜绿假单胞菌耐药率最高的是环丙沙星(25.00%)和左旋氧氟沙星(25.00%),见图2。
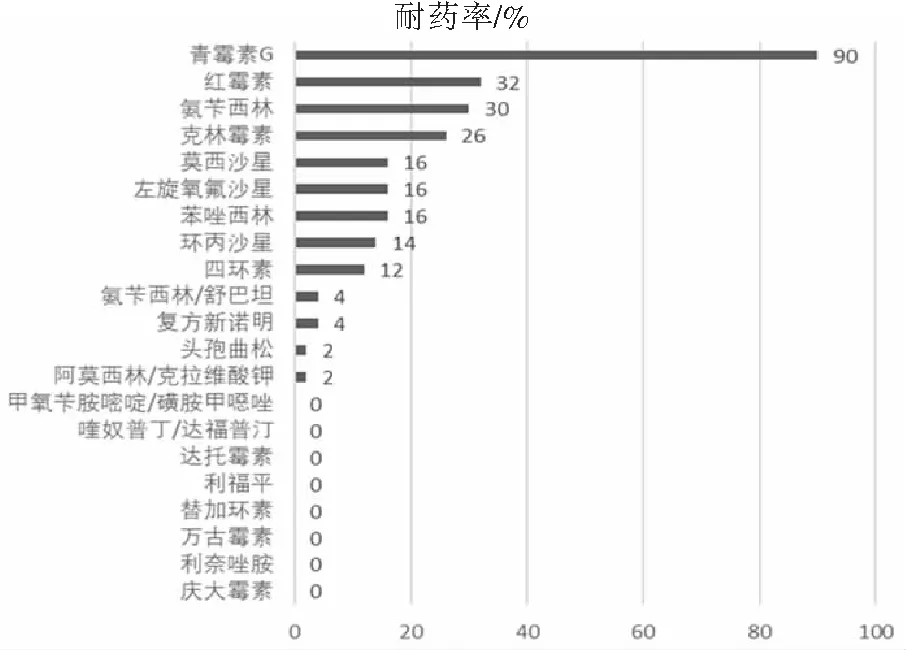
图1 金黄色葡萄球菌的耐药情况(n=50)

图2 铜绿假单胞菌的耐药情况(n=12)
2.3 毒力基因
金黄色葡萄球菌的毒力基因SEA、SEB、TSST-1、HLα、HLβ、PLV中,HLα的检出率最高,达100%;铜绿假单胞菌的毒力基因ToxA、ExoT中,ToxA的检出率最高达100%,见表3。各毒力基因电泳结果见图3—4。
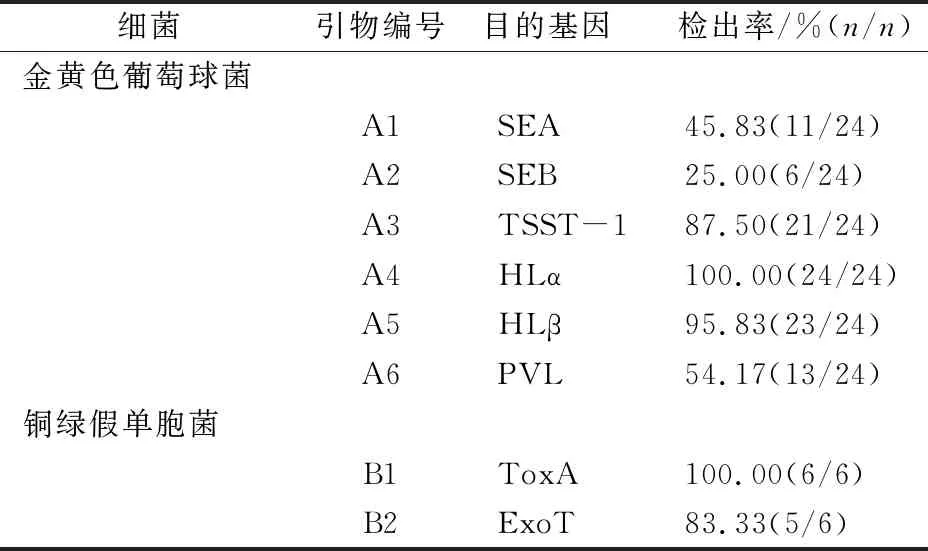
表3 金黄色葡萄球菌和铜绿假单胞菌毒力基因检出情况

1—24:金黄色葡萄球菌;M:marker。图3 金黄色葡萄球菌各毒力基因电泳结果

图3(续)

1—6:铜绿假单胞菌;M:marker。图4 铜绿假单胞菌各毒力基因电泳结果
3 讨论
成年人CSOM的发病率在国内一般为2%~4%[9],占耳鼻喉科新诊断患者的11.7%。常合并慢性乳突炎,中耳腔内的脓性分泌物以感染的细菌、白细胞、巨噬细胞等为主,发病时间通常定义为8周以上。长期的炎症病理改变会破坏中耳的生理结构,导致听力损失,甚至破坏周围的骨质。在一定条件下,可出现严重的颅内、外并发症而危及生命[10]。感染、咽鼓管功能障碍及免疫不健全是中耳炎的三大主要发病病因[11],致病菌感染是引起CSOM的最重要和最直接的外源性病因。
国内外很多研究者对CSOM分离出的致病菌类型进行了分析。上海的金晓杰等[1]研究62例CSOM患者的致病菌,依照实际的检出占比为铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌等。杨燕珍等[2]收集武汉市92例CSOM患者的中耳炎性分泌物并做细菌培养,结果致病菌是绿脓杆菌、金黄色葡萄球菌和变形杆菌等。王志红等[3]收集化脓性中耳炎耳道分泌物80例进行细菌培养,结果显示,致病菌为金黄色葡萄球菌、表皮葡萄球菌及铜绿假单胞菌等。韩国学者YEO等[4]回顾性分析1102名罹患CSOM患者致病菌排列为:假单胞菌属、耐甲氧西林金黄色葡萄球菌(MRSA)、金黄色葡萄球菌、凝固酶阴性葡萄球菌等。提示,CSOM的常见致病菌类型因地区而异。
本研究中凝固酶阴性葡萄球菌(头状葡萄球菌、溶血性葡萄球菌、耳葡萄球菌、假中间葡萄球菌等)占11.38%,因其致病性存在争议[12],故暂不作为致病菌参与比例排序。故排名前三位的致病菌检出率为金黄色葡萄球菌50株(29.94%)、丝状真菌44株(26.35%)、铜绿假单胞菌12株(7.19%)。与金晓杰等[1]在2004年提出的铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌的比例顺序已完全不同。其中,金黄色葡萄球菌的检出明显增多,且真菌的检出比例上升到第二位。可能与上海处于我国的长江下游地区,环境温暖湿润,适合真菌生长有关。另外,也可能与长期不规范使用抗生素,造成局部菌群失调有关。本研究中24例患耳存在2种致病菌混合感染,可能是自行使用抗生素治疗各种炎症,造成局部或全身的菌群紊乱。
本研究总致病菌的耐药试验结果显示,革兰阳性菌,特别是金黄色葡萄球菌对青霉素G的耐药率最高,远超《抗菌药物临床应用指导原则》和《抗菌药物临床应用管理办法》[13-14]的慎重用药的标准,在金黄色葡萄球菌作为目标细菌的治疗中,建议暂停青霉素G。而耐药率超30%的红霉素、氨苄西林,也应慎用。革兰阴性菌,尤其是铜绿假单胞菌,对环丙沙星和左旋氧氟沙星的耐药率最高,虽未达到用药预警,但仍需注意目前对β-内酰胺类抗生素、喹诺酮类药物的耐药性,有明显升高。参考“全国细菌耐药监测网(CARSS)”[15],2019年金黄色葡萄球菌对常用抗菌药物的敏感性表中,耐药率前五位与此次CSOM分离出金黄色葡萄球菌的耐药率前五位的结果顺序基本一致。2019年铜绿假单胞菌对常用抗菌药物的敏感性表中,耐药率前五位与此次CSOM分离出铜绿假单胞菌的耐药率前五位结果顺序基本相近。提示CSOM的致病菌,与全身其他部位的相同致病菌,对抗生素的耐药效果基本相似。
细菌致病力的强弱,主要取决于其产生的各种毒力基因。此次实验中,金黄色葡萄球菌的毒力基因中,HLα基因检出率最高,达100%。HLα基因,是金黄色葡萄球菌分泌的外毒素——溶血毒素的α毒素,在感染致病过程中,具有破坏宿主细胞免疫屏障的能力,是关键因子之一,并参与金黄色葡萄球菌的生物膜生成[16],与其致病性密切相关。而细菌生物膜在CSOM发病机制中已经引起广泛的关注[17]。生物膜难以根除,还可能导致复发性感染。此外,生物膜与受损组织,如暴露的骨组织和溃烂的中耳黏膜,或耳科植入物如鼓膜置管,紧密相连,进一步加剧了治疗困难[18]。
铜绿假单胞菌的毒力基因中,ToxA的检出率最高,达100%。ToxA基因,由Ⅱ型分泌系统产生,其表达的外毒素,细菌毒力极强,可导致宿主细胞蛋白质合成障碍。因此,铜绿假单胞菌感染造成的CSOM,比其他致病菌更有致病性。
尽管各种毒力基因的检出率各不相同,但是,这些毒力基因共同参与细菌的致病作用。例如,金黄色葡萄球菌的黏附和定植需要表面锚定蛋白和HLβ基因的参与,HLα、HLβ、PVL基因协同损伤细胞膜,HLα、HLβ基因共同降低纤毛功能,SEA、SEB基因发挥毒素效应,TSST-1基因增强对毒素敏感性,共同参与CSOM的致病过程。而铜绿假单胞菌的ToxA和ExoT基因,则抑制靶细胞的蛋白质合成和细胞分裂,使细胞凋亡[19]和组织坏死。同样将CSOM的致病力,发挥到了极致。
总之,随着检测方法的更新,治疗药物的升级,致病菌谱必定会有变化。因此,应动态监测病原学的变化,及时总结致病菌检出率的排序变化、细菌的耐药率和耐药特点等,并且更新使用针对性的抗菌药物进行治疗。临床尽可能对每位患者进行细菌培养和药敏试验,特别是对抗菌治疗效果差,或伴有糖尿病、结核病等消耗性疾病的机会性感染患者更是如此。依据细菌培养与药敏试验结果,合理、规范、有针对性地使用抗生素,不仅可以缩短病程,减少并发症,还可以减少耐药性的发生。致病菌的培养鉴定、药敏试验分析及其毒力基因的检测,可为临床合理用药提供科学参考,进一步促进个体化治疗,精准化治疗。同时,卫生管理部门应继续加强对抗菌药物的管理,加大监督和指导的力度;医疗机构应严格控制对抗菌药物的临床应用指征;应该通过各种渠道宣传滥用抗菌药物的危害,增强遵守医嘱的自觉性,避免过度使用抗菌药物。
致谢:特此感谢刘洋师兄对论文的悉心指导!

