开腹直肠癌根治术与腹腔镜直肠癌根治术治疗直肠癌疗效比较
王松阳,侯红艳,樊松强
(1.漯河市第二人民医院胃肠外科,河南 漯河 462000;2.漯河医学高等专科学校第二附属医院神经内科,河南 漯河 462300)
直肠癌是临床最常见的消化道恶性肿瘤之一,其患病率呈逐年上升趋势[1]。根治性手术是目前临床治疗直肠癌的首选方法,包括开腹直肠癌根治术和腹腔镜直肠癌根治术。开腹直肠癌根治术根治效果好,但手术创伤大、并发症多、患者术后康复较慢。随着微创技术的发展,腹腔镜直肠癌根治术正在逐步替代传统开腹手术,有效弥补了常规开腹手术的不足[2]。腹腔镜直肠癌根治术具有创伤小、术中出血量少、患者术后恢复快等优点[3],但腹腔镜直肠癌根治术操作相对复杂,学习曲线较长,可增加并发症发生风险。目前尚无治疗直肠癌手术方式的明确标准。本研究旨在探讨开腹直肠癌根治术与腹腔镜直肠癌手术治疗直肠癌临床效果,以期为临床应用提供参考。
1 资料与方法
1.1 一般资料选择2015年1月至2020年9月漯河市第二人民医院收治的44例直肠癌患者为研究对象。纳入标准:(1)肠镜检查及病理学活检确诊为直肠癌;(2)符合根治性手术指征。排除标准:(1)直肠癌术后复发者;(2)术前发生远处转移者;(3)合并严重心、肝、脑、肺疾病;(4)凝血功能障碍者。根据手术方式将患者分为对照组和观察组,每组22例。对照组:男12例,女10例;年龄60~79(69.6±5.2)岁;肿瘤直径 2.0~4.5(3.14±0.44)cm。观察组:男11例,女11例;年龄61~78(68.2±5.2)岁;肿瘤直径:2.0~5.0(3.11±0.45)cm。2组患者的性别、年龄、肿瘤直径比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院医学伦理委员会批准,患者均签署知情同意书。
1.2 手术方法
1.2.1 对照组对照组患者行开腹直肠癌根治术。患者全身麻醉,取截石位。切口做于腹部正中,进入腹腔后,切开肠系膜于结肠动脉处,游离相应的肠段,并将其上血管结扎,清扫周围淋巴结,于距肿瘤5 cm处切断肠管,切除肿瘤,然后吻合肠管,最后蒸馏水冲洗腹腔,仔细止血,放置引流管,缝合切口。
1.2.2 观察组观察组患者行腹腔镜直肠癌根治术。患者全身麻醉,取截石位。采用四孔操作法[4-5],在脐上约1 cm处建立穿刺点,建立气腹,脐部左右侧和麦氏点处取操作孔,保持气腹压力在11~14 mm Hg(1 mm Hg=0.133 kPa),置入操作器械,对腔内情况进行探查,明确肿瘤位置,以无瘤原则为基础,用超声刀对肠系膜进行游离,并做好血管结扎处理,清扫周围淋巴结后直接进入Toldt间隙和直肠系膜间隙进行分离,在肿瘤5 cm处做切口,将肠道与系膜拉出,做纵向切口,并对肠道进行吻合,再将其放回腹腔,蒸馏水冲洗腹腔,仔细止血,放置引流管,缝合切口。
1.3 观察指标(1)记录2组患者的术中出血量、手术时间、术后住院时间;(2)血清炎症反应指标:分别于术前和术后第1天采集患者外周静脉血 3 mL,3 500 r·min-1离心10 min,收集上层血清,采用酶联免疫吸附法测定C反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleukin-6,IL-6)水平,试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书进行操作;(3)胃肠激素:术前、术后第3天采集患者外周静脉血1 mL,3 000 r·min-1离心5~10 min,收集上层血清,采用放射免疫法检测患者血清胃动素及胃泌素水平,放射免疫分析试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书进行操作; (4)术后并发症:记录2组患者术后并发症发生情况。
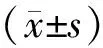
2 结果
2.1 2组患者手术情况比较结果见表1。2组患者手术时间比较差异无统计学意义(P>0.05)。观察组患者术中出血量及术后住院时间均显著少于对照组,差异有统计学意义(P<0.05)。

表1 2组患者术中出血量、手术时间、术后住院时间比较
2.2 2组患者血清IL-6、CRP、TNF-α水平比较结果见表2。术前2组患者血清IL-6、CRP、TNF-α水平比较差异无统计学意义(P>0.05)。术后第1天2组患者血清IL-6、CRP、TNF-α水平均显著高于术前,差异有统计学意义(P<0.05)。术后第1天,观察组患者血清IL-6、CRP、TNF-α水平均显著低于对照组,差异有统计学意义(P<0.05)。
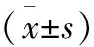
表2 2组患者血清IL-6、CRP、TNF-α水平比较
2.3 2组患者血清胃动素及胃泌素水平比较结果见表3。术前2组患者血清胃动素及胃泌素水平比较差异无统计学意义(P>0.05)。术后第3天2组患者血清胃动素及胃泌素水平均显著低于术前,差异有统计学意义(P<0.05)。术后第3天,观察组患者血清胃动素及胃泌素水平均显著高于对照组,差异有统计学意义(P<0.05)。
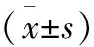
表3 2组患者血清胃动素及胃泌素水平比较
2.4 2组患者术后并发症发生情况比较对照组患者术后发生切口感染3例,吻合口出血2例,肠梗阻3例,并发症发生率为36.36%(8/22);观察组患者术后发生切口感染1例,肠梗阻1例,并发症发生率为9.09%(2/22);观察组患者术后并发症发生率低于对照组,差异有统计学意义(χ2=4.651,P<0.05)。
3 讨论
近年来,直肠癌发病率呈上升趋势,且低位直肠癌较多[6]。早期直肠癌通常没有特殊的症状,大部分患者是通过常规的体检被发现。外科手术是早期直肠癌的首选治疗方式,随着腹腔镜手术技术不断完善,腹腔镜直肠癌根治术已经在国内广泛应用。腹腔镜直肠癌根治术视野清晰,可准确地分离解剖层次,更大程度避免术中对脏器及周围组织的损伤。本研究结果显示,观察组患者术中出血量、术后住院时间和术后并发症发生率均显著低于对照组;提示腹腔镜直肠癌根治术比开腹直肠癌根治术创伤小、患者术后住院时间短、并发症发生率低。
手术不可避免对机体产生创伤,从而刺激炎症介质的释放,随着机体炎症反应的不断增强,体内炎症因子水平也随着增高。CRP是机体的一种重要急性期蛋白,由肝脏合成并释放入血,在机体受到感染或组织损伤时肝细胞在IL-6等细胞因子诱导下大量合成CRP。TNF-α具有广泛的生物学活性,是巨噬细胞被脂多糖和其他细菌产物活化后分泌的一种重要炎症细胞因子,也是一种致热源,能促进IL-1、IL-6、IL-8、TNF以及炎症急性期反应物质的产生,对多种肿瘤细胞和病毒感染细胞有抑制生长或细胞毒作用。因此,可将炎症因子水平作为判断直肠癌术后疗效的重要指标。本研究结果显示,术后第1天观察组患者血清IL-6、CRP、TNF-α水平均显著低于对照组,提示与开腹直肠癌根治术相比,腹腔镜直肠癌手术能减少手术对机体的创伤,减少炎症因子的释放。
胃肠激素是胃肠道分泌的高效生物活性物质,可调节消化器官的各项功能,其中胃泌素和胃动素是最为重要的胃肠激素。胃泌素可促进机体胃肠活动、胃酸分泌等。胃动素通过调控消化间期电位传导周期,增加胃肠蠕动,促进胃排空。手术操作会导致机体胃肠激素水平发生紊乱,抑制胃肠活动,影响预后效果,增加术后并发症的发生率[8-9]。有研究显示,抑制炎症反应程度可有效减轻对直肠癌患者胃动素与胃泌素的影响[7]。传统开腹手术切口大、术中出血量较多、术后并发症发生率较高,还会导致机体出现应激反应,对术后胃肠功能的恢复造成一定影响,严重者可能会影响手术效果[8]。腹腔镜手术可以提供清晰的视野,可更好地进行淋巴结清扫和病灶切除,并且腹腔镜手术的创伤较少,出血量可以有效控制,也可尽可能地减少对周围器官和组织的损伤,不仅提高了手术的操作性,也有利于术后机体康复[9-10]。本研究结果显示,术后第3天,观察组患者血清胃动素及胃泌素水平均显著高于对照组,这与叶方进等[11]研究结果相符,说明腹腔镜直肠根治术对胃肠道器官的牵拉和损伤较小,使患者胃肠激素在术后维持在相对稳定的水平,从而加快术后胃肠功能的恢复。
综上所述,腹腔镜直肠癌根治术治疗直肠癌有创伤小、术中出血少、术后并发症少、住院时间短等优点。但本研究样本量较小,患者随访时间较短,可能会出现一些偏差,有待于进一步完善。

