不同核心启动子对中国仓鼠卵巢细胞重组蛋白表达的影响
肖梦珂,华 宇,冯莹莹,路江涛,翟海晖,王天云,贾岩龙
(1.新乡医学院公共卫生学院,河南 新乡 453003;2.新乡医学院药学院,河南 新乡 453003;3.新乡医学院基础医学院,河南 新乡 453003)
中国仓鼠卵巢(Chinese hamsters ovary,CHO)细胞表达系统已被广泛应用于重组蛋白药物(抗体、疫苗)的研发和生产[1],但应用哺乳动物细胞生产重组蛋白时目的蛋白的表达水平较低以及表达失稳是目前亟待解决的问题[2]。选择合适的启动子对提高重组蛋白的产量具有重要意义。巨细胞病毒(cytomegalovirus,CMV)启动子是哺乳动物细胞中驱动重组蛋白表达的最强的启动子之一,启动子的转录驱动是目的蛋白表达的关键步骤[3-4]。研究表明,超级核心启动子(super core promoter,SCP)能够增强基因转录活性,提高目的蛋白表达及其稳定性[5-6]。本研究通过构建不同启动子(CMV启动子、Natural CMV启动子、SCP2和SCP3)驱动的真核表达载体并分别转染CHO细胞,检测启动子对增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)表达及稳定性的影响,为设计表达载体时选择适用于稳定高产重组蛋白的启动子提供理论依据。
1 材料与方法
1.1 细胞、主要试剂与仪器CHO-K1细胞由本实验室驯化保存。达尔伯克改良伊格尔培养基(Dulbeco′s modified Eagle′s medium,DMEM)-F12购自河南普诺易生物制品研究院有限公司,胎牛血清购自美国Gibco公司,青霉素、链霉素、胰蛋白酶消化液购自上海吉诺生物科技有限公司,Lipofectamine 2000转染试剂购自赛默飞世尔科技(中国)公司,杀稻瘟菌素筛选试剂购自上海生工生物工程股份有限公司,TRIzol Reagent试剂盒、反转录试剂盒购自美国Invitrogen公司;荧光倒置显微镜购自德国Leica公司,流式细胞仪购自美国Thermo公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)仪购自瑞士罗氏公司;以CMV、Natural CMV、SCP2、SCP3为启动子、EGFP为报告基因、杀稻瘟菌素为筛选基因的表达载体CMV-vector、Natural CMV-vector、SCP2-vector、SCP3-vector由安徽通用生物系统有限公司合成,CMV启动子的碱基序列为5′-AGGTCTATATAAGCAGAGCTCTCTGGCTAACTAGAGAACCCACTGC-TTAACTGGCTTATCGAAAT-3′,Natural CMV启动子的碱基序列为5′-AGGTCTATATAAGCAGAGCTCG-TTTAGTGAACCGTCAGATCGCCTGGAGACGCCATC-CACGCTGTTTTGACCTCCATAGAA-3′,SCP2启动子的碱基序列为5′-AGGTCTATATAAGCAGAGCTCG-TTTAGTGAACCGTCAGATCGCCTGGAGACGTCGAG-CCGAGTGGTTGTGCCTCCATAGAA-3′;SCP3启动子的碱基序列为5′-AGGTCTATATAAGCAGAGCTC-GTTTAGTGAACCGTCAGTCCGCCTGGAGACCTCGA-GCCGAGTGGTCGTGCCTCCATAGAA-3′。
1.2 细胞培养、转染及分组将CHO-K1细胞培养于含体积分数10%胎牛血清、100 U·L-1青霉素、链霉素溶液的DMEM-F12培养基中,于37 ℃含体积分数5%CO2恒温培养箱中培养,细胞密度达80%时进行传代。收集对数生长期CHO-K1细胞,以每孔2×105个细胞接种于24孔板。根据转染表达载体的不同将细胞分为对照组、Natural CMV组、SCP2组和SCP3组,每种载体设3个复孔。当细胞密度达到约70%时,使用Lipofectamine®2000转染试剂2 μL分别将1 μg CMV-vector、1 μg Natural CMV-vector、1 μg SCP2-vector、1 μg SCP3-vector质粒转染CHO细胞。转染方法按照试剂盒说明进行。收集转染48 h的4组细胞用于后续实验。
1.3 荧光倒置显微镜观察4组细胞的瞬时转染效率转染48 h后,通过荧光显微镜检测转染细胞的荧光强度,计算EGFP阳性和阴性细胞数,以EGFP阳性细胞数与总细胞数之比表示转染效率,分析报告基因EGFP瞬时表达。
1.4 流式细胞术检测4组细胞中EGFP表达水平
转染48 h后,使用含15 mg·L-1杀稻瘟菌素的培养基筛选细胞7 d后未成功转染载体的细胞死亡,将成功转染载体的细胞改用含低浓度杀稻瘟菌素(7.5 mg·L-1)的培养基维持培养7 d后获得第1代多克隆细胞,并继续传代培养至第30代。分别收集对数生长期的第1代和第30代细胞,1 000 r·min-1离心 5 min,吸弃上清,重悬于200 μL的磷酸盐缓冲液中,应用流式细胞术检测各组第1代和第30代多克隆细胞中EGFP表达的平均荧光强度(mean fluorescence intensity,MFI),MFI=细胞总荧光强度/细胞总数,以MFI代表EGFP蛋白表达水平。实验重复3次,取均值。
1.5 qRT-PCR法检测4组细胞中EGFP mRNA相对表达量收集4组稳定筛选的第30代多克隆细胞,根据TRIzol Reagent试剂盒说明书提取总RNA,并用反转录试剂盒将总RNA反转录为cDNA。EGFP上游引物序列为5′-CTACGTCCAGGAGCGCACCATCT-3′,下游引物序列为5′-GTTCTTCTGCTTGTCGGCCATGATAT-3′;内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-CGACCCCTTCATTGACCTC-3′,下游引物序列为5′-CTCCACGACATACTCAGCACC-3′。qRT-PCR 反应体系:cDNA 2 μL,SYBR Green Buffer 10 μL,上下游引物各1 μL,ddH2O 6 μL;反应程序:95 ℃预变性60 s,95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,重复45个循环。采用2-ΔΔCt法计算EGFP mRNA的相对表达量。实验重复3次,取均值。
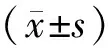
2 结果
2.1 4组细胞的瞬时转染效率比较结果见图1。对照组、Natural CMV组、SCP2组、SCP3组细胞的瞬时转染效率分别为(67.00±2.65)%、(66.67±7.09)%、(74.00±4.36)%、(80.33±1.53)%。对照组、Natural CMV组、SCP2组细胞的瞬时转染效率比较差异无统计学意义(P>0.05)。SCP3组细胞的瞬时转染效率显著高于对照组,差异有统计学意义(P<0.05)。
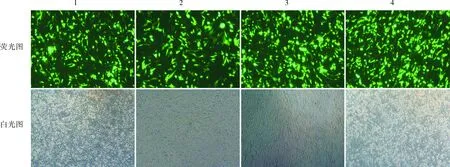
1:对照组;2:Natural CMV组;3:SCP2组;4:SCP3组。
2.2 4组细胞中EGFP蛋白表达水平比较结果见表1。对照组、Natural CMV组、SCP2组、SCP3组第1代多克隆细胞中EGFP蛋白表达水平两两比较差异均无统计学意义(P>0.05)。对照组、Natural CMV组、SCP2组第30代多克隆细胞中EGFP蛋白表达水平两两比较差异无统计学意义(P>0.05)。与对照组、Natural CMV组、SCP2比较,SCP3组第30代多克隆细胞中EGFP蛋白表达水平显著增高,差异有统计学意义(P<0.05)。

表1 4组细胞中EGFP蛋白表达水平比较
2.3 4组第30代多克隆细胞中EGFP mRNA相对表达量比较对照组、Natural CMV组、SCP2组、SCP3组第30代多克隆细胞中EGFP mRNA相对表达量分别为1.00±0.02、1.04±0.08、1.26±0.06、1.38±0.06。对照组与Natural CMV组第30代多克隆细胞中EGFP mRNA相对表达量比较差异无统计学意义(P>0.05);SCP2组、SCP3组第30代多克隆细胞中EGFP mRNA相对表达量显著高于对照组、Natural CMV组,差异有统计学意义(P<0.05);SCP3组第30代多克隆细胞中EGFP mRNA相对表达量显著高于SCP2组,差异有统计学意义(P<0.05)。
3 讨论
CHO细胞是目前生产重组蛋白药物常用的细胞系之一,但是在细胞长期培养过程中重组蛋白表达量及稳定性逐渐降低。表达载体的优化对于提高外源基因在CHO细胞中的表达及稳定性至关重要[7]。启动子是表达载体的重要组成部分,核心启动子是基因精确转录所必需的DNA序列,但启动子本身容易受到干扰,导致重组蛋白在长期培养中产量下降或表达不稳定[5]。研究表明,SCP1和SCP2在HeLa细胞和果蝇中的转录活性增强[8]。SCP3可促进人宫颈癌细胞HeLa S3和人骨髓源性神经母细胞瘤细胞SH-SY5Y中靶基因的瞬时表达和长期表达稳定性[9]。然而,SCP在CHO细胞中的作用尚不清楚。
为了研究不同核心启动子对CHO细胞中重组蛋白表达的影响,本课题组构建了4种核心启动子(CMV核心启动子、Natural CMV核心启动子、SCP2和SCP3)驱动的表达载体并转染CHO细胞,分析其对EGFP瞬时表达以及长期稳定性表达的影响。结果显示,SCP3组细胞的瞬时转染效率显著高于对照组,与对照组、Natural CMV组、SCP2比较,SCP3组第30代多克隆细胞中EGFP表达水平显著增高;这一结果表明,在细胞长期培养过程中,重组蛋白的产量和稳定性会受到表达载体的启动子元件相互作用的影响,这与之前的研究结果一致[10-11]。有报道证实,SCP已经被用于TFIID与DNA结合的生物分析、转录过程的生物化学研究以及促进基因表达,SCP与CMV增强子的协调作用提高了EGFP报告基因转录活性[12-13]。本研究结果显示,SCP2组、SCP3组第30代多克隆细胞的EGFP mRNA相对表达量显著高于对照组、Natural CMV组,SCP3组第30代多克隆细胞的EGFP mRNA相对表达量显著高于SCP2组,表明核心启动子不仅可以影响转录的启动,而且可以促进转录水平。
综上所述,SCP3不仅可以驱动高水平的转录,而且可以提高EGFP的表达及其稳定性,为哺乳动物细胞高效稳定表达系统的优化提供了一种潜在的新型策略。后续研究中,将利用核心启动子的不同元件排列组合进行启动子的合成生物学分析,以期找到高效稳定的强启动子用于重组蛋白的表达。

