2型糖尿病肾病患者发生颈动脉粥样硬化危险因素分析
王 焕,崔 凯,尤冠巧,郭利芹,徐 可,布海霞
(1.新乡市中心医院肾内科,河南 新乡 453000;2.新乡市中心医院普瘤外科,河南 新乡 453000;3.河南省人民医院肾内科,河南 郑州 450000)
动脉粥样硬化是2型糖尿病肾病患者较为常见的血管病变。而颈动脉粥样硬化是动脉粥样硬化一种常见的表现,由于其表浅易于评估从而成为观察全身动脉粥样硬化病变的窗口。因此,通过彩超评估颈动脉病变情况可以反映2型糖尿病肾病患者血管的病变情况。筛查2型糖尿病肾病的颈动脉脉粥样硬化的危险因素,有助于进行早期的预防和治疗,从而减少2型糖尿病肾病患者颈动脉粥样硬化的发生,减少心脑血管事件的发生。
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种慢性睡眠障碍,其特征是发作性完全或部分上呼吸道阻塞。糖尿病肾病患者中OSA的患病率较高[1],有研究显示,OSA可影响血糖和血压的控制[2-3]。而高血压、高血糖是导致糖尿病患者发生心血管并发症的常见危险因素。OSA除了可影响血糖、血压控制外,其伴随的间歇性低氧血症还可以触发导致糖尿病微血管并发症以及大血管并发症发生的病理生理途径,包括氧化和炎症途径的激活以及晚期糖基化终产物的大量产生。基于此,本研究探讨了2型糖尿病肾病患者发生颈动脉粥样硬化的危险因素,并重点关注OSA与颈动脉粥样硬化的关系,现将结果报道如下。
1 资料与方法
1.1 一般资料选择2015年1月至2020年1月新乡市中心医院收治的2型糖尿病肾病患者214例为研究对象。病例纳入标准:(1)年龄>18岁;(2)糖尿病病史>5 a;(3)尿白蛋白定量>30 mg·24 h-1,同时合并糖尿病视网膜病变;(4)估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)>90 mL·min-1。排除标准:(1)合并感染者;(2)合并急性心脑血管疾病者。根据颈动脉彩色多普勒超声检查结果将患者分为非动脉粥样硬化组(n=40)和动脉粥样硬化组(n=174)。
1.2 颈动脉彩色多普勒超声检查所有患者行颈动脉彩色多普勒超声检查,由同1名医师进行操作。检查时患者取去枕平卧位,头后仰,充分暴露颈部,探头置于颈部行纵向、横向扫描检查,分别探查双侧颈总动脉临近分叉处近端、双侧颈内动脉的内-中膜厚度(internal media thickness,IMT)。IMT取双侧最大值为统计值,IMT≥1.0 mm为增厚,颈动脉斑块指颈动脉内膜局限性的突出于管腔的回声结构(可表现为高、低回声或者伴有声影,颈动脉斑块的诊断标准为斑块厚度≥1.3 mm[4],颈内动脉IMT增厚和或有斑块形成,判定为动脉粥样硬化。
1.3 资料收集(1)常规监测患者血压、空腹血糖,记录患者的身高、体质量,并计算体质量指数(body mass index,BMI)。(2)生物化学指标:入院当天清晨抽取患者空腹肘静脉血4 mL,3 000 r·min-1离心10 min,分离上层血清。采用尿素酶谷氨酸脱氢酶法检测血尿素氮,采用肌氨酸氧化酶法测量血肌酐,采用氧化酶法检测三酰甘油、胆固醇、低密度脂蛋白(low-density lipoprotein, LDL)水平;高效液相色谱法测定糖化血红蛋白(glycated hemoglobin,HbA1c)水平;邻苯三酚红比色法测定24 h尿蛋白定量;根据CKD-EPI公式[5]计算eGFR。(3)常规行多导睡眠监测判断患者是否存在OSA。OSA的诊断标准:每晚睡眠7 h内发生呼吸暂停和低通气30次以上,或每小时呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5次。
2 结果
2.1 2型糖尿病肾病患者颈动脉粥样硬化发生情况214例2型糖尿病肾病患者中共有174例发生颈动脉粥样硬化,发生率为81.3%。
2.2 2型糖尿病肾病患者发生颈动脉粥样硬化危险因素单因素分析结果见表1。2组患者年龄、性别分布、HbA1c、eGFR比较差异无统计学意义(P>0.05)。2组患者BMI、收缩压、舒张压、三酰甘油、胆固醇、LDL、24 h尿蛋白定量及OSA发生比例比较差异均有统计学意义(P<0.05)。
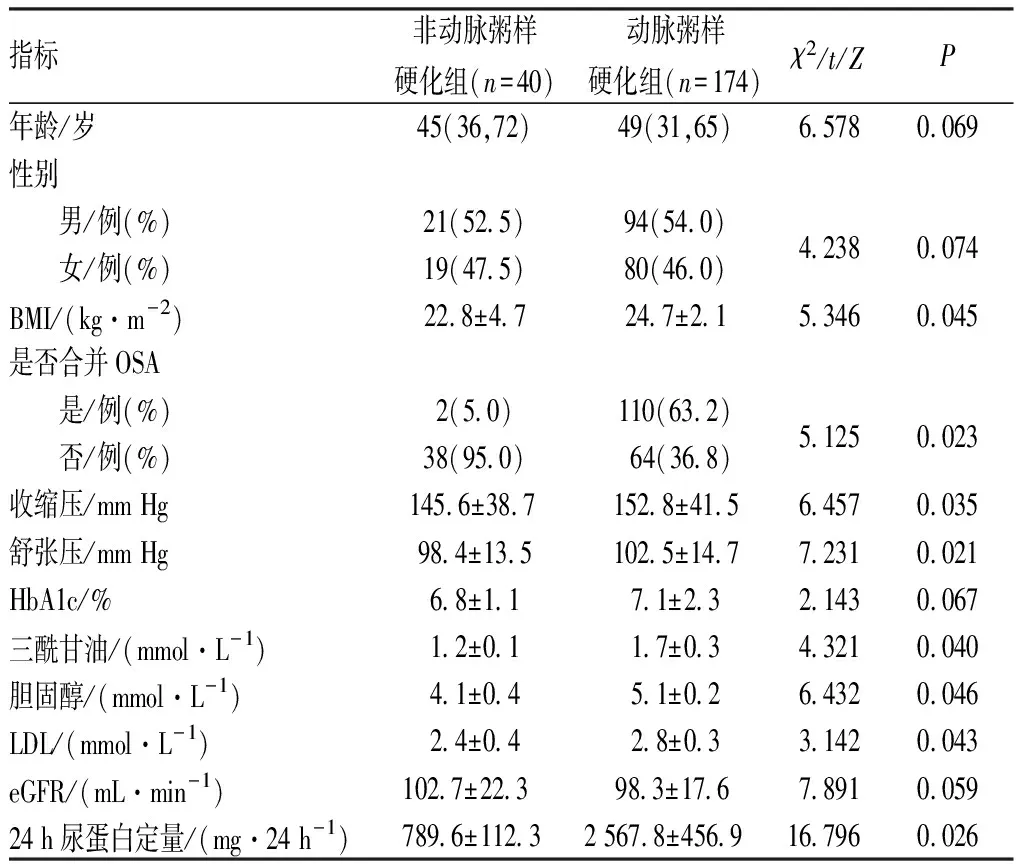
表1 2型糖尿病肾病患者发生颈动脉粥样硬化危险因素单因素分析
2.3 2型糖尿病肾病患者发生颈动脉粥样硬化危险因素logistic回归分析结果见表2。将单因素分析中差异有统计学意义的指标进一步行多元线性logistic回归分析,结果显示,收缩压、舒张压、三酰甘油、合并OSA是2型糖尿病肾病患者发生颈动脉粥样硬化的危险因素(P<0.05)。
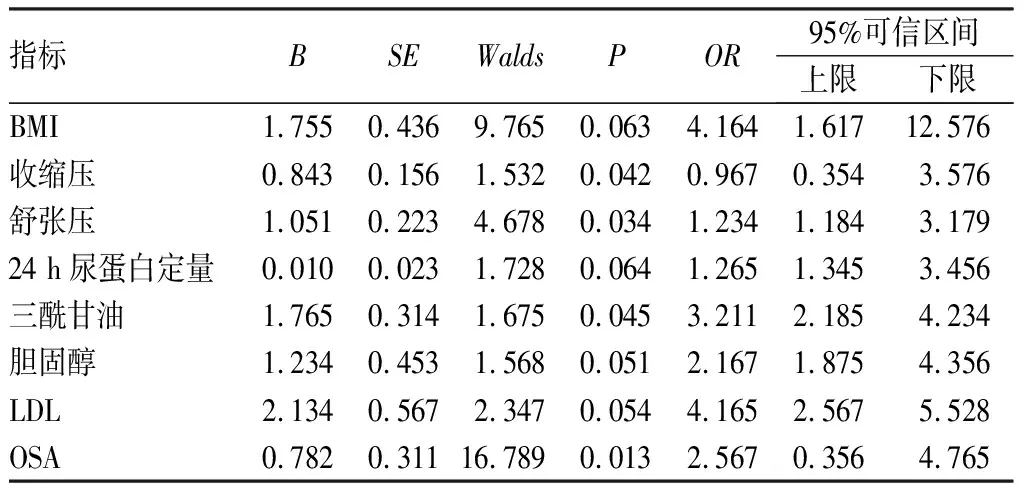
表2 2型糖尿病肾病患者发生动脉粥样硬化危险因素logistic回归分析
3 讨论
目前,在我国糖尿病肾病是导致终末期肾病的首位原因,而心脑血管疾病是导致慢性肾脏病患者死亡的最主要原因。在一项有关慢性肾脏病心血管疾病患病率的调查中发现,糖尿病肾病患者的心血管疾病发病率远高于其他病因所致的慢性肾脏病患者的心血管疾病发病率[6]。动脉粥样硬化是心血管事件发生的早期基础病理变化,具体发生机制为血管内皮细胞在受到各种刺激后受损,导致内皮功能障碍,出现血管舒张功能紊乱,从而导致炎症细胞因子分泌、单核巨噬细胞聚集等。动脉粥样硬化的初期表现为动脉内膜增厚,最终形成斑块。而不稳定斑块的脱落会导致急性心脑血管事件的发生,严重时可导致患者死亡。
动脉粥样硬化是一种全身性疾病,全身各处动脉均可受累,特别是大动脉的受累可使患者死亡风险明显增加。目前超声检查颈动脉IMT被认为是最容易评估动脉粥样硬化的量化指标。在本研究中,动脉粥样硬化的发生率高达81.3%,提示2型糖尿病肾病患者动脉粥样硬化的发生率较高,应尽早进行检测并给予及时干预。引起动脉粥样硬化的因素较多,本研究通过单因素分析及进一步的logistic回归分析显示,高血压、高三酰甘油及合并OSA是2型糖尿病肾病患者发生颈动脉粥样硬化的危险因素。
高血压可促进动脉粥样硬化的发生、发展已经得到既往研究的证实[7]。三酰甘油经分解代谢后产生的LDL对血管内皮具有直接损伤作用,另外三酰甘油本身还可降低人体内高密度脂蛋白水平,并通过促进凝血功能等机制参与动脉粥样硬化甚至动脉斑块的形成和发展。
OSA是一种慢性睡眠障碍,其特征是发作性完全或部分上呼吸道阻塞,导致间歇性低氧血症和睡眠碎片。有调查结果显示,OSA的总体患病率已大幅增加,在2型糖尿病患者中占58%~86%[8-9]。本研究中,OSA的患病率达52.3%,与上述调查结果接近。一项对132例2型糖尿病患者进行4.9 a跟踪调查的纵向研究显示,OSA是发生冠状动脉性疾病的一个预测因子(危险比为1.9,95%可信区间为1.1~3.3),其还可增加患者发生心力衰竭的风险[10]。SEICEAN等[11]研究发现,呼吸睡眠低通气指数可使卒中风险增加2.57倍。以上研究结果提示,2型糖尿病肾病患者合并OSA可能是导致心脑血管疾病风险增加的危险因素。
合并OSA使2型糖尿病肾病患者发生颈动脉粥样硬化风险增加的机制可能是:(1)间歇性低氧血症导致血管收缩和氧化应激增加,如一氧化氮合酶活性的改变,导致内皮功能障碍和微血管损伤[12]。(2)交感神经系统活动增加、内皮素-1水平升高、肾素-血管紧张素-醛固酮调节改变导致血压升高。有研究显示,OSA是通过高血压状态导致糖尿病相关大血管并发症[13]。(3)夜间低氧血症会导致血管内皮生长因子水平增加[14],血管内皮生长因子是一种低氧敏感的糖蛋白,已被证明在糖尿病视网膜病变[15]中起一定作用,可刺激新生血管,包括微血管及大血管的内皮增生,内膜增厚。(4)与OSA相关的炎症标志物的增加和高凝状态也是导致发生颈动脉粥样硬化风险增加的可能因素[16]。
综上所述,血压、血脂及OSA共同参与了2型糖尿病肾病患者颈动脉粥样硬化的发生、发展,但何为启动环节,何为关键环节,三者之间是否存在相互影响尚不清楚,还需要后续研究进一步证实。但可以肯定的是,血压、血脂的控制达标以及针对OSA的治疗可以减少颈动脉粥样硬化的发生,降低2型糖尿病肾病患者心脑血管事件的发生概率。

