香叶木素对大鼠脑缺血再灌注损伤的保护作用研究
肖聚慧,刘小军
(郑州大学第二附属医院,河南 郑州 450014)
中风是一组以脑部缺血及出血性损伤症状为主要临床表现的疾病,具有极高的病死率和致残率,中风的病死率有随年龄增长而上升的趋势。中风分为两种类型:一种是由血管阻塞所造成的缺血性脑中风,一种是由出血所造成的出血性脑中风[1]。不论是缺血性或是出血性脑中风都会造成脑功能异常。除了直接的缺血、缺氧,再灌注损伤在疾病进展中也起着关键作用,其中涉及到过度的炎症反应,自由基损伤,Ca2+超载,自噬和细胞凋亡等多种病理和生理学过程。由于一直缺乏有效的治疗措施,目前认为预防是最好的措施,临床上迫切需要提出一种有效的脑缺血再灌注损伤医学策略并揭示其潜在机制。
研究证实,很多天然植物提取物具有治疗脑缺血性疾病的巨大潜力[2]。香叶木素(Dio)主要提取自柠檬,活性成分为黄酮类化合物,具有抗氧化、抗感染、抗休克等多种作用[3-4],且多篇文献报道香叶木素具有抑制肿瘤的作用[5-7]。迄今为止,对香叶木素与脑缺血再灌注损伤的研究还很少,揭示香叶木素对脑I/R损伤、细胞自噬和细胞凋亡之间潜在的药理学联系,实现其药用价值。
在本研究中,笔者旨在探索香叶木素是否可以增加脑缺血再灌注对大鼠脑血流量,减少缺血梗死体积,并评估香叶木素对动物保护神经组织和神经行为功能的作用。
1 材料和方法
1.1 实验动物
48只10周龄(体质量250~280 g)雄性Wistar大鼠购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],动物饲养于恒温、恒湿的 SPF 级动物房,维持12 h/12 h的光/暗循环条件。本项目的研究过程得到动物伦理委员会的批准,承诺尽量减少动物的使用数量并减轻动物的痛苦,动物处置方法均符合动物伦理学规范。
1.2 分组及处理
将大鼠随机分为假手术对照组(Sham组,n=16)、脑缺血/再灌注组(I/R组,n=16)、香叶木素治疗组(I/R + Dio组,n=16)。使用灭菌生理盐水稀释Dio,造模14 d前开始给药(20 mg/kg),连续灌胃14 d,Sham组和I/R组使用灭菌的生理盐水灌胃。14 d治疗后,对大鼠进行短暂局灶性脑缺血模型造模。
1.3 短暂局灶性脑缺血模型
参照文献[8],通过大脑中动脉闭塞(MCAO)建立短暂局灶性脑缺血的啮齿动物模型。通过腹膜内注射10%水合氯醛(400 mg/kg)麻醉大鼠。在整个手术过程中,使用加热垫将大鼠体温维持在(37±0.5)℃。沿腹部中线切开颈部皮肤2 cm,分离左侧的颈总动脉、颈外动脉和颈内动脉并结扎。将规格为3-0的单丝尼龙线插入大脑中动脉,从颈内动脉与颈外动脉分叉处开始约15 mm。持续缺血1.5 h后抽出单丝尼龙线,再灌注24 h。假手术的对照组大鼠不进行MCAO,其余操作一致。激光多普勒系统(PeriFlux System 5010,Perimed,斯德哥尔摩,瑞典)用于监测局部脑血流量(rCBF)。
1.4 神经功能评分
使用改良的五分量表评分系统评估大鼠的神经功能,得分越高表明神经功能损害越严重。再灌注后24 h后评分包括0分:神经系统功能未见丧失,活动正常;1分:不能伸展左前爪;2分:爬行时向左转;3分:走路时向左侧倾倒;4分:无法自发地行走与意识障碍。
1.5 TTC染色
再灌注24 h后在麻醉下处死大鼠进行TTC染色。将鼠脑放入-20 ℃冰箱中速冻10 min,使用振动切片机将大鼠大脑切成 2 mm 的厚片,浸入2% TTC染液(Solarbio,G3005,北京,中国)中,用锡箔纸包裹避光,放在摇床上37 ℃ 孵育15~30 min,使脑片均匀接触到染色液。红色表示正常的脑组织,而灰色区域表示梗塞的组织。使用Image-Pro Plus 6.0软件(Media Cybernetics)计算梗塞体积。
1.6 HE染色
如前所示,再灌注24 h后收集大鼠鼠脑,常规石蜡包被后制备10 μm石蜡切片,然后浸入二甲苯中脱蜡。随后,依次置于无水乙醇、95%酒精、90%酒精、80%酒精、70%酒精中5 min,最后用蒸馏水冲洗使切片水合。切片放入Harris苏木素染6 min,用1%的盐酸酒精分化数秒,使用0.6%氨水返蓝,流水冲洗后放入伊红染液中染色2 min。常规脱水透明后使用中性树胶封片。用Olympus BX50光学显微镜观察载玻片并拍照。
1.7 免疫荧光染色
大鼠用生理盐水灌注2 min后用4%多聚甲醛灌注固定,取出鼠脑后放在4%多聚甲醛中浸泡过夜。制备40 μm厚的冰冻切片,室温下使用山羊血清封闭2 h,然后孵育抗TUNEL(1∶100,Abcam),抗LC3(1∶400,Cell Signaling Technology),抗NeuN(1∶300,Abcam)4 ℃过夜。室温孵育山羊来源的二抗(1∶1 000,Cell Signaling Technology)2 h,滴加防荧光淬灭剂后封片。显微镜下拍片后进行后续分析。
1.8 蛋白质免疫印迹
再灌注24 h后在麻醉状态下处死动物。在冰上分离鼠脑并制备匀浆后,用RIPA缓冲液裂解组织。离心后收集上清液,使用BCA法测蛋白浓度。等量蛋白上样电泳,然后将其转移到聚偏二氟乙烯(PVDF)膜(Millipore,MA,美国)中。10%脱脂奶室温封闭2 h,然后用抗大鼠LC3 I(1∶3 000,Cell Signaling Technology),抗大鼠LC3 Ⅱ,抗大鼠Beclin(1∶3 000,Cell Signaling Technology),抗大鼠Bcl-2(1∶2 000,Abcam),抗大鼠Atg7(1∶2 000,Cell Signaling Technology),抗大鼠β-actin(1∶5 000,Cell Signaling Technology),4 ℃孵育过夜。PBST洗涤后,将膜与辣根过氧化物酶(HRP)偶联的山羊抗兔IgG(北京天根生物技术有限公司)在室温下孵育1 h。在化学发光试剂(Millipore,MA)中测量蛋白质的表达量,结果表示为目的蛋白/β-actin的值。
1.9 统计学处理
2 结果
2.1 香叶木素对脑缺血再灌注大鼠脑血流量和神经系统功能的影响
为了直观观察短暂局灶性缺血再灌注的脑血流量变化,因此通过激光多普勒系统对脑血流进行成像观察。如图1A显示,Sham组大鼠的脑血量正常,全脑均有血液灌流,而I/R组中可以明显观察到红色区域减少,表征鼠脑的脑血流量减少(P<0.001),提示I/R组大鼠脑梗死区域增多。值得注意的是,Dio治疗组大鼠的脑血流量相较于Sham组有所下降,但是比起I/R组有明显的增加(P<0.01)。大鼠的神经功能方面,如图1B所示,Sham组大鼠神经功能正常,平均分低于1分;而I/R组的平均分为3分,表明I/R组大鼠神经功能损伤严重;I/R+Dio组大鼠平均得分为1分,表明大鼠出现了较轻微的神经功能损伤。

注:与Sham组相比,###P<0.001;与I/R组相比,**P<0.01。图1 香叶木素对脑缺血再灌注大鼠脑血流量(A)和神经系统功能(B)的影响
2.2 香叶木素对脑缺血再灌注大鼠脑梗死体积及组织损伤的影响
缺血再灌注24 h后取出鼠脑分析鼠脑的组织损伤和梗死情况。如图2A所示,Sham组大鼠的鼠脑呈现鲜红色,且颜色分布均匀;I/R组大鼠的左侧鼠脑出现灰色的梗死区域,且大脑中部梗死区域更多(P<0.001);I/R+Dio组大鼠的左侧鼠脑有一定的梗死,但是相较于I/R组大大降低。HE染色观察大鼠皮层区域的损伤情况,发现Sham组大鼠皮层结构正常,细胞排列整齐,细胞形态正常;I/R组大鼠皮层结构出现大量破坏,细胞排列疏松,部分神经细胞可见肿胀、破裂和坏死,细胞核出现解体;I/R+Dio组大鼠皮层结构未发生较大改变,细胞形态较为正常,未见明显坏死区域。

注:与Sham组相比,###P<0.001;与I/R组相比,**P<0.01。图2 香叶木素对大鼠鼠脑梗死区域(A)和皮层组织(B)的保护作用
2.3 香叶木素对脑缺血再灌注大鼠脑中细胞凋亡的影响
TUNEL染色发现,正常的细胞几乎没有DNA的断裂,因此没有3′-OH形成,很少能够被标记。Sham组中仅有少量的TUNEL阳性细胞,而I/R组中出现大量TUNEL阳性的神经元(P<0.001),表明I/R组大鼠皮层区域有大量神经元出现凋亡。相较于I/R组,I/R+Dio组中TUNEL阳性细胞数量降低(P<0.01),表明Dio治疗对大鼠鼠脑神经元具有保护作用。
2.4 香叶木对脑缺血再灌注大鼠脑中细胞自噬的影响
图4A显示,Sham组中几乎无LC3信号,而I/R组中LC3阳性细胞显著增加,I/R+Dio组中LC3信号明显少于I/R组。另外,相较于Sham组,I/R组的NeuN阳性细胞有少量降低;相较于I/R组,I/R+Dio组NeuN阳性细胞有所增加。LC3是细胞自噬的标志物,而NeuN可以标记成熟的神经元。I/R可以导致大鼠神经元自噬增多,从而导致神经元的数量减少。并且使用Western Blot对自噬相关的蛋白进行了定量检测,结果显示与Sham组相比I/R组中LC3 Ⅱ/LC3 Ⅰ比例增加(P<0.001),Beclin和Atg7表达均显著增加(P<0.001);抗凋亡蛋白Bcl-2表达低于I/R +Dio组(P<0.001)。
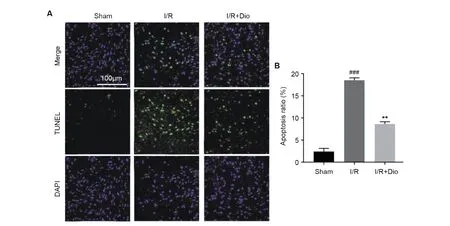
注:A.免疫荧光染色代表图;B.凋亡率统计图。与Sham组相比,###P<0.001;与I/R组相比,**P<0.01。图3 香叶木素治疗对皮层神经元细胞凋亡的影响

注:A.免疫荧光染色代表图;B.Western Blot代表图;C.LC3 Ⅱ/LC3 Ⅰ统计图;D.Beclin统计图;E.Agt7统计图;F.Bcl-2统计图。与Sham组相比,###P<0.001;与I/R组相比,**P<0.01。图4 香叶木素对神经元自噬的影响
3 讨论
在本研究中,笔者证实了香叶木素对大鼠大脑中动脉闭塞后诱导的脑缺血再灌注损伤的积极影响,发现用香叶木素处理的动物在脑缺血再灌注后脑血流量增加,动物的神经行为功能评分减少。香叶木素治疗组脑梗死体积减少,神经元的凋亡和自噬均减少。研究结果表明,香叶木素可以减轻脑缺血再灌注的损伤。
香叶木素广泛存在与自然界的草本药物中,是很多药用植物的有效成分,常用于治疗恶性肿瘤[3]。例如香叶木素可以抑制人类肝细胞CYP1A 酶活性,具有抗诱变和抗变应的特性,可用于肝癌的治疗[9]。另外,香叶木素可减弱 CCl4诱导的肝损伤大鼠NLRP3 炎性小体信号通路活化增加细胞增殖,减少细胞凋亡从而降低大鼠的肝纤维化程度[10]。香叶木素会降低IL-1β诱导的新生大鼠骨关节炎软骨细胞NF-κB P65从细胞质向细胞核的转运,通过抑制NF-κB通路活化缓解软骨细胞凋亡和免疫反应[11]。香叶木素这种抑制细胞凋亡,减轻炎症反映的功能是否可以缓解因缺血再灌注导致的脑损伤呢?笔者采用激光多普勒系统观察大鼠脑部的血流变化,发现I/R造模组大鼠血流明显减少,而Dio治疗可以增加大鼠的脑血流量;另外,对脑组织的切片TTC染色也显示出I/R会导致大鼠鼠脑梗死区域增加,皮层组织细胞结构被破坏,神经细胞出现坏死,Dio的治疗可以减少梗死,维持大脑的正常细胞形态和组织结构。且经过脑I/R后,大鼠出现了明显的行为障碍,神经功能评分增加;提前的Dio干预可以有效预防I/R造成的行为缺陷。
脑缺血再灌注引起的损伤主要表现为进行性的脑细胞损伤。在I/R过程中,神经元可能发生坏死和凋亡[12]。自噬是一种高度保守的细胞行为,主要参与细胞内大分子循环以及受损细胞器和功能障碍蛋白的清除,这在维持细胞内环境的稳定性中起着重要作用。细胞通过自噬相关基因的表达和调控自主发挥作用,降解细胞内成分,而缺血和缺氧是自噬激活的重要诱因[13]。自噬相关蛋白 (autophagy-related protein,Atg) 是一类自噬相关的蛋白, 在生物体内参与调节自噬的过程。其中几个关键蛋白, 也成为自噬标志物,如微管相关蛋白1轻链3 (LC3)以及与其结合辅助LC3成熟的Atg 7,液泡分选蛋白30基因的同源物Beclin等[14]。细胞内的LC3经过加工,在胞浆中形成可溶性的LC3Ⅰ,之后LC3Ⅰ需要Atg7和Atg3参与的泛素化修饰加工[15]。泛素化LC3Ⅰ与通过自噬体膜表面的磷脂酰乙醇胺耦联,成为膜结合形式的LC3Ⅱ。LC3Ⅱ定位于前自噬体和自噬体, 是自噬体的标志分子,随自噬体膜的增多而增加。LC3Ⅱ的含量或LC3Ⅱ/LC3Ⅰ的比例与自噬体的数量呈正相关,LC3Ⅱ与LC3Ⅰ的比值增加,反映了细胞的自噬活性增加[16]。Beclin在细胞内主要位于反面高尔基体、内质网和线粒体中。Beclin包含三个结构域:BH-3域,中央卷曲螺旋结构域和进化保守结构域,这些结构域参与自噬调节的蛋白质网络相互作用[17]。在正常情况下,抗凋亡蛋白Bcl-2通过与BH-3结构域的相互作用来抑制自噬[18]。免疫荧光和蛋白质免疫印迹结果显示,I/R组大鼠的TUNEL阳性细胞显著增多,自噬相关蛋白LC3 Ⅱ/LC3 Ⅰ的值显著增加,Beclin和Atg 7的表达也显著增加,而抗凋亡的Bcl-2表达则明显低于I/R+Dio组,表明脑I/R可以激活神经元的自噬信号,促进细胞自噬和细胞凋亡,而Dio的治疗可以抗细胞凋亡,减少神经元的自噬现象从而维持神经功能的正常。
综上所述,本研究首次发现了香叶木素对脑缺血再灌注诱导的神经元自噬的保护作用。香叶木素的干预可以减少神经元自噬来预防脑缺血再灌注损伤。但是,笔者研究有一些局限性,在未来的研究中将继续探索脑缺血再灌注损伤出现之后,香叶木素是否也能发挥治疗作用,以及其发挥作用是否通过其他信号通路和分子机制。

