基于氧化应激损伤保护的玉竹多糖降糖活性机制研究
肖作奇,潘涛,邱盼子,欧阳波
(湖南省妇幼保健院药学制剂部,湖南 长沙 410008)
玉竹为百合科植物玉竹[Polygatumodoratum(Mill.)Druce]的干燥根茎,湘产玉竹是国产玉竹中道地药材的一种。《本草正义》准确提出其有“治津液枯涸,口渴嗌干等症,而胃火制热,燥渴消谷,多食易饥者,尤为捷效”[1],是中医学治疗糖尿病的常用药。现代药理学研究表明,玉竹主要成分为挥发油、黄酮、多糖、氨基酸、皂苷等[2],其中玉竹总黄酮[3]、二氢异黄酮[4]等均具有抗糖尿病活性。玉竹中的生物碱成分也被证实具有降糖作用,刘梓晗等首次分离8个生物碱类化合物,并证实其有显著的糖苷酶抑制活性[5]。但是大多的研究认为,玉竹中的多糖是治疗糖尿病的主要活性成分[6]。丁登峰等分离得到玉竹褐色多糖粗提物,并用于大鼠链脲佐菌素糖尿病模型,证明了提取物有降糖作用[7]。还有研究者提出玉竹多糖对糖尿病大鼠胰岛β细胞损伤有显著改善作用[8]。Park S等比较了玉竹、黄柏等多种中药材,发现均能改善Min6细胞上的胰岛素抵抗[9]。然而,近10年对玉竹多糖(POP)的改善胰岛素抵抗作用机制的研究尚未见系统阐述。因此笔者运用HepG2细胞系进行体外研究,通过诱导产生的体外胰岛素抵抗和氧化应激损伤,探究玉竹多糖的降糖活性机理。
1 材料与方法
1.1 材料
1.1.1 药品与试剂
玉竹(衡东县中药饮片厂,批号:20170503);胰岛素(CAS# 11061-68-0)、罗格列酮(CAS#122320-73-4)(Sigma);DEAE-52(美国Sigma公司分装);AB-8大孔树脂(廊坊淼阳化工有限公司);DMEM培养基(BNCC341433);胎牛血清(FBS, BNCC344675)、HepG2细胞(BNCC316757)(北纳生物);BPS、CCK-8试剂盒(上海碧云天生物技术有限公司);葡萄糖、SOD、MDA、GSH检测试剂盒(南京建成生物工程研究所);蛋白定量检测试剂盒、S-PAGE凝胶制备试剂盒(武汉赛维尔生物科技);H2O2等其他化学试剂(国药集团)。
1.1.2 仪器设备
旋转蒸发仪;紫外分光光度计;CO2培养箱;超净工作台;DP72奥林巴斯显微成像系统(OLYMPUS);D-37520高速离心机(Thermo Fisher Scientific);多功能酶标仪(奥豪斯仪器有限公司);凝胶成像系统(Thermo Fisher Scientific)。
1.2 药物处置及分组
正常对照组(NC):不加任何药物处置;胰岛素抵抗模型组(IR):0.1 μmol/L insulin处置24 h后不加其他任何药物;罗格列酮组(RGZ):0.1 μmol/L insulin处置24 h后加2 mg/mL罗格列酮作为阳性对照;低剂量POP组(IR+1 mg/mL POP):0.1 μmol/L insulin处置24 h后加1 mg/mL POP;高剂量POP组(IR+10 mg/mL POP):0.1 μmol/L insulin处置24 h后加10 mg/mL POP。药物孵育24 h后,除NC组外,其余各组加10 μL 0.3%H2O2溶液。每组实验每次设置3个平行样,每个实验重复进行3次。
1.3 方法
1.3.1 POP制备
选用湘玉竹饮片粉碎后,过60目筛。用20倍体积的石油醚热回流脱脂。热水提取3次,每次10倍水,80 ℃下搅拌提取,合并提取液,减压浓缩至10%,搅拌下缓慢加乙醇至80%醇沉比,取沉淀冷冻干燥得到粗多糖。粗多糖经过AB-8大孔树脂脱色[6],Sevage法脱蛋白[10],在经过DEAE过柱,分别用去离子水,0.1 mol/L NaCl洗脱,分离得到精制的POP,硫酸-苯酚法[10]测定样品中POP含量。
1.3.2 细胞培养与细胞模型制备
HepG2细胞使用含10%FBS的DMEM,5% CO2,37 ℃下培养。经过10次传代后选用细胞状态良好的细胞制备胰岛素抵抗HepG2细胞模型:将HepG2细胞置于含1 μmol/L胰岛素的无血清培养基中24 h以上,葡萄糖的消耗量明显减少(P<0.01)时为成功诱导出胰岛素模型[11]。进行药物处置时更换不含FBS的DMEM。
1.3.3 CCK-8法检测细胞活力
更换不含FBS的DMEM,在培养基中加入梯度浓度的POP,即POP终浓度分别为0、0.1、1、5、10 mg/mL。另设置一组加造模剂量的胰岛素(0.1 μmol/L insulin),正常对照组为等体积DMEM不加药物,按1.5×103个/孔细胞密度接种于96孔板中,24 h后,加CCK-8反应液4 h,按CCK-8试剂盒使用说明说操作,在490 nm处检测吸光度,计算细胞活力。
细胞活力(%)=各组吸光度值/正常对照组吸光度均值×100%
1.3.4 葡萄糖消耗实验
将HepG2细胞和IR-CM细胞分别更换含药物培养基培养24 h后,在96孔板中加入试剂盒中检测试剂(由试剂2酶溶液和试剂3酚试剂按1:1比例混合,现配现用),200 μL,再加入各组细胞上清液10 μL。设置空白孔。充分震荡混匀,反应15 min后,于505 nm处检测吸光度。
葡萄糖消耗比(%)=[(样品吸光度-空白孔吸光度)/(对照组吸光度均值-空白孔)-1]×100%
1.3.5 氧化应激指标检测
细胞完成药物处置培养后,收集样品,用细胞裂解液裂解(冰浴)。于4 ℃,4 000 rpm离心5 min,收集沉淀。分别按照试剂盒说明书测定样品SOD、MDA和总GSH水平。
1.3.6 蛋白免疫印迹实验
细胞完成孵育后,弃上清,PBS洗涤2次,加细胞裂解液,转移细胞样品至冰浴中,用匀浆器碾磨30 min,于4 ℃,15 000 rpm离心5 min,取上清液测总蛋白浓度。用10% SDS 聚丙烯酰胺凝胶电泳分离蛋白样品,转膜封闭,孵育一抗PI3K/PPARγ,过夜,孵育二抗。显影成像,Image-J6.0分析PI3K/PPARγ蛋白表达量。
1.4 统计学方法
所有统计数据以均数±标准差表示。用单因素方差分析(ANOVA)和Dunnett’st检验进行统计评价。采用SPSS 16.0进行统计学分析。P≤0.05为差异有统计学意义。
2 结果
2.1 POP提取分离纯化
玉竹多糖提取率7.97%,经过脱色、去蛋白后过柱,去离子水洗脱分离得到中性多糖组分Ⅰ(即本文活性研究对象POP),占玉竹粗多糖67.5%。经硫酸-苯酚法测定样品中POP含量为92.8%。DEAE-2纤维素洗脱曲线见图1。
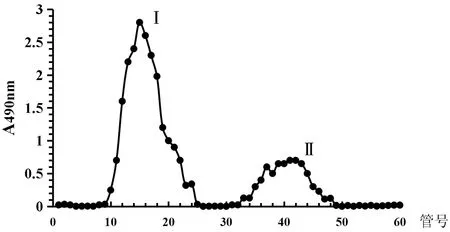
注:Ⅰ去离子水洗脱组分(POP);Ⅱ0.1 mol/L NaCl洗脱组分。图1 玉竹多糖DEAE-52洗脱曲线
2.2 POP对氧化应激损伤HepG2细胞的保护作用
0.01~10 mg/mL浓度的POP对正常培养的HepG2细胞增殖均没有显著的影响,各组差异无统计学意义(P>0.05),结果见表1。高剂量POP对H2O2诱导的HepG2氧化应激损伤细胞有保护作用,作用同RGZ。高剂量POP组较模型组细胞活性有显著增高,差异有统计学意义(P<0.05),结果见表2。实验结果提示,玉竹中性多糖几乎没有HepG2细胞毒性,且对H2O2引起的氧化应激损伤有显著的改善作用。

表1 玉竹多糖对胰岛素抵抗HepG2和正常HepG2细胞活力的影响

表2 玉竹多糖对氧化应激损伤的胰岛素抵抗HepG2细胞活力的影响
2.3 POP对胰岛素抵抗HepG2细胞葡萄糖消耗能力的影响
胰岛素诱发产生胰岛素抵抗后,细胞的葡萄糖消耗水平显著下降(P<0.01),阳性药物RGZ和不同浓度的POP能显著增加胰岛素抵抗细胞的葡萄糖消耗(P<0.01),结果见表3。

表3 玉竹多糖对胰岛素抵抗HepG2细胞的葡萄糖消耗水平的影响
2.4 POP对胰岛素抵抗HepG2细胞中SOD、GSH和MDA水平的影响
在细胞给药24 h后,检测细胞内SOD、GSH和MDA水平以评估胰岛素抵抗引起的氧化应激反应。诱发IR后,抗氧化酶SOD和GSH显著降低(P<0.01),胞内活性氧失衡,引起氧化应激损伤,导致MDA蓄积(P<0.01)。RGZ作为胰岛素增敏剂,有一定氧化应激保护作用,结果显示,RGZ明显升高IR细胞的SOD和GSH水平,同时显著降低MDA蓄积(P<0.01),POP孵育与RGZ有相同的作用,与IR组比较,高剂量的POP能明显升高IR细胞的SOD和GSH水平,同时显著降低MDA蓄积(P<0.01),结果见表4。这可能是POP有氧化应激损伤保护作用,拮抗IR诱发的IR作用,使得SOD和GSH维持在正常水平,从而保护保内活性氧平衡。
2.5 POP对胰岛素抵抗HepG2细胞的P13K和PPARγ蛋白表达的影响
细胞完成孵育后,弃上清取细胞提取蛋白,检测细胞中的P13K和PPARγ蛋白表达量。与正常对照组细胞比较,IR细胞蛋白表达量都显著降低(P<0.01),这可能是细胞发生胰岛素抵抗后,下游信号通路P13K/PPARγ被抑制,进而导致SOD和GSH水平下调,与IR组比较,阳性药物RGZ和POP均能显著提高IR细胞内的P13K/PPARγ表达水平(P<0.05),即激活了P13K信号通路,POP可能有胰岛素素增敏作用和氧化应激保护作用。结果见图2。

注:A.与NC组比较, #P<0.05;与IR组比较,*P<0.05。B.与NC组比较, ##P<0.01;与IR组比较, *P<0.05。图2 玉竹多糖对胰岛素抵抗HepG2细胞的PI3K/PPARγ水平的影响
3 讨论
用高糖、TNF-α和胰岛素等刺激HepG2细胞诱导产生胰岛素抵抗模型用于2型糖尿病(T2DM)研究的体外研究方法已经应用得十分广泛[12-14],IR是T2DM主要发病机制,研究表明,脂肪细胞因子失调或胰岛素信号破坏均会导致胰岛素抵抗的发生,氧化应激反应在这个过程中起十分重要的作用[15]。氧化应激损伤也是T2DM主要并发症之一,高糖、高脂肪酸或持续的胰岛素刺激均会导致细胞内活性氧化物(ROS)的堆积,ROS代谢产物——共轭二烯烃类、丙二醛(MDA)有严重的细胞毒性,会产生氧化应激损伤[16]。T2DM动物实验研究表明,发生胰岛素抵抗的大鼠,肝脏超氧化物歧化酶(SOD)和总谷胱甘肽(GSH)均会显著降低,而代谢产物MDA会蓄积更多[17]。李兰芳等研究证实,TNF-α诱导产生IR的HepG2细胞经吡格列酮孵育后,模型组的ROS水平显著降低,可见,吡格列酮能通过改善氧化应激损伤抑制JNK信号通路[18]。实际上,ROS与IR之间的分子关联十分复杂,蛋白激酶C(PKC)通路和炎症信号转道通路(NF-κB)等也均与OS-IR形成有关[19-20],在胰岛素信号调控下游,胰岛素和受体结合后经胰岛素受体底物-1(IRS-1)和磷脂酰肌醇-3-激酶(PI3-K)传导信号,因此在改善PI3-K胰岛素抵抗发生中起重要枢纽作用。RGZ作为胰岛素增敏剂,增敏机制被报道与特异性过氧化物酶体增殖因子激活剂的γ型受体(PPARγ)有关,在大鼠胰岛素抵抗模型中,RGZ能使IR模型大鼠血清SOD显著升高,MDA显著降低[21]。综上所述,本次研究采用胰岛素诱导产生IR-HepG2细胞模型作为研究模型是可行的。而笔者研究结果表明,IR细胞中发生了氧化应激反应,与正常对照组比较,模型组中SOD和GSH水平增加,MDA显著降低,且RGZ可有效改善这种氧化应激损伤。可见,此模型可以用于研究POP的降血糖作用。
近年来,POP的分离纯化及生物活性分析已成为玉竹药理活性研究的重点,Chen Yi等分离得到精制POP并在体外研究中表明其有抗氧化活性[22],Huiyan Jiang等从玉竹分离纯化后得到分子量约3 500 KD的纯化多糖YZ-2,并在STZ诱导的糖尿病小鼠模型上证实POP能降低模型小鼠的空腹血糖含量并能促进其胰岛素释放,POP能显著改善模型小鼠肝脏组织中的SOD、CAT和GSH水平[23]。
本实验研究结果表明,体外细胞孵育时,0.01~10 mg/mL POP对HepG2细胞生长没有影响,且POP可有效改善对于H2O2造成的氧化应激损伤,与模型组比较,POP给药组细胞存活率显著升高。且10 mg/mL浓度的细胞保护作用优于1 mg/mL浓度,1~10 mg/mL POP浓度都能有效改善胰岛素抵抗,促进模型细胞的葡萄糖摄取,POP会显著升高模型细胞中的的SOD和GSH水平,同时显著降低细胞中的MDA浓度, MDA浓度降低是POP改善氧化应激损伤的结果。蛋白免疫印迹实验结果表明,IR细胞中PIK3蛋白水平显著降低,PPARγ表达降低,POP通过激活PIK3通路,改善胰岛素抵抗,进一步激活下游PPARγ的蛋白表达。10 mg/mL POP可以达到阳性对照药物RGZ的显著效果。综上所述,本研究进一步用体外细胞实验法证实了玉竹中的多糖有基于改善氧化应激损伤而缓解胰岛素抵抗的作用,其分子机制可能是通过激活PIK3通路而发挥胰岛素增敏的效应。

