miR-429靶向肌细胞增强因子2D调控Hippo/YAP信号通路对舌鳞癌细胞的影响
刘 鸣,黄 浩,钟晓敏,聂智亮,雷 雳,孙秋榕
0 引 言
舌鳞癌是口腔颌面部最常见的恶性肿瘤,其发病率逐年升高[1]。目前,舌鳞癌的治疗以手术、放疗和化疗为主,但缺乏特异的靶向治疗药物。舌鳞癌的发病机制尚未明了,探究其发生发展的分子机制可为其发病机制的阐明及治疗靶点的选择提供新途径。微小RNA(miRNA)是一类小分子非编码RNA,其可靶向其靶基因的表达参与调控细胞的增殖和凋亡等生命过程。近年来研究显示,肿瘤中存在大量异常表达的miRNA,这些miRNA参与调控肿瘤细胞的恶性生物学行为,可作为肿瘤治疗的分子靶点[2-3]。miR-429是miR-200家族的成员,其在卵巢癌[4]、肝癌[5]、食管鳞状细胞癌[6]和甲状腺乳头状癌[7]等肿瘤中表达下调,通过上调其表达可抑制肿瘤细胞的恶性表型,进而抑制肿瘤发展进程。有报道称,头颈部鳞状细胞癌组织中miR-429表达降低,上调其表达可抑制舌鳞癌细胞增殖,miR-429可能是舌鳞癌治疗的分子靶点[8]。
Targetscan靶基因在线软件预测显示,肌细胞增强因子2D(myocyte enhancer 2D,MEF2D)可能是miR-429的靶基因。MEF2D是MEF2家族成员之一,其在多种肿瘤中表达升高,促进肿瘤发展进程。例如,MEF2D在神经胶质瘤中表达升高,通过靶向抑制其表达可削弱胶质瘤细胞的增殖、迁移和侵袭能力,并促进胶质瘤细胞凋亡,增强细胞放射敏感性,MEF2D在胶质瘤中起促癌基因作用[9]。然而,MEF2D对舌鳞癌发生发展的影响及miR-429能否靶向MEF2D影响舌鳞癌的发生发展尚未阐明。本研究主要探究miR-429和MEF2D对舌鳞癌细胞增殖、凋亡和迁移的影响及miR-429能否靶向MEF2D发挥作用。
1 资料与方法
1.1 临床资料收集2017年4月至2019年10月赣南医学院第一附属医院口腔科行手术切除的33例舌鳞癌患者的组织及癌旁组织标本。液氮保存,其中男19例,女14例,平均年龄(59.28±7.45)岁。按照国际抗癌联盟及美国癌症联合会(UICC/AJCC)(第8版)进行TNM分期[10],I期5例,II 期14例,III期11例,IV期3例;依据组织分化程度不同分为高分化6例,中分化12例,低分化15例。纳入标准:首次确诊;术前未行放化疗治疗。排除标准:合并其他恶性肿瘤;合并心、肝、肾等重要器官功能障碍者;合并糖尿病等慢性病患者。本研究经过医院伦理委员会批准(批准号:LLSC-2021042901),患者均签署知情同意书。
1.2细胞和试剂舌鳞癌细胞株CAL 27取自中国科学院上海细胞库;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒购自大连宝生物;RPMI 1640培养液、双荧光素酶活性检测试剂盒、Annexin V-FITC/PI凋亡试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒购自北京索莱宝;胎牛血清(FBS)购自浙江天杭生物科技股份有限公司;PCR引物、miR-429 模拟物(mimcs)、模拟对照序列(miR-NC)、MEF2D小干扰RNA(si-MEF2D)、小干扰RNA阴性对照(si-NC)、MEF2D过表达载体(pcDNA-MEF2D)购自上海生工;LipofectamineTM2000试剂盒购自美国Invitrogen公司;兔抗人MEF2D、磷酸化Yes相关蛋白(phosphorylated Yes-associatedprotein,p-YAP)和甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自美国Santa Cruz公司。
1.3方法
1.3.1 RT-qPCR法检测miR-429和MEF2D mRNA表达用RNA抽提试剂盒提取组织总RNA,经逆转录后,行PCR扩增。扩增程序:95℃5 min;95℃10 s,60℃30 s,72℃30 s,共35个循环。引物序列:miR-429上游5'-CGGTAATACTGTCTGGTAA-3',下游5'-GTGCAGGGTCCGAGGT-3';U6上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3';MEF2D上游5'-CGTTGGGAATGGCTATGTC-3',下游5'-GAGGCCCTGGCTGAGTAA-3';GAPDH上游5'-AACGGATTTGGTCGTATTGGG-3',下游5'-TCGCTCCTGGAAGATGGTGAT-3'。2-△△Ct法计算miR-429相对于U6、MEF2D mRNA相对于GAPDH的表达量。
1.3.2舌鳞癌细胞培养和转染复苏舌鳞癌细胞,用含10 % FBS的RPMI 1640培养液培养。取对数期细胞将其接种至6孔板中(1.0×105个/孔),当细胞生长密度至80 %时,用LipofectamineTM2000脂质体法,分别转染miR-NC(miR-NC组)、miR-429 mimics(miR-429组)、si-NC(si-NC组)、si-MEF2D(si-MEF2D组)、pcDNA(pcDNA组)、pcDNA-MEF2(pcDNA-MEF2组)、共转染miR-429 mimics与pcDNA-MEF2(miR-429+pcDNA-MEF2组),转染时间为12 h。更换新鲜培养液,再培养24 h,RT-qPCR法检测细胞中MEF2D或miR-429表达验证转染效果,方法同1.3.1,并收集细胞备用。同时设置对照组(细胞不进行任何转染操作,用常规培养液进行培养)。
1.3.3CCK-8法检测细胞增殖将各组细胞均接种至96孔板中(2.5×104个/孔),每组设3个复孔。培养24 h后,加10 μL CCK-8试剂,孵育2 h,用酶标仪(λ=450 nm)测光密度(A)值。实验重复3次。
1.3.4克隆形成实验将各组细胞接种至6孔板中(1.0×104个/孔),每组设3个复孔。每2 d换一次新鲜培养液,培养14 d后,弃培养液。用4 % 多聚甲醛固定30 min,0.4 %结晶紫染色15 min,显微镜观察,统计超过50个细胞的克隆数。实验重复3次。
1.3.5流式细胞术检测细胞凋亡将各组细胞接种至6孔板中(1.0×105个/孔),每组设3个复孔。培养24 h后,收集细胞,并PBS清洗2次,于离心半径10 cm的离心机,1500 r/min离心5 min,弃PBS。加500 μL结合缓冲液,重悬细胞。然后依次加10 μL Annexin V-FITC和5 μL PI,室温避光孵育15 min后,上流式细胞仪检测细胞凋亡。实验重复3次。
1.3.6划痕实验检测细胞迁移将各组细胞均接种至6孔板中(1.0×105个/孔),每组设3个复孔。培养4 h后,弃培养液。用200 μL无菌移液器枪头沿中轴线在培养板底部划两条平行线,并用PBS冲洗掉划痕间细胞,测量划痕间距d,记为d0 h。更换新鲜培养液,培养24 h后,再次测量细胞间间距d,记为d24 h。细胞迁移距离=d0 h-d24 h。实验重复3次。
1.3.7蛋白质印迹法检测MEF2D和p-YAP蛋白表达将各组细胞接种至6孔板中(1.0×105个/孔),每组设3个复孔。培养24 h后,用RIPA试剂提取细胞中总蛋白。经BCA定量、SDS-PAGE电泳、转膜和封闭后,分别用MEF2D(1∶1000)、p-YAP(1∶1000)和GAPDH(1∶1000)一抗孵育液,4 ℃孵育过夜。再用山羊抗兔二抗(1∶1000)孵育液,37 ℃孵育2 h。加显影液避光显影,凝胶系统曝光拍照,Image J软件分析MEF2D和p-YAP相对于GAPDH的表达量。实验重复3次。
1.3.8双荧光素酶报告基因实验根据StarBase靶基因在线软件预测显示的MEF2D与miR-429的核苷酸序列的结合位点构建MEF2D野生型荧光素酶报告基因载体(wt-MEF2D)和突变型荧光素酶报告基因载体(mut-MEF2D),该过程由上海生工生物工程股份有限公司完成。取对数期细胞将其接种至6孔板中(1.0×105个/孔),当细胞生长密度至80 %时,用LipofectamineTM2000脂质体法,分别共转染miR-429 mimics与wt-MEF2D(miR-429 +wt-MEF2D组)、miR-NC与wt-MEF2D(miR-NC+wt-MEF2D组)、miR-429 mimics与mut-MEF2D(miR-429+mut-MEF2D组)、miR-NC与mut-MEF2D(miR-NC+mut-MEF2D组)至舌鳞癌细胞,转染时间为12 h。更换新鲜培养液,再培养24 h,收集细胞并裂解,于离心半径10 cm的离心机,3500 r/min离心10 min后,取上清,检测荧光素酶活性,结果以萤火虫荧光强度与海肾荧光强度的比值表示。
2 结 果
2.1 miR-429和MEF2D在舌鳞癌中的表达舌鳞癌组织中miR-429的表达低于癌旁组织(P<0.05),MEF2D mRNA的表达高于癌旁组织(P<0.05),且舌鳞癌组织中miR-429和MEF2D mRNA呈负相关(r=-0.992,P<0.05)。见图1,表1。
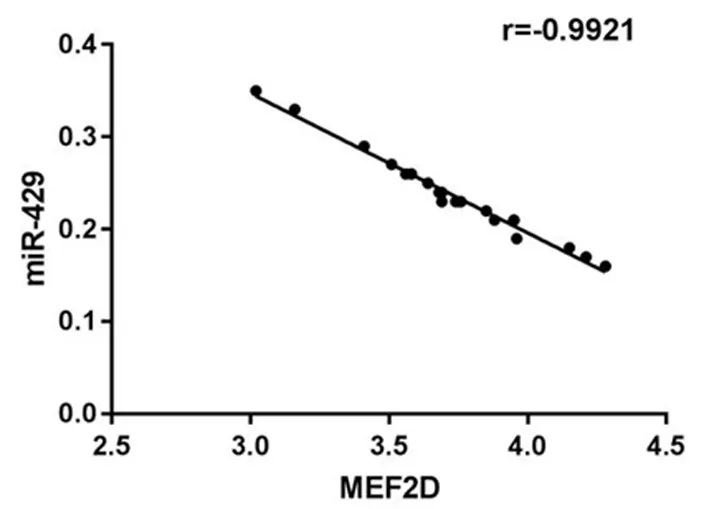
图1 舌鳞癌组织中miR-429与MEF2D mRNA的相关分析Figure 1 There was a negative correlation between miR-429 and MEF2D mRNA in tongue squamous cell carcinoma

表1 舌鳞癌组织中miR-429和MEF2D mRNA的表达水平Table 1 Expression levels of miR-429 and MEF2D mRNA in tongue squamous cell carcinoma
2.2上调miR-429对舌鳞癌细胞增殖、凋亡和迁移的影响miR-429组舌鳞癌细胞中miR-429的表达高于对照组、miR-NC组(P<0.05),而对照组与miR-NC组差异无统计学意义(P>0.05),表明上调miR-429的舌鳞癌细胞构建成功。见表2。miR-429组舌鳞癌细胞凋亡率、p-YAP蛋白表达较对照组、miR-NC组显著升高(P<0.05)。见图2、图3,表2。与对照组、miR-NC组比较,miR-429组舌鳞癌细胞A值、集落形成数和迁移距离、MEF2D蛋白表达显著降低(P<0.05)。见图4,表2。说明上调miR-429抑制舌鳞癌细胞增殖和侵袭,加剧细胞凋亡,并抑制细胞中MEF2D蛋白表达,而激活Hippo/YAP信号通路。
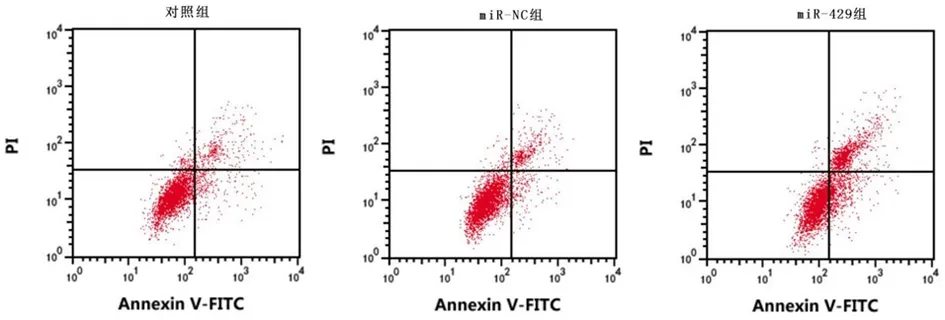
图2 上调miR-429促进舌鳞癌细胞凋亡Figure 2 Up regulation of miR-429 promotes apoptosis of tongue squamous cell carcinoma cells
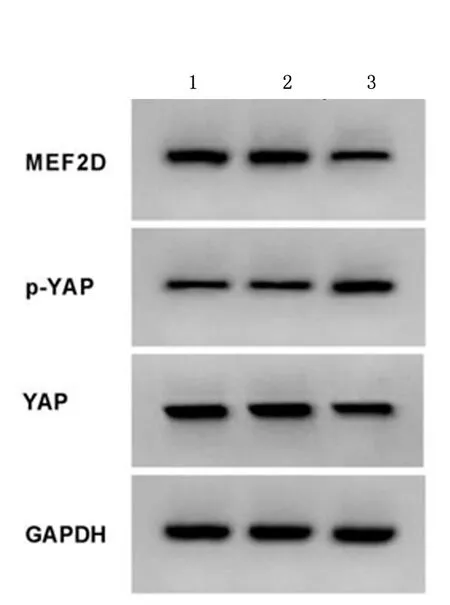
1:对照组; 2:miR-NC组; 3:miR-429组图3 上调miR-429后舌鳞癌细胞中MEF2D蛋白及YAP的表达Figure 3 Up regulation of miR-429 inhibits the expression of MEF2D protein and Yap protein in tongue squamous cell carcinoma cells
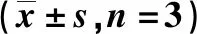
表2 上调miR-429对舌鳞癌细胞增殖、凋亡和迁移的影响Table 2 Effects of up-regulatingmiR-429 on proliferation, apoptosis and migration of tongue squamous cell carcinoma cells

图示miR-429组迁移距离较对照组、miR-NC组显著降低图4 上调miR-429后舌鳞癌细胞迁移情况Figure 4 Up regulation of miR-429 inhibits tongue squamous cell carcinoma cell migration
2.3miR-429靶向结合MEF2DTargetscan靶基因在线软件预测显示,miR-429与MEF2D的3'UTR含有互补的核苷酸序列,见图5。双荧光素酶报告基因实验结果显示,与miR-NC+wt-MEF2D组比较,miR-429+wt-MEF2D组舌鳞癌细胞荧光素酶活性降低[(0.22±0.01)vs(1.03±0.09),P<0.05];与miR-NC+mut-MEF2D组比较,miR-429+mut-MEF2D组舌鳞癌细胞荧光素酶活性无明显变化[(1.03±0.07)vs(1.02±0.08),P>0.05],说明MEF2D是miR-429的靶基因。
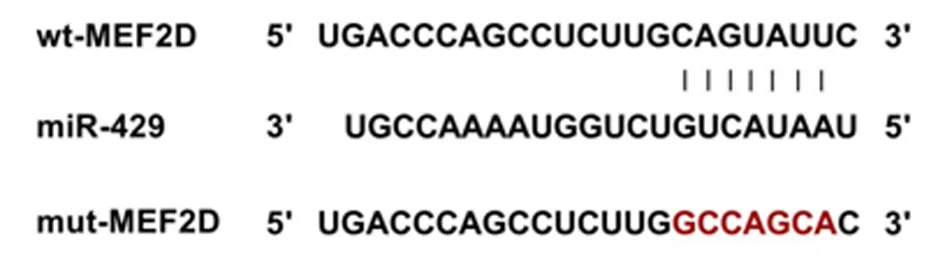
图5 Targetscan靶基因在线软件预测miR-429与MEF2D的3'UTR互补核苷酸序列Figure 5 The effect of down-regulation of MEF2D on the apoptosis of tongue squamous cell carcinoma cells and the expression of p-YAP protein
2.4舌鳞癌细胞中下调或上调MEF2D的效果验证si-MEF2D组舌鳞癌细胞中MEF2D蛋白表达低于对照组、si-NC组(P<0.05),说明下调MEF2D的舌鳞癌细胞构建成功。pcDNA-MEF2D组舌鳞癌细胞中MEF2D蛋白表达(1.04±0.07)明显高于对照组(0.66±0.05)、pcDNA组(0.65±0.05),差异有统计学意义(P<0.05),说明上调MEF2D的舌鳞癌细胞构建成功。见图6。
1:对照组;2:si-NC组;3:si-MEF2D组;4:pcDNA组;5:pcDNA-MEF2D组图6 MEF2D蛋白表达的检测Figure 6 Detection of MEF2D protein expression
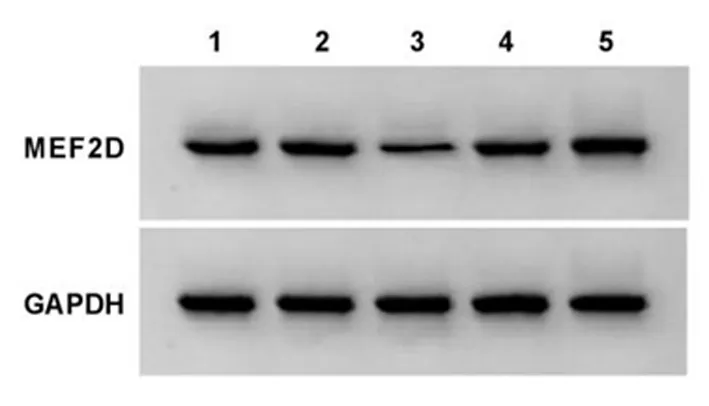
2.5下调MEF2D对舌鳞癌细胞增殖、凋亡和迁移的影响si-MEF2D组舌鳞癌细胞凋亡率、p-YAP蛋白表达较对照组、si-NC组显著升高(P<0.05)。见图7、图8,表3。与对照组、si-NC组比较,si-MEF2D组舌鳞癌细胞A值、集落形成数和迁移距离显著降低(P<0.05)。见图9,表3。说明下调MEF2D抑制舌鳞癌细胞增殖和侵袭,加剧细胞凋亡,并激活细胞中Hippo/YAP信号通路。

图7 下调MEF2D后对舌鳞癌细胞凋亡影响Figure 7 Down-regulation of MEF2D promotes apoptosis of tongue squamous cell carcinoma cells
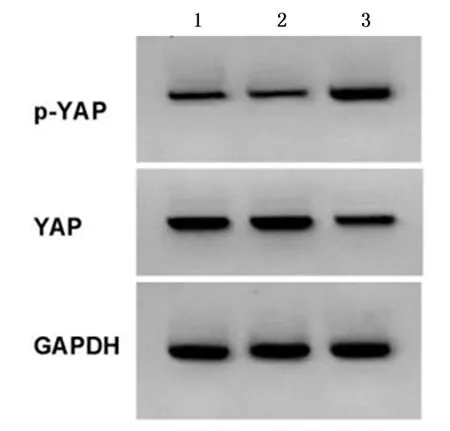
1:对照组;2:si-NC组;3:si-MEF2D组图8 下调MEF2D抑制舌鳞癌细胞中YAP蛋白表达Figure 8 Down-regulation of MEF2D inhibits theexpressionofYAPproteinin tongue squamous cell carcinoma cells
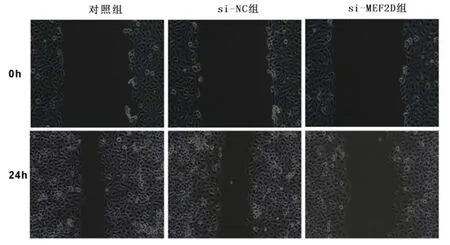
图9 下调MEF2D抑制舌鳞癌细胞迁移Figure 9 Down-regulationof MEF2Dinhibits the migration of tongue squamous cell carcinoma cells
表3 下调MEF2D对舌鳞癌细胞增殖、迁移和凋亡的影响Table 3 Effects of down regulating MEF2D on proliferation, migration and apoptosis of tongue squamous cell carcinoma cells
2.6上调MEF2D降低上调miR-429对舌鳞癌细胞增殖、凋亡和迁移的影响miR-429组舌鳞癌细胞凋亡率、p-YAP蛋白表达较对照组明显升高(P<0.05);miR-429+pcDNA-MEF2D组较miR-429组显著降低(P<0.05)。见图10、图11,表4。与对照组比较,miR-429组舌鳞癌细胞A值、集落形成数和迁移距离显著降低(P<0.05)。与miR-429组比较,miR-429+pcDNA-MEF2D组舌鳞癌细胞A值、集落形成数和迁移距离显著升高(P<0.05)。见图12,表4。说明上调MEF2D降低上调miR-429对舌鳞癌细胞增殖、凋亡和迁移的影响。
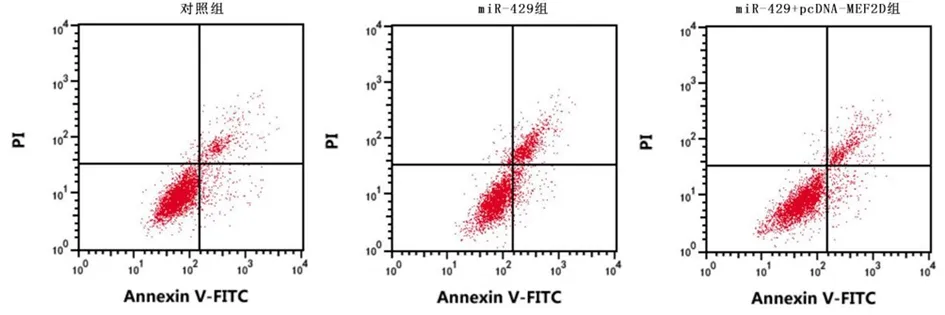
图10 上调MEF2D降低上调miR-429对舌鳞癌细胞凋亡的促进作用Figure 10 Up-regulation of MEF2D reduces the effect of up-regulation of miR-429 on the apoptosis of tongue squamous cell carcinoma cells

1:对照组;2:miR-429组;3:miR-429+pcDNA-MEF2D组图11 上调MEF2D降低上调miR-429对舌鳞癌细胞中YAP蛋白表达的抑制作用Figure 11 Up-regulation of MEF2D reduces the inhibitory effect of up-regulation of miR-429 on the expressionofYAP protein in tongue squamous cell carcinoma cells
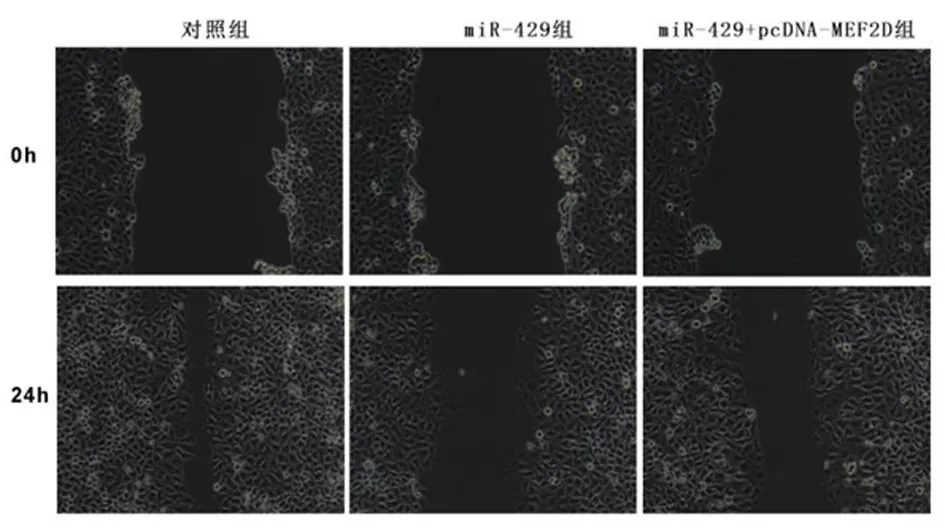
图示miR-429+pcDNA-MEF2D组迁移距离较对照组、miR-429组显著升高图12 上调MEF2D降低上调miR-429对舌鳞癌细胞迁移的的抑制作用Figure 12 Up-regulation of MEF2D reduces the inhibitory effect of up-regulation of miR-429 on the migration of tongue squamous cell carcinoma cells
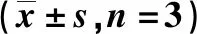
表4 上调MEF2D降低上调miR-429对舌鳞癌细胞增殖、迁移和凋亡的影响Table 4 Up-regulation of MEF2D reduces the effect of up-regulation of miR-429 on the proliferation, migration and apoptosis of tongue squamous cell carcinoma cells
3 讨 论
舌鳞癌的发生发展与原癌基因的激活和抑癌基因的失活密切相关,探究舌鳞癌中异常表达的基因分子及其对该肿瘤发生发展的影响可为其治疗提供分子靶点。miRNA在真核生物中广泛存在,其可通过靶向其靶基因的表达参与调控肿瘤细胞的增殖、凋亡等恶性表型,是肿瘤治疗的潜在分子靶点。研究表明,miR-431-5p[11]、miR-543[12]和miR-138-5p[13]等多种miRNA在舌鳞癌中异常低表达,对舌鳞癌的发展起抑制作用;而miR-21-5p[14]、miR-17-5p[15]等miRNA在舌鳞癌中表达升高,促进舌鳞癌细胞的恶性生物性行为,进而促进对舌鳞癌的发展进程。这些研究结果表明,不同的miRNA在舌鳞癌中发挥的作用不同。
作为一种miRNA,miR-429参与多种肿瘤的发展进程。研究显示,结直肠癌组织中miR-429表达下调,上调其表达可通过靶向抑制HMGB3来抑制结直肠癌细胞增殖,并促进细胞凋亡,miR-429/HMGB3轴在结直肠癌中具有特定的肿瘤抑制功能[16];miR-429可通过靶向FN1抑制Wnt/β-catenin信号通路,降低乳腺癌细胞的增殖和侵袭能力[17];miR-429在骨肉瘤组织和细胞系中表达下调,其可通过靶向HOXA9进而抑制Wnt/β-catenin信号通路的激活来抑制骨肉瘤的发展进程[18]。本研究结果显示,舌鳞癌组织中miR-429表达降低,上调其表达可阻碍舌鳞癌细胞增殖和迁移,而促进细胞凋亡,这与Ma等[19]报道的结果一致,提示miR-429对舌鳞癌发展起抑制作用,其可能成为舌鳞癌治疗的分子靶点。
为了进一步探究miR-429调控舌鳞癌细胞增殖、凋亡和迁移的分子机制,本研究证实了MEF2D是miR-429的靶基因。此外,上调miR-429抑制了舌鳞癌细胞中MEF2D的表达,进而说明了miR-429靶向负调控MEF2D,且与本研究结果舌鳞癌组织中miR-429与MEF2D mRNA表达呈负相关的结果一致。研究显示,miR-335的过表达可通过靶向MEF2D降低胆囊癌细胞活力和集落形成能力,并阻滞细胞周期进程[20];miR-30a在肺癌中表达降低,这引起其靶基因MEF2D表达的增加,进而促进肺癌细胞增殖,加速肺癌发展进程[21]。本研究结果显示,舌鳞癌组织中MEF2D表达升高,通过下调MEF2D表达可显著降低舌鳞癌细胞的增殖和迁移能力,并诱导细胞凋亡。本研究结果还显示,上调MEF2D降低了上调miR-429对舌鳞癌细胞增殖和迁移的抑制作用及凋亡促进作用,进而提示miR-429通过靶向抑制MEF2D的表达来抑制舌鳞癌细胞恶性表型。
Hippo/YAP信号通路是参与调控细胞增殖、凋亡和迁移等生命活动的重要通路,其主要组成部分包括Mst1/2、Sav1、Mob1和Lats1/2系列的核心激酶链及下游核心效应因子Yes相关蛋白(YAP)。YAP是一个癌基因,其不直接与DNA结合而发挥生物学作用,而是在进入细胞核后与特定的转录因子TEAD结合,然后启动下游癌基因转录,进而发挥恶性生物学行为[22]。正常生理状态下,Hippo/YAP信号通路处于激活状态,系列的激酶作用使YAP磷酸化,并与细胞质中的蛋白结合滞留在细胞质中或被泛素化降解,从而抑制YAP下游作用的癌基因表达,进而抑制细胞的生长和转移等恶性生物学行为[23]。有报道称,circ_0128846可通过降低miR-1184的表达,从而增加AJUBA的表达并使Hippo/YAP信号通路失活,从而促进结直肠癌的发展[24]。本研究结果显示,上调miR-429或下调MEF2D均可促进舌鳞癌细胞中YAP的磷酸化水平,而上调MEF2D逆转了上调miR-429对舌鳞癌细胞中YAP磷酸化的促进作用,提示miR-429通过靶向MEF2D进而激活Hippo/YAP信号通路来抑制舌鳞癌细胞的恶性表型。
综上,miR-429在舌鳞癌组织中表达降低,上调其表达能够降低舌鳞癌细胞的增殖和迁移能力,并诱导舌鳞癌细胞凋亡,其作用机制可能与靶向抑制MEF2D进而激活Hippo/YAP信号通路有关,miR-429/MEF2D/Hippo/YAP轴可能为舌鳞癌的治疗提供了新的途径。但本研究尚需通过裸鼠移植瘤实验在体内验证miR-429/MEF2D/Hippo/YAP轴对舌鳞癌发生发展的影响。

