产KPC铜绿假单胞菌的耐药分子机制及其临床分布
陈 勇,史利宁,胡毓安,曹 进,孙 宁,姚新月,张 静,王 颖,范 明,王卫萍
0 引 言
铜绿假单胞菌(Pseudomonas aeruginosa ,PA)是医院内感染的重要病原菌,随着碳青霉烯类药物的广泛和不合理使用,耐碳青霉烯PA日益增多[1-2],尤其是多重耐药甚至是泛耐PA的数量和比例迅速上升[3],给PA所致的感染的治疗带来了极大的困难[4-6]。临床现有可选抗菌药物少,治疗难度高,严重影响患者的转归。由PA所引起的医院内感染达30%[7],其中呼吸道感染率最高,死亡率可高达61.1%[8]。PA碳青霉烯耐药主要与OprD2孔蛋白缺乏相关[9]。但研究人员对全球碳青霉烯耐药PA的流行病学发现,产碳青霉烯酶的PA所占比例正急剧增高[10],不同的酶其流行的区域不同。本文收集了泛耐药PA,调研碳青霉烯酶的存在情况,并对其耐药分子机制及其临床分布进行探讨,为预防和控制耐药菌株的传播以及临床治疗提供理论依据。
1 材料与方法
1.1 菌株来源收集了东部战区总医院2018年7-12月的临床首次分离的泛耐药PA112株,-20 ℃冻存待用。
1.2主要试剂和仪器BHI培养基(英国OXOID公司)、MiSeq测序仪(美国Illumina公司)、DNA Marker2000(上海慧颖公司)、Qiagen Large-Construct Kit(德国QIAGEN公司)、PCR仪(美国ABI公司)、琼脂糖凝胶电泳仪(深圳博伟尔公司)、凝胶成像系统(英国Syngene公司)。
1.3菌株鉴定用16S rRNA进行菌种鉴定,在BHI平板上挑取单个菌落,置于100 μL的去离子水中,100 ℃ 10 min 裂解菌体,13 000×g离心1 min,取上清作为模板,16S rRNA基因扩增参考文献[11]进行,PCR扩增产物送去上海英捷维基公司测序。
1.4碳青霉烯酶的检测及其类型用改良Carba NP 法检测碳青霉烯酶及其类型[12-13]。取甘油菌接种于新鲜的肉汤,37 ℃、200 r/min培养至A600值约1.0,取1 mL菌液4 ℃离心集菌,用20 mmol/L Tris-HCl(pH7.8)清洗2遍后,用500 μL 20 mmol/L Tris-HCl(pH 7.8)重悬菌体,在冰浴中超声5 s,后4 ℃下10 000×g离心5 min ,取50 μL上清分别与底物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ混合,37 ℃孵育1~2 h检测碳青霉烯酶及其类型。底物Ⅰ为酚红+硫酸锌,底物Ⅱ为亚胺培南+酚红+硫酸锌,底物Ⅲ为亚胺培南+酚红+硫酸锌+他唑巴坦,底物Ⅳ为亚胺培南+酚红+硫酸锌+EDTA,底物Ⅴ为亚胺培南+酚红+硫酸铵+他唑巴坦+EDTA。
1.5碳青霉烯酶基因的检测用PCR法检测碳青霉烯酶基因。根据文献查阅各种碳青霉烯酶耐药基因引物信息,部分引物序列见表1,以PA全基因组DNA为模板,进行PCR扩增。PCR条件为:95 ℃ 5 min;94 ℃ 40 s,50 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR产物过1.5%琼脂糖凝胶电泳。
1.6质粒测序与生物信息学分析使用QiagenLarge-Construct Kit从PA14057中提取质粒DNA[14],并将携带blaKPC基因的质粒命名为p14057-KPC。用高通量全基因组测序技术对质粒进行测序,用RAST 2.0与UniProtKB/Swiss-Pro数据库和RefSeq数据库进行BLAST搜索,预测开放阅读框(ORFs)和假基因。 用BLASTP和BLASIN对UniProt和NR库进行注释。 用Inkscape 0.48.1绘制基因结构图,对测序的质粒全序进行生物信息学分析,绘制质粒图谱。
1.7质粒同源性分析根据上述质粒测序结果,针对质粒骨架区(复制区、稳定区和接合区)分别设计三个引物,见表2;并对其他产KPC的PA进行质粒同源性分析。PCR条件为:95 ℃ 5 min;94 ℃ 40 s,50 ℃ 40 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。PCR产物过1.5%琼脂糖凝胶电泳。
2 结 果
2.1 菌株鉴定经16S rRNA菌种鉴定,收集112株 均为PA。
2.2CarbaNP产酶实验112株中20株产A类碳青霉烯酶,占17.9%。5株产B类碳青霉烯酶,占4.46%。
2.3碳青霉烯酶基因的检测产A类碳青霉烯酶的20株菌均检出blaKPC基因,与CarbaNP产酶实验结果相一致。5株产B类碳青霉烯酶中,有2株检出blaIMP、基因,未检出blaVIM、blaDIM、blaSIM基因。blaKPC基因PCR结果见图1。
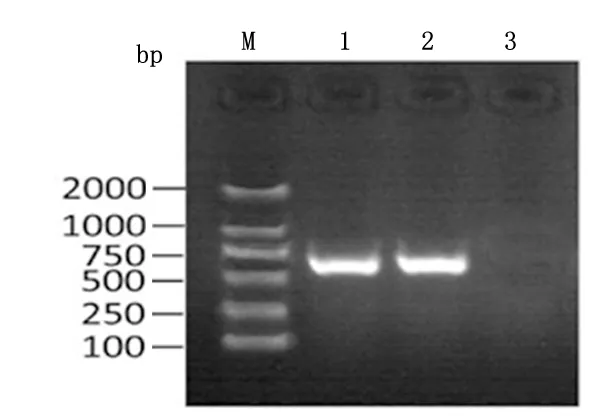
M:DNA marker;1、2:产A类碳青霉烯酶的菌株,编号分别为14057,21005;3:不产A类碳青霉烯酶的菌株,编号为15012图1 碳青霉烯酶基因检测结果Figure 1 Carbapenemase gene test results
2.4p14057-KPC质粒全序测定与生物信息学分析
2.4.1 p14057-KPC的概述运用高通量测序[15],该质粒大小为51 663 bp的环状DNA,平均G+C含量为59.2%,含有69个开放阅读框,由骨架区和外源插入区两部分组成。骨架区长度约为40.6 kb ,与公共序列数据库中可用的DNA序列相似性较低(同源性<20%),含有复制区(repA)、稳定区(potF等)和接合区(virB6等)。该质粒含有单个外源插入区,即blakpc-2区域。见图2。

基因由箭头表示,骨架区和外源插入区分别以黑色和灰色突出显示图2 p14057-KPC示意图Figure 2 Schematic map of p14057-KPC
2.4.2p14057-KPC的外源插入区外源插入区即blakpc-2区域。按顺序分别由3.5 kb 的Tn1403骨架区,6.5 kb的ΔTn6296区和IS6100元件构成。见图3。

基因用箭头表示。 基因,移动元素和其他功能基于功能分类进行着色。 阴影表示同源区(> 95%核苷酸同一性)。 括号中的数字表示相应质粒内的核苷酸位置。 用于参考的Tn6296和Tn1403的登录号分别是FJ628167和AF313472图3 p14057-KPC的外源插入区,并与相关遗传内容进行比较Figure 3 The accessory regions of p14057-KPC and comparison to related genetic contents
2.5质粒同源性分析结果显示:产KPC的20株菌中有17株菌与p14057-KPC相似质粒结构,占85%,其余菌株有待进一步研究。见图4。

1、2:均为产KPC的菌株,编号分别为14057,21005; M:DNA marker图4 质粒同源性分析Figure 4 Plasmid homology analysis
2.6产KPC PA的临床分布共20株菌产KPC,占17.9%。其中ICU 病房16株,占80.0%;非ICU 病房4株,占20.0%。
3 讨 论
KPC型碳青霉烯酶首次报道于1996年美国的一株肺炎克雷伯菌,2005年法国、以色列和哥伦比亚等许多国家和地区也报道了产KPC酶的细菌的产生,产KPC酶的细菌在世界各地相继流行和播散。2006年哥伦比亚首次报道了产KPCPA,接着在波多黎各,美国和中国有出现,且分离率越来越高。
从我院数据来看,17.9%的泛耐药PA检出blaKPC,提示产KPC酶已成为泛耐药PA对β-内酰胺类药物耐药的重要原因。其中ICU 病房16株,占80.0%;非ICU 病房4株,占20.0%。
blaKPC基因既可存在于质粒上,从NCBI GenBank数据库(https://www.ncbi.nlm.nih.gov/nuccore)检索结果显示,携带blaKPC基因的PA质粒有5个,其中2个为IncP-6,2个为IncU,1个为未知分型。为进一步探究我院产KPC酶PA的分子耐药机制,我们选择了编号为14057的菌株,提取质粒,并对其质粒进行了全序测定。结果显示,该质粒全长 51 663 bp,有69个开放阅读框[15](ORFs),平均GC含量59.2 %,与数据库中现存序列同源性<20%,为一个全新的质粒。仅带有blaKPC-2一个耐药基因,序列分析确认为blaKPC-2亚型。对耐药区域的详细分析发现,p14057-KPC质粒的blaKPC-2区域由Tn1403核心转座模块、△Tn6296和一个IS6100构成。Tn1403是PA的一个多药耐药转座子,带有In28和Tn5393c。Tn6296来自中国的一个带blaKPC-2基因的肺炎克雷伯菌质粒,其中△Tn3:ISKpn27到△repB为blaKPC-2核心区。Tn1403和Tn6296均属于Tn3家族Tn21亚群。因此,来自Tn6396的blaKPC-2核心区和Tn1403的核心转座模块tnpA-tnpR区域通过同源重组形成了p14057-KPC质粒的blaKPC-2区域。
根据p14057-KPC测序结果,针对质粒骨架区(复制区、稳定区和接合区)分别设计三个引物对其他产KPC的铜绿假单菌进行同源性分析,发现有17株菌与p14057-KPC相似质粒结构,其中ICU病房16株,神经外科1株。有2株(泌尿外科)未检出,有待进一步研究。
综上所述,产KPC酶是PA对β-内酰胺类药物耐药的另一耐药机制,PA中带blaKPC-2基因质粒的出现,提示这种耐药特性将如同其在肠杆菌科一样在PA中播散。通过对产KPC酶PA的耐药分子机制的研究,对指导临床用药和控制医院感染具有重要意义。

