温敏型生物材料羟丁基壳聚糖的辐射裂解研究
林福星 戴婧婷 罗菊香 张建汉


【摘 要】 壳聚糖毒性很低、生物相容性很好,同时又能夠在生物体内降解,而受到学者们的关注。然而壳聚糖的水溶性太差,使得应用研究很难开展。本文研究证实,裂解后HBC的分子量明显降低,而MTT细胞实验证实,裂解后HBC的细胞毒性依然很低,完全可以应用于生物材料领域。本课题为温敏型生物材料HBC在生物、医学等领域的推广应用提供了坚实的基础。
【关键词】 生物材料;壳聚糖;辐射裂解;分子量;细胞毒性
【中图分类号】 Q356.1 【文献标识码】 A 【文章编号】 2096-4102(2021)03-0097-03
壳聚糖是脱乙酰度(脱去乙酰基的葡萄糖胺单元数占总单元数的比例)在55%以上的甲壳质的总称。壳聚糖具备了低细胞毒性、优异的生物相容性、自然生物可降解性等优良性能,在生物材料领域的应用中具备极大的潜力。
在分子结构上,由于壳聚糖链上众多的羟基(-OH)以及氨基(-NH2)等基团很容易形成氢键,因此,壳聚糖的溶解性非常差。容易发生聚沉,稳定的溶液浓度较低。通常,壳聚糖溶液的质量分数只能是1%-3%。
壳聚糖的应用在食品、化妆品等行业很常见,然而,壳聚糖的应用性能始终受限于溶解性,存在明显的瓶颈。为了解决这个难题,本课题组设计改性并报道合成了一种亲水性壳聚糖——羟丁基壳聚糖(HBC)。实验结果证实,HBC在溶解性上有了比较大的提升。
由于生物材料在应用过程中,经常会用到辐射灭菌技术,以保证生物材料的安全性能。因此,对于生物材料HBC而言,他们的抗辐射稳定性需要进行一定的探索,并且研究他们在辐照过程中的变化。
本研究通过之前报道的方法将羟丁基键合到壳聚糖的羟基和氨基上,成功合成了HBC。为了验证HBC的辐射稳定性以及辐射产物的安全性,将HBC溶液放置在60Coγ-ray的辐照下进行一定剂量(分别是0kGy,1kGy,2kGy,3kGy,5kGy,10kGy,)的辐照。之后对辐照制备的样品进行后续的分析,包括分子量的测定和细胞毒性的研究。研究结果证实,经过辐照裂解过程之后,HBC分子量有所降低,且降低的程度与辐照剂量呈现正相关。另外,细胞毒性MTT实验显示,经过辐照裂解后的HBC毒性非常低,哪怕在10ug/mL的浓度下,细胞存活率依然在93.3%。这充分说明了HBC对细胞的生长没有毒性作用,是非常良好的生物材料。这为HBC在生物、医学等领域的推广应用提供了坚实的基础。
1材料与方法
1.1材料
壳聚糖(分子量Mw=2.0×105Da,脱乙酰度≧90%)以及1,2-环氧丁烷购自阿拉丁化学试剂有限公司。聚乙酰亚胺(PEI)来自美国赛默飞世尔科技有限公司。氢氧化钠(片状,97.0%-100%)、异丙醇(99.7%)、丙酮(99.5%)购自医药集团化学试剂有限公司。
细胞毒性实验使用的3-(4,5-二甲基噻唑-2)-2,5-二苯基氮唑溴盐(MTT)由碧云天生物科技有限公司提供,人宫颈癌细胞(Hela)培养在37oC以及含5%CO2的空气中。胎牛血清从浙江天杭生物科技股份有限公司购买,青霉素-链霉素从美国英杰生物试剂有限公司购买,并添加在DMEM全培养基中。
本实验中所使用的水均为去离子水,且上述试剂均为即买即用。
1.2 HBC的制备过程
HBC的制备原理如图1所示。
首先,称取25gNaOH片状固体加入100mL烧杯,倒入50mL水并快速搅拌,待片状固体全部溶解后通氮气15min。随后,取4g壳聚糖粉末加入上述的NaOH溶液中继续搅拌,通氮气15min。过滤,并用水洗至pH=7。之后,将滤纸上的固体加入到异丙醇/水混合溶液(V∶V=9∶1)中,并搅拌反应24h。接着,将1,2-环氧丁烷加入上一步的溶液,并继续通氮气15min,搅拌反应4d。然后,用丙酮沉淀并离心。将离心下来的沉淀物用水超声洗涤,再离心分离,直至pH=9,真空干燥24h。
1.3不同吸收剂量的辐照后羟丁基壳聚糖的制备(HBC-X,X表示辐照过程中的总吸收剂量)
为了研究羟丁基壳聚糖在辐照过程的性能变化,需要将HBC溶液置于辐射源的辐照下。首先,用天平称取10mg的羟丁基壳聚糖粉末溶解在上述的10mL浓度为0.1mol/L乙酸溶液中,超声溶解,并通氮气10min。之后,将羟丁基壳聚糖溶液样品置于60Coγ-ray下辐照,剂量率为8.3Gy/min。控制不同的吸收剂量,得到不同的辐照后羟丁基壳聚糖(HBC-X)。
1.4 HBC-X的分子量测定
为了探究HBC溶液在辐照过程中变化,通过黏度法在25±0.1℃对不同吸收剂量辐照后的HBC样品分子量进行测定。纯溶剂的流出时间以1%的醋酸溶液在乌氏黏度计内的流出时间t0计算。在测试过程中,每个流出时间的测定都需要进行3次取平均值,且3次测量结果之间的极差不超过0.5s。接着,测定吸收不同剂量辐照的HBC样品(HBC-0、HBC-1、HBC-2和HBC-3、HBC-5、HBC-10)的设置浓度梯度溶液(1、2/3、1/2)的流出时间,分别记为t1、t2和t3,然后根据设置浓度梯度的羟丁基壳聚糖溶液的流出时间(t1、t2和t3)和纯溶剂的流出时间(t0),分别计算不同吸收剂量辐照后的HBC溶液的增比黏度?sp和相对黏度?r。最后,通过?sp/c和ln?r/c分别对HBC溶液的浓度c作图,外推可得不同HBC溶液的特性黏度[?],并通过公式1计算不同吸收剂量辐照后HBC的分子量。
[?]=K·Mα 公式1
公式1中,[?]是测得的特性黏度,K=1.8×10-3cm3·g-1,α=0.93,均为常数。
1.5 HBC-X的细胞毒性研究
为了体现HBC-X的细胞毒性水平,本次实验选用常用的生物材料PEI作为对照,通过MTT细胞毒性实验来表征测定。首先,以每孔5000个的密度在96孔细胞培养板上进行Hela细胞的培养,每孔添加200?L的含10%FBS、1%青霉素-链霉素的培养基,37oC下生长15h。之后让细胞在100?L分别包含了HBC-0、HBC-1、HBC-2、HBC-3和PEI材料的全培养基中,保持温度37℃的5%CO2培养箱中生长48h。同时,一组添加100?L不含其他材料的细胞在纯培养基中的自然生长设置作为空白对照。Hela细胞培养48h之后,将所有孔的培养液替换为20?LMTT溶液(5mg/mL),继续4h的孵化。结束后,每个孔中加入150?L的DMSO。最后,通过酶标仪(美国博腾仪器有限公司)测定各个孔中细胞在490nm波长的吸光度。各种材料不同浓度的细胞毒性都可以通过细胞存活率来体现,细胞的存活率(Cellviability)通过公式2来计算。
[Cell viability%=AsampleAcontrol×100%] 公式2
公式2中,Asample和Acontrol分别代表材料测试组与所设置的空白对照组的细胞在490nm波长的吸光度值。
2实验结果
2.1 HBC-X的制备
从图1中可以很清楚地看到,没有接受辐照的HBC溶液,是澄清无色的。经过1kGy的吸收剂量的辐照,HBC样品溶液的颜色变成了图中中间的浅黄色。而随着吸收剂量的增大,壳聚糖溶液的颜色越来越少,当HBC溶液样品被γ-ray辐照时,葡萄糖胺和N-乙酰葡萄糖胺单元的β(1-4)糖苷键断裂,使得HBC的主链发生了链断裂。另外,辐照过程通常伴随着一些氧化反应,产生含大量的羰基和羧基,导致了整个溶液的颜色变黄。
2.2 HBC-X的分子量
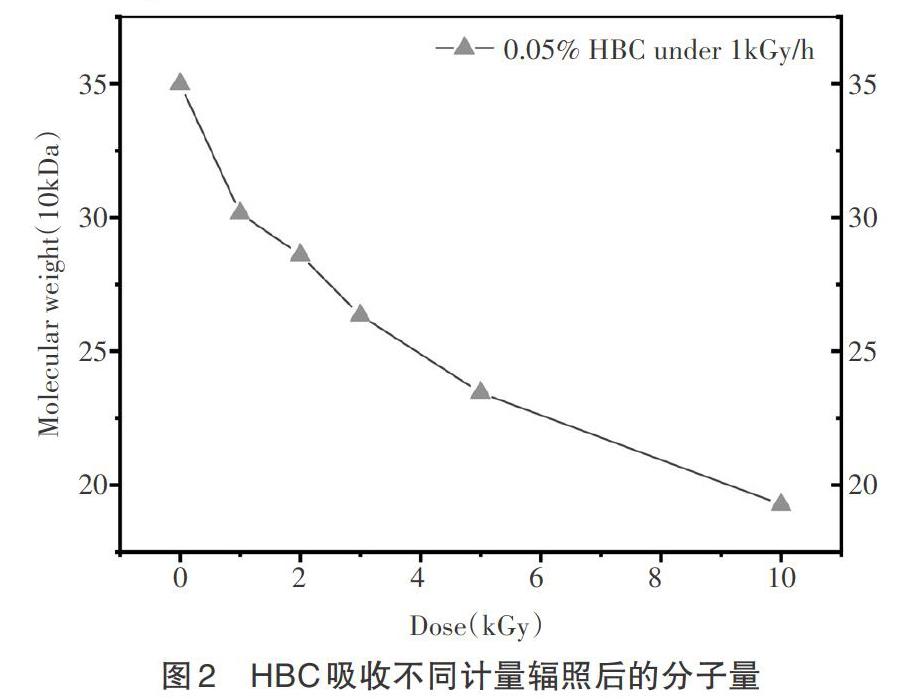
烏氏黏度计法测得辐照后HBC溶液样品的分子量如图2所示。
不同吸收剂量辐照过后的HBC样品测得的分子量,相比于原来的HBC-0,都有所降低。从图2上最左边,辐照之前的HBC-0组,分子量为35.0×104g·mol-1。吸收剂量为1kGy时,HBC样品的分子量已经降为HBC-1的30.16×104g·mol-1。要是剂量加大到3kGy,分子量就只剩下26.34×104g·mol-1。而HBC-10这组材料,吸收剂量10kGy的时候,壳聚糖降解更加的明显,分子量仅为19.27×104g·mol-1。HBC样品辐照后的分子量降低,说明辐照过程中被一定程度降解。并且可以看到这样的规律,随着吸收剂量的增加,降解的程度越高,分子量降低越发明显。
2.3 HBC-X与PEI的细胞毒性探究
对于吸收不同计量的辐照之后的产物(HBC-0、HBC-1、HBC-2、HBC-3)和PEI在不同浓度下的细胞毒性通过MTT法进行表征,结果如图3所示。
HBC-0组,也就是未经过辐照的羟丁基壳聚糖,细胞存活率都接近100%,即使浓度增大很多倍,细胞存活率也没有明显的降低。对于吸收一定剂量辐照之后的HBC,在0.5μg/mL的浓度下,HBC-1、HBC-2和HBC-3的细胞存活率分别是99.5%,97.3%和93.3%,远高于PEI组的60.8%。当HBC样品浓度从0.5μg/mL增大到10μg/mL,细胞存活率虽然有所降低,但是依然呈现比较健康的态势。而对HBC-2和HBC-3来说,虽然比HBC-0和HBC-1略有降低,但也呈现一样的趋势。而之所以细胞存活率有些许降低,可能是辐照过程中所产生的含羰基以及羟基的产物给细胞带来影响,而在相同的情况下,对比PEI组,它们的毒性非常惊人。PEI组即使在只有1μg/mL浓度下,大部分的细胞都会被杀死,假如PEI的浓度达到10μg/mL,那么,大多数细胞都会死亡,只剩下10%左右的细胞。这样的对比,也有力地体现了HBC作为生物材料的低细胞毒性,比起剧毒的PEI有更加广阔的临床应用前景。
3讨论
本文研究结果表明,羟丁基壳聚糖作为一种壳聚糖的衍生物,在具备温敏等其他功能的同时,辐射相关的性质依然比较优秀。虽然在辐照过程中,分子量会有少量的降低,但是如果辐照过程的吸收剂量不大的话,分子量降低程度较小。此外,HBC辐照之后的产物,依然具有非常低的细胞毒性,不会干扰Hela细胞的正常生长。因此,HBC作为一种温敏型生物材料的应用是比较可靠的。
【参考文献】
[1]廖振胜,张娜,杨宇成,等.多糖溶解性改善方法研究进展[J].食品与发酵工业,2020,46(24):292-299.
[2]金洹宇,银华,安艳.辐射技术在医用生物材料领域中的应用[J].辐射研究与辐射工艺学报,2011,29(5):261-265.
[3]黄伟,王英杰,张爽,等.γ-射线辐射可控改性壳聚糖用于药物释放研究[C].中国核学会.第十一届全国核化学与放射化学学术讨论会,北京:中国核学会,2012.
[4]唐振兴,石陆娥,易喻.壳聚糖及其降解物分子量的测定[J].化工技术与开发,2004,33(6):38-39.

